结核分枝杆菌多表位诊断抗原的制备
高健,赵鼎
结核分枝杆菌多表位诊断抗原的制备
高健1, 2, 3,赵鼎1, 2, 3
1 郑州大学附属儿童医院 检验科, 河南 郑州 450000 2 郑州儿童医院 检验科,河南 郑州 450000 3 河南省儿童医院 检验科,河南 郑州 450000

高健, 赵鼎. 结核分枝杆菌多表位诊断抗原的制备. 生物工程学报, 2019, 35(4): 718–725.Gao J, Zhao D. Preparation of multi-epitope recombinant diagnostic antigen of Mycobacterium tuberculosis. Chin J Biotech, 2019, 35(4): 718–725.
将结核分枝杆菌 (,Mtb) 多个B细胞预测表位串联表达 (命名为B102),并初步评价其作为诊断抗原的血清学诊断价值。将Mtb PstS1、ESAT6、CFP10、Ag85B、Ag85A及PPE54等6个蛋白的11个B细胞预测表位串联,加入合适的连接臂后全基因合成;将多表位片段插入带有TRX标签的表达质粒中,在大肠杆菌BL21 (DE3) 中诱导表达,并利用Ni2+-Chelating亲和层析和DEAE阴离子交换层析纯化目的蛋白;利用Western blotting (WB) 技术对目的蛋白抗原性进行鉴定,并建立Mtb抗体检测竞争法ELISA技术,初步评价此方法对阴阳血清样本的鉴别能力。目的蛋白以包涵体形式存在,其表达量约占菌体总蛋白的31.25%,经纯化及复性后蛋白B102可溶性存在,浓度为3.124 mg/mL,纯度为96.71%;WB实验表明目的蛋白能与Mtb阳性血清相应抗体发生反应。对60份Mtb阳性血清及60份Mtb阴性血清进行检测得出其灵敏度为90.00%,特异性为93.33%,阳性预测值为93.10%,阴性预测值为90.32%,符合率为91.67%,McNemer检验的结果提示与“金标准”诊断结果无差异,Kappa=0.833,提示两种方法诊断结果一致性优异。原核表达与层析纯化可以获取抗原性优异的Mtb多表位诊断抗原,作为诊断抗原可以应用于Mtb的血清学检测中。
多表位抗原,结核分枝杆菌,原核表达,层析纯化,血清学诊断
结核病(Tuberculosis,TB) 严重危害人类健康,我国是全球第三大结核病高负担国家[1],随着耐药结核日趋严重,结核病的预防控制势在必行。缺乏理想的诊断技术是其防控的主要难题。目前结核病的诊断以细菌学检查为“金标准”,主要包括痰涂片镜检法与痰结核菌培养法,但存在对样本质量要求高、涂片灵敏度低、培养耗时长、操作误差较大、不易标准化且无法区分非结核分枝杆菌等问题[2]。皮肤结核菌素试验很难将结核菌活动感染和潜伏感染以及卡介苗(Bacillus Calmette-Guérin,BCG) 免疫个体区分开来[3]。分子检测技术如PCR、核酸探针、生物芯片、蛋白芯片等技术操作复杂,对检测仪器依赖性高,需要专业技术人员,不适宜用于大样本检测[4]。结核分枝杆菌(,Mtb) 免疫学诊断技术由于简便、快捷、成本低、灵敏性和特异性较高广泛用于结核病的早期诊断[5]。目前市面上血清学诊断试剂盒敏感性和特异性存在很大差异,分别为10%–90%和47%–100%[6]。因此筛选结核分枝杆菌高灵敏性和高特异性抗原成分,是解决结核病早期发现、快速诊断的关键途径。研究发现,单独使用一种Mtb蛋白,由于单一抗体含量低或/和单一抗原分期出现,诊断价值不高[7–9]。也有研究表达多个蛋白,将其混合后作为诊断抗原,大大提高其诊断价值[10-12]。本研究根据筛选出通过基因工程技术表达Mtb PstS1、ESAT6、CFP10、Ag85B、Ag85A及PPE54等6个蛋白的11个B细胞预测表位串联表达,并采用Western blotting和ELISA技术对其抗原性及诊断潜能进行初步评价,以期为结核病早期诊断和疫苗研制提供依据。
1 材料与方法
1.1 主要材料与试剂
大肠杆菌BL21 (DE3) 感受态细胞及TRX载体购自北京全式金生物技术有限公司。限制性内切酶Ⅰ和Ⅰ以及T4 DNA连接酶购自美国NEB公司。TMB底物溶液购自天根生化科技有限公司。Chelating Sepharose Fast Flow和DEAE Sepharose Fast Flow层析介质购自美国GE公司。Goat anti-human IgG-HRP conjugate均购自美国Merck Millipore公司。Mtb阳性血清60份分别来自河南省儿童医院(34份)、郑州大学附属儿童医院(20份) 及郑州儿童医院(6份) 结核病患者(年龄3–27岁),阴性血清60份为普通门诊血样(年龄2–19岁) 由河南省儿童医院提供。阴阳性血清样本都经过临床和实验室确诊,以肺结核患者痰细菌学检测结果(痰涂片和/或痰培养阳性)、影像学结果、结核菌素试验结果及核酸检测结果为金标准,即4项皆为阳性结果定为阳性血清,4项皆为阴性结果定为阴性血清。
1.2 表达质粒B102的构建
根据参考文献[7],将Mtb Pst1 aa 58–73 & aa 176–206 & aa 337–362、ESTA6 aa 15–30 & aa 44–59、CFP10 aa 18–33 & aa 60–84、Ag85B aa 119–134、Ag85A aa 214–230以及PPE54 aa 422–438 & aa 1825–1851用GGGS连接臂进行串联,然后根据大肠杆菌密码子偏好表优化基因并在5′端添加Ⅰ酶切位点序列,3′端添加Ⅰ酶切位点序列,最后交由TaKaRa全基因合成(将基因片段命名为B102F)。用限制性内切酶Ⅰ和Ⅰ处理包含B102F的pMD19-T-B102F质粒(全基因合成产物),将B102F酶切下来,连接到相同酶切处理的TRX表达载体上,转化BL21 (DE3) 感受态细胞。次日挑取单克隆菌落进行小量诱导表达,提取阳性表达克隆质粒进行测序和双酶切鉴定。鉴定正确的质粒命名为B102质粒。
1.3 蛋白B102的制备
将转化B102质粒的BL21 (DE3) 接种于含氨苄霉素(50 μg/mL) 的LB培养基(10 g/L 蛋白胨,5 g/L酵母提取液,10 g/L NaCl) 中,培养适当时间后IPTG诱导表达目的蛋白(34 ℃, 4 h, 2 L)。离心收集表达菌(4 000 r/min,8 min,10 ℃)。用缓冲液A (20 mmol/L Tris-HCl,0.3% Triton X-100,pH 8.0) 重悬表达菌后用超声仪破碎(功率250 W,超声工作时间10 s,间歇时间20 s,共40个循环),离心(12 000 r/min,8 min,10 ℃)弃去上清。沉淀再次用缓冲液A重悬后离心回收(10 000 r/min,8 min,8 ℃)。用5 mL双蒸水重悬沉淀,逐滴加入到缓冲液B (20 mmol/L Tris-HCl,7 mol/L盐酸胍,pH 8.0) 中并不断搅拌直至溶液澄清。离心(12 000 r/min,8 min,8 ℃) 收集上清。将此上清上样于用缓冲液B平衡的Chelating Sepharose Fast Flow层析介质中。首先用60 mmol/L咪唑(溶于缓冲液B中) 进行洗脱,然后用缓冲液C (20 mmol/L Tris-HCl,8 mol/L尿素,pH 8.0)再次平衡层析介质,然后用300 mmol/L咪唑(溶于缓冲液C中) 进行洗脱。取300 mmol/L洗脱液于缓冲液C中进行透析去掉咪唑成分。DEAE Sepharose Fast Flow层析介质用缓冲液C平衡后上样,分别用0、100、200、400 mmol/L NaCl (溶于缓冲液C中) 进行梯度洗脱并收集相应洗脱液。分别取样SDS-PAGE检测目的蛋白的含量以及分布情况。将目的蛋白含量最高。纯度最好的洗脱液于PBS (137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH 7.4) 中彻底透析后,于4 ℃保存备用。
1.4 蛋白B102的Western blotting分析
上样10 μL蛋白B102溶液在13.5% SDS-PAGE中电泳(恒流35 mA,60 min),然后转膜至硝酸纤维素膜(NC) 上(恒压12 V,35 min)。室温,封闭液(3%脱脂奶粉溶解于PBST)处理NC膜2 h。加入封闭液稀释的Mtb阳性血清(1∶20)、Mtb阴性血清(1∶20),常温孵育1 h后用PBST洗膜5次。检测抗体都为Goat anti-human IgG-HRP conjugate (1∶5 000;Merck Millipore),常温孵育1 h后PBST洗膜5次,最后DAB显色,清水终止显色。
1.5 蛋白B102诊断效能的评价
利用蛋白B102建立血清Mtb抗体诊断竞争法ELISA试剂盒,并对临床和实验室确诊的血清样本进行检测,评价试剂盒对阴阳性血清标本的鉴别能力。简言之,碳酸盐包被缓冲液稀释蛋白B102 (1∶3 000) 后每孔100 μL (1.041 μg/mL) 包被板条孔,200 μL封闭液封闭非特异性位点;加入待测血清100 μL (1∶100稀释),置37 ℃孵育 1 h,然后洗涤;加入100 μL B102-HRP conjugate (1∶6 000;高碘酸盐偶联法;1.852 μg/mL),置37 ℃孵育1 h,然后洗涤;加入100 μL TMB显色,参考基线波长为620 nm,用酶标仪测定波长为450 nm吸光度值(值)。
1.6 统计学分析
运用GraphPad Prism 7.00软件分析120份血清样本的值,绘制Mtb阳性血清与阴性血清抗体水平散点图,并进行检验比较两组血清水平差异。根据经验选取阴性血清值均值2.1倍作为最佳临界值(Cut-off value) 并以此判定检测试剂盒的灵敏度和特异性。用McNemer检验及Kappa一致性检验评价两种检测方法的一致性。
2 结果与分析
2.1 原核表达和层析纯化可获取高度均质的蛋白B102
B102的构建如图1A所示,融合蛋白的氨基端为TRX标签,紧跟着依次为PstS1 (3个表位)、ESAT6 (2个表位)、CFP10 (2个表位)、Ag85B (1个表位)、Ag85A (1个表位) 以及PPE54 (2个表位) 等6个蛋白的11个B细胞预测表位,羧基端为His标签,间隔中添加了连接臂GGGS以及合适的酶切位点(如Ⅰ、Ⅰ和Ⅰ)。全基因合成的多表位基因片段长度约773 bp (图1B),构建好的表达质粒经测序、小量表达(图2A) 和双酶切鉴定结果(图1C) 证实构建成功,并将正确质粒命名为B102质粒。
3个转化B102质粒的BL21 (DE3) 单克隆菌落小量表达结果发现,与对照组相比,在约40 kDa处有明显表达条带(图2A),表明B102蛋白可以在大肠杆菌中有效表达。但是蛋白B102主要以包涵体形式存在(图2B),占菌体总蛋白比例达到31.25%。将包涵体进行处理后利用His亲和层析进行纯化,电泳结果发现蛋白B102主要存在于300 mmol/L咪唑洗脱液中(图2B),纯度为94.25%,浓度为2.313 mg/mL。经过DEAE阴离子交换层析后,蛋白B102主要分布于200 mmol/LNaCl洗脱液中,纯度为96.71%,浓度为3.124 mg/mL (图2B)。
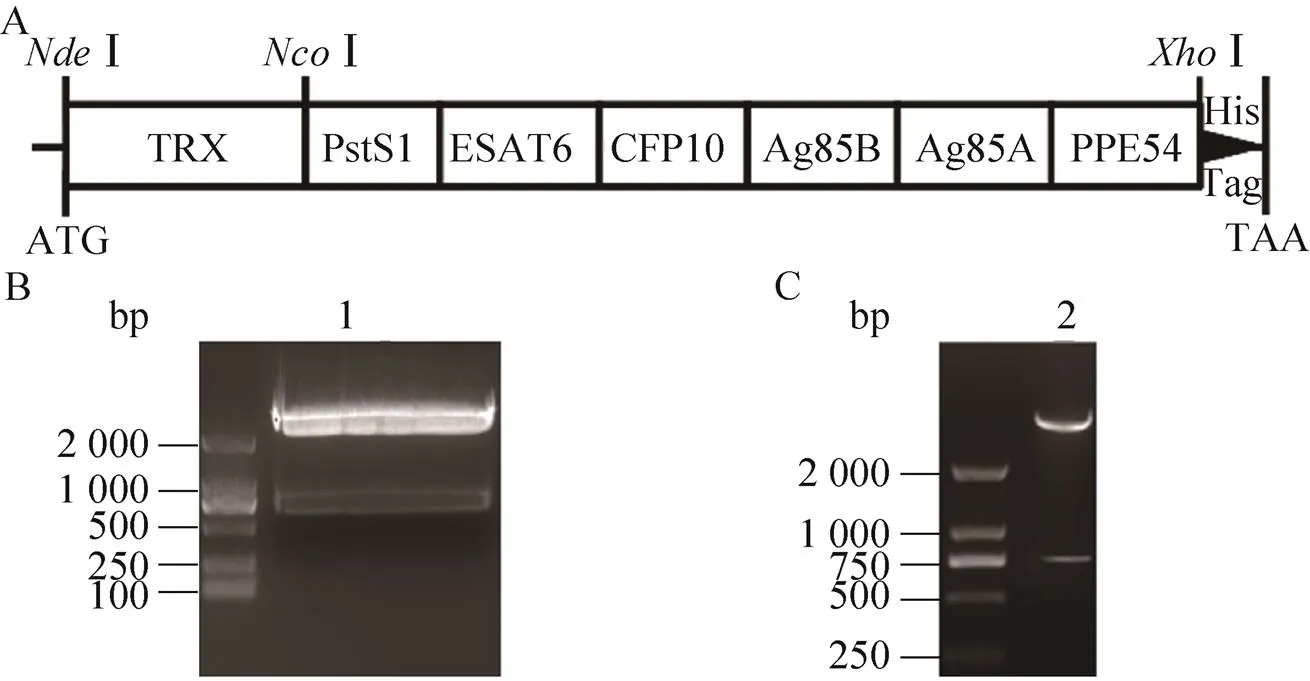
图1 B102表达质粒的构建
2.2 蛋白B102可以与Mtb阳性血清发生特异性反应
利用Western blotting技术对蛋白B102的抗原性进行初步鉴定,结果显示,利用Mtb阳性血清作为捕获抗体,抗人IgG-HRP作为检测抗体,在NC膜上相应位置出现了明显条带(图3A);而Mtb阴性血清作为捕获抗体,在NC膜上相应位置没有出现对应条带。并且无论是用Mtb阳性血清还是阴性血清,无蛋白B102表达菌及TRX空载体表达菌都未见明显条带(图3,泳道1-2),表 明了蛋白B102可以与Mtb阳性血清发生特异性反应。

图2 蛋白B102小量表达(A) 和亲和层析及阴离子交换层析纯化结果(B)
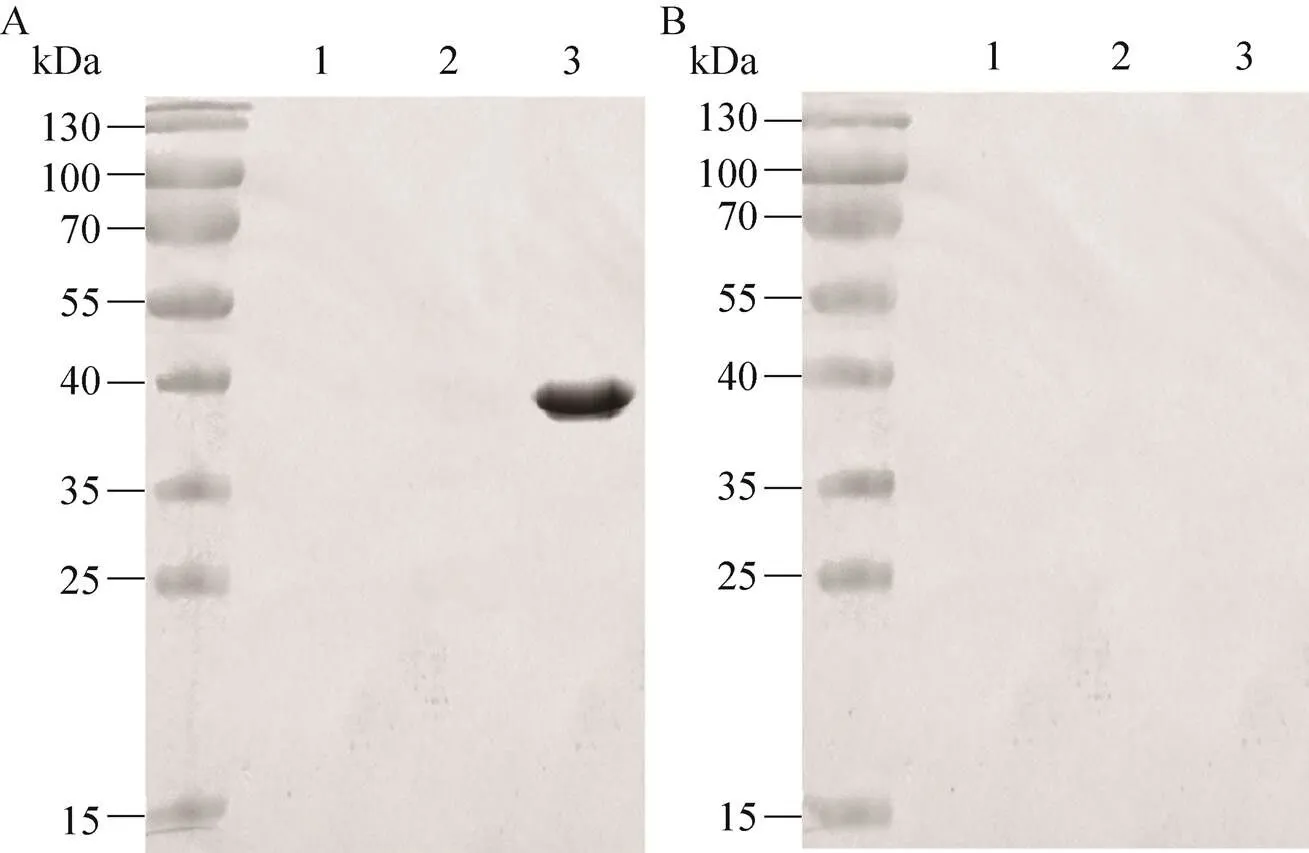
图3 蛋白B102的Western blotting分析
2.3 基于蛋白B102的竞争法ELISA技术可以很好地鉴别Mtb阴阳性血清标本

3 讨论
一直以来结核分枝杆菌感染的血清学诊断是科研难题,病人不同的疾病进程、潜伏及细胞内感染的特性、相对繁多的结构及非结构蛋白等使Mtb的免疫学指标纷呈复杂。目前有很多Mtb抗原如MPT-64、Ag85复合物和CFP-10/ ESAT-6等用于血清学诊断和疫苗研究,但灵敏度或特异性都不理想[5,13-14]。本研究根据B细胞表位预测筛选出Mtb6个蛋白的11个表位并将多表位展示在一个蛋白上,旨在构建表位依赖性Mtb诊断抗原。

图4 蛋白B102在Mtb感染血清学诊断效果评价
所选取的6个蛋白分别为PstS1 (3个表位)、ESAT6 (2个表位)、CFP10 (2个表位)、Ag85B (1个表位)、Ag85A (1个表位) 以及PPE54 (2个表位)。PsttS1、Ag85A、Ag85B、ESAT-6、CFP10是感染早期大量表达的分泌蛋白[15]。PE/PPE蛋白家族为分枝杆菌所独有,且是结核分枝杆菌基因组中一个数量庞大的家族,对分枝杆菌的内稳态保持、繁殖及不同环境下的生存影响有着巨大的研究潜力。而且PE/PPE蛋白作为毒力因子对抗原加工递呈、诊断抗原和疫苗研究等方面意义重大[16]。因此本研究选用了PPE54蛋白两个抗原性预测值较高的表位。PstS1是结核菌的主要免疫原,何秀云等发现此抗原检测的特异性明显高于PPD[17]。ESAT6和CFP10无论在Mtb的显性感染、隐性感染还是在与HIV合并感染中都具有较好的特异性和敏感性。当与PstS1蛋白联合应用时,CFP10能检测出对PstS1抗原缺乏反应的结核病患者血清特异性抗体,在保持高特异性的基础上,可以弥补PstS1蛋白对涂片阴性结核病患者检测敏感性的不足[18]。Ag85复合物在活动性肺结核病患者血清中高50–150倍,对活动性结核病辅助诊断具有重要意义[19]。将这6种蛋白的优势表位进行串联进而构建出新型Mtb诊断抗原。本研究发现目的蛋白主要以包涵体形式存在(图2B),但纯化后经过透析复性,目的蛋白水溶性程度很高,主要原因有:1) TRX融合表达能提高目的蛋白的可溶性,对目的蛋白的复性可能也有帮助作用[20];2)所选择的B细胞预测表位为线性表位同时也是T细胞表位,对蛋白构象的要求相对较低;3)预测表位亲水程度高,容易水溶。Western blotting结果显示蛋白B102可以与Mtb阳性血清发生特异性反应,理论上可以与存在表位对应的所有抗体反应,说明了其抗原性优异。
本研究采用竞争法同时检测血清中Mtb相关IgG、IgM和IgA。在Mtb感染早期,患者体内抗体以IgM为主,中晚期以IgG型为主,而潜伏感染者及感染愈后患者体内一定时间内存在大量IgG抗体。有研究发现大量样本检测[21],IgM阳性率很低,大部分为IgG阳性,而本研究采用的是竞争法ELISA,可以同时检测IgG和IgM两种血清学指标,IgM抗体检测可以补充IgG检测只针对结核病中晚期的局限性,为结核病的早期诊断提供依据,针对不同的患者和不同的病程,同时检测两种抗体在结核病的诊断中意义重大[21]。IgA为粘膜免疫指标,血清中IgA也是一个重要诊断指标。本研究发现可以同时检测这3种抗体的新型诊断试剂的灵敏度和特异性都很理想,下一步需要精细优化包被抗原和酶偶联抗原含量,灵敏度和特异性可能会有所提升。
总之,原核表达和层析纯化获取的多表位串联诊断抗原,可以很好地鉴别Mtb阴阳性血清,为结核分枝杆菌感染的早期诊断和治疗提供有效的血清学依据,为结核防控工作提供更真实的决策指标。
[1] WHO. Global tuberculosis report 2017. Washington, DC: WHO, 2017.
[2] Steingart KR, Ramsay A, Pai M. Optimizing sputum smear microscopy for the diagnosis of pulmonary tuberculosis. Expert Rev Anti-Infect Therapy, 2007, 5(3): 327–331.
[3] Diel R. Long-term effect of bacille calmette-Guérin vaccination in tuberculin skin testing: a new reality for TB prevention. Chest, 2017, 152(2): 235–236.
[4] Casela M, Cerqueira SMA, de Oliveira Casela T, et al. Rapid molecular test for tuberculosis: impact of its routine use at a referral hospital. J Bras Pneumol, 2018, 44(2): 112–117.
[5] Bekmurzayeva A, Sypabekova M, Kanayeva D. Tuberculosis diagnosis using immunodominant, secreted antigens of. Tuberculosis, 2013, 93(4): 381–388.
[6] Steingart KR, Henry M, Laal S, et al. Commercial serological antibody detection tests for the diagnosis of pulmonary tuberculosis: a systematic review. PLoS Med, 2007, 4(6): e202.
[7] Nguyen TLT, Sarmiento ME, Calero R, et al. Immunoinformatics study on highly expressedgenes during infection. Tuberculosis, 2014, 94(5): 475–481.
[8] Zhu ZY, Zhang D, Wang HB, et al. Expression and serological diagnosis of Mycobacterium tuberculosis CFP-10 and Rv2626c proteins. Genet Mol Res, 2014, 13(3): 7398–7406.
[9] Luo Q, Li SJ, Xiao TY, et al. Cloning expression and serological evaluation onfour new antigens. Chin J Epidemiol, 2018, 39(4): 514–518 (in Chinese). 罗巧, 李霜君, 肖彤洋, 等. 结核分枝杆菌4种新抗原的克隆表达及血清学评价. 中华流行病学杂志, 2018, 39(4): 514–518.
[10] Burbelo PD, Keller J, Wagner J, et al. Serological diagnosis of pulmonaryinfection by LIPS using a multiple antigen mixture. BMC Microbiol, 2015, 15: 205.
[11] Infantes-Lorenzo JA, Whitehead CE, Moreno I, et al. Development and evaluation of a serological assay for the diagnosis of tuberculosis in alpacas and llamas. Front Vet Sci, 2018, 5: 189.
[12] Wang S, Wu J, Chen JZ, et al. Evaluation of-specific antibody responses for the discrimination of active and latent tuberculosis infection. Int J Infect Dis, 2018, 70: 1–9.
[13] Yan ZH, Yi L, Wei PJ, et al. Evaluation of panels ofantigens for serodiagnosis of tuberculosis. Int J Tubercul Lung Dis, 2018, 22(8): 959–965.
[14] Pukazhvanthen P, Anbarasu D, Basirudeen SA, et al. Assessing humoral immune response of 4 recombinant antigens for serodiagnosis of tuberculosis. Tuberculosis, 2014, 94(6): 622–633.
[15] Andersen P. The T cell response to secreted antigens of. Immunobiology, 1994, 191(4/5): 537–547.
[16] Sun L, Min CY, Qian Y, et al. Progress on PE/PPE proteins of mycobacterium tuberculosis. Chin J Zoon, 2013, 29(5): 499–503 (in Chinese). 孙林, 闵晨雨, 钱源, 等. 结核分枝杆菌PE/PPE蛋白研究进展. 中国人兽共患病学报, 2013, 29(5): 499–503.
[17] He XY, Zhuang YH, Zhang XG. The immunogenic characteristics of the recombinant 38 000 antigen from. Chin J Tubercul Respirat Dis, 2000, 23(8): 485–488 (in Chinese). 何秀云, 庄玉辉, 张晓刚. 结核分支杆菌重组38000蛋白的免疫原性特征. 中华结核和呼吸杂志, 2000, 23(8): 485–488.
[18] Dillon DC, Alderson MR, Day CH, et al. Molecular and immunological characterization ofCFP-10, an immunodiagnostic antigen missing inBCG. J Clin Microbiol, 2000, 38(9): 3285–3290.
[19] Chai XM, Li YL. The research progression of tuberculosis vaccine on antigen85 complex. Chin J Antitubercul, 2013, 35(4): 282–285 (in Chinese). 柴雪敏, 黎友伦. 结核分枝杆菌Ag85复合物相关疫苗研究进展. 中国防痨杂志, 2013, 35(4): 282–285.
[20] Huang YT, Lu XM, Yang XR, et al. Renaturation technology of recombinant fusion protein Trx-IFN-CSP. Biotechnol Bull, 2016, 32(6): 219–225 (in Chinese). 黄演婷, 卢雪梅, 杨小蓉, 等. 重组融合蛋白Trx-IFN-CSP复性工艺研究. 生物技术通报, 2016, 32(6): 219–225.
[21] Li SJ, Zhang ZG, Yu Q, et al. Application value of detectingspecific IgG/IgM antibodies for tuberculosis diagnosis with colloidal gold immunochromatography assay. Chin J Zoon, 2018, 34(2): 139–144 (in Chinese). 李霜君, 张治国, 余琴, 等. 胶体金免疫层析法检测结核分枝杆菌特异性IgG/IgM抗体对结核病诊断的应用价值. 中国人兽共患病学报, 2018, 34(2): 139–144.
Preparation of multi-epitope recombinant diagnostic antigen of
Jian Gao1, 2, 3, and Ding Zhao1, 2, 3
1Department of Laboratory Medicine, Children’s Hospital Affiliated of Zhengzhou University, Zhengzhou 450000,Henan,China 2Department of Laboratory Medicine, Zhengzhou Children’s Hospital, Zhengzhou 450000, Henan, China 3 Department of Laboratory Medicine, Henan Children’s Hospital, Zhengzhou 450000, Henan, China
Multi-epitope recombinant diagnostic antigen (designated ‘B102’) of(Mtb) was prepared and evaluated as a serological diagnostic antigen. With TRX at the N-terminal and His tag at the C-terminal, the multi-epitope Mtb recombinant diagnostic antigen including 11 predicted B-cell epitopes from 6 Mtb antigens (PstS1, ESAT6, CFP10, Ag85B, Ag85A and PPE54) was expressed inBL21 (DE3) and purified by Ni2+-Chelating affinity and DEAE anion exchange chromatography. Based on the antigenicity of B102 confirmed in Western blotting analysis, we constructed and evaluated a double-antigen sandwich ELISA for diagnosis of Mtb infection. The protein B102 exists in the form of inclusion bodies, accounting for 31.25% of the total proteins of the bacteria. After purification and renaturation, protein B102 exists in soluble form with the concentration 3.124 mg/mL and the homogeneity 96.71%. WB analysis demonstrated that protein B102 could react with antibodies in Mtb positive serum. Using the novel antigen in ELISA, we tested 60 Mtb-related positive and negative serum; The results showed the sensitivity, specificity, positive and negative predictive values and coincidence rate of the detection method is 90.00%, 93.33%, 93.10%, 90.32% and 91.67%, respectively. The McNemer analysis suggested there was no statistical difference between the ‘Gold standard’ and the novel ELISA with kappa 0.833, which suggested the excellent consistency. By prokaryotic expression and chromatography purification, the multi-epitope recombinant antigen B102 was obtained with excellent antigenicity, which could be applied for Mtb-related serological detection.
multi-epitope recombinant diagnostic antigen,, prokaryotic expression, chromatography purification, serological diagnosis
10.13345/j.cjb.180392
September 21, 2018;
November 19, 2018
Ding Zhao. Tel/Fax: +86-371-85515776 ; E-mail: zhaoding_henan@126.com
2019-01-07
http://kns.cnki.net/kcms/detail/11.1998.Q.20190107.1101.001.html
(本文责编 郝丽芳)

