功能化树枝状聚合物处理综合电镀废水的研究
伍春柔,张冰如
(同济大学环境科学与工程学院,上海 200092)
1 引 言
随着工业化的快速发展,我国产生了大量含有重金属的工业废弃物,由于处理不当或违规排放,已造成严重的土壤和水体污染。目前我国土壤重金属超标率达82.8%[1],约70%的河流和湖泊被污染[2],“血铅”“镉米”等重金属危害事件频出,重金属污染成为最受关注的公共事件之一,其中重金属废水是重金属进入环境的主要方式之一。电镀行业属当今全球三大污染工业之一,据不完全统计,我国每年排出电镀废水达40多亿吨[3],其中含有大量Cu、Ni等污染物[4]。近年来,我国对电镀污染物的环保要求愈加严格,各地区陆续执行《电镀污染物排放标准》(GB21900-2008)中表3的特别排放限值(其中Cu<0.3 mg/L,Fe<2.0 mg/L,Ni<0.1 mg/L)[5-6]。而且,2018年1月1日起,我国在全国范围征收环境保护税[7],环保力度不断升级。
目前,处理电镀废水的技术主要有离子交换法、膜分离法、吸附法、化学沉淀法等。其中离子交换法投资大、工艺复杂,膜分离法成本高,会产生膜污染,吸附法条件严格,仅适用于低浓度废水,同时还存在吸附剂的再生等问题。常规化学沉淀法成本较低、操作简单、应用较广,但难以满足日益严格的排放标准,在实际处理过程中需要与膜处理、离子交换等工艺联用进行深度处理,增加处理成本,难以普遍应用[8-9]。二硫代氨基甲酸盐(DTC)类重金属捕集剂是一类性能优良的重金属废水处理药剂[10],但小分子DTC 类捕集剂生成的重金属螯合沉淀絮体细小,沉降性能不好,需维持适当过量才能达到较好效果。并且目前的研究主要集中在重金属捕集剂对模拟废水中重金属的去除方面,对实际废水的研究鲜有报道。
本实验以上海市某电镀厂综合废水作为研究对象,合成一种新型的树枝状聚合物TE-6CSSNa,并对比氢氧化钠(NaOH)和二甲基二硫代氨基甲酸钠(SDD),探究初始pH值以及药剂投加量对实际废水中重金属去除效果的影响。在不增加电镀企业现有废水处理设施的前提下,为电镀废水处理工艺的改进提供依据。
2 实验部分
2.1 实验材料
本实验所用试剂均为分析纯,TE-6CSSNa为实验室合成。
实验采用上海市某电镀厂的实际综合电镀废水,该废水pH为7.66,COD为84 mg/L。对比《电镀污染物排放标准》(GB 21900-2008),废水中超标重金属为铜、镍,初始浓度分别为6.82 mg/L、64.36 mg/L。
2.2 实验方法
取100 mL废水于烧杯中,磁力搅拌下(300 r/min)用质量分数为50%的NaOH溶液调节pH,在不同实验条件下(初始pH值、药剂投加量)进行试验,加入药剂反应5 min,静置30 min后取10 mL上清液,采用电感耦合等离子体光谱仪或电感耦合等离子体质谱仪测定溶液中残留的重金属浓度。
2.3 分析方法
废水的pH值由Jenco-6010M酸碱度计测定;重金属残留浓度的测定采用电感耦合等离子体光谱仪(ICP-OES,Ageilent 720 ES), 金属浓度低于1 mg/L时改用电感耦合等离子体质谱仪(ICP-MS,Agilent 7700)。
所有实验组均设置3 个平行实验,取其数据平均值±标准偏差作为实验结果。
3 结果与讨论
3.1 中和沉淀法
中和沉淀法是向重金属废水中投加NaOH、Ca(OH)2等碱性药剂,使废水中的重金属转变为难溶的氢氧化物,从而达到去除废水中重金属离子的目的[11]。
取100 mL废水于烧杯中,用质量分数为50%的NaOH溶液将初始pH分别调节至7.66、8.48、8.88、9.48、10.46、11.57、12.59,实验结果见图 1。从图中可以看出,随着pH的增加,废水中残留Cu和Ni浓度变化基本一致,呈现先下降后上升的趋势。当pH为7.66~8.88时,上清液中Cu和Ni浓度随着pH的增加而急剧下降,说明Cu、Ni与-OH开始形成不溶于水的氢氧化物沉淀。在pH为8.88~11.57之间时,下降速度放慢,Cu和Ni残留浓度保持稳定或达到最小值。当pH过高时处理效果反而不佳,Cu和Ni残留浓度上升,这是因为形成多核羟基络离子的缘故。采用NaOH处理废水,出水中Cu和Ni最低浓度分别为1.07 mg/L和2.83 mg/L,远远高于电镀污染物排放标准(GB 21900-2008)中表3的排放限值(Cu<0.3 mg/L,Ni<0.1 mg/L),必须进一步妥善处理。
综上,中和沉淀法处理电镀废水,必须控制好加碱量(即pH值),加碱量过少或过多,都会影响处理效果,但实际处理过程中废水的成分及pH值的波动往往较大[12]。同时,由以上实验结果可知,单纯采用NaOH处理电镀废水,出水中金属离子远远不能满足日益严格的环境标准,必须进行深度处理,导致处理成本增加,因此对于新处理方法的需求就变得更加迫切。

图1 初始pH值对氢氧化钠去除重金属效果的影响Fig.1 Effect of initial pH on removal of heavy metals by sodium hydroxide
3.2 SDD沉淀法
SDD是市场上现有的直链型DTC类重金属捕集剂,其中的-CSS-基团具有较强的螯合能力,能与金属形成较稳定的螯合物,从而去除废水中的金属污染物[13]。
取100 mL废水于烧杯中,初始pH值从7.66变化到12.68,加入200 mg/L SDD溶液,实验结果见图2。原水pH为7.66,在未调节pH的情况下,投加SDD即对Cu和Ni有一定的去除效果,出水中Cu和Ni含量分别降至1.43 mg/L和6.67 mg/L。随着初始pH值的增加,上清液中Cu和Ni浓度先降低后升高,在pH为8.6时,达到最小值,其中Cu含量降至0.30 mg/L,接近表3的排放限值(Cu<0.3 mg/L),而Ni含量为2.17 mg/L,离标准规定的0.1 mg/L仍有较大差距。从图 3中SDD离解平衡式可知,当pH 值升高时,平衡向左移动,-CSS-浓度增大,螯合作用增强,重金属(M)浓度则降低。但是,当反应pH过高时,SDD-M沉淀会吸附-OH,带相同负电荷的SDD-M絮体相互排斥,导致出水中重金属浓度升高[14]。

图2 初始pH值对二甲基二硫代氨基甲酸钠去除重金属效果的影响Fig.2 Effect of initial pH on removal of heavy metals by sodium dimethyl dithiocarbamate

图3 SDD分子离解平衡式Fig.3 Dissociation equilibrium of SDD molecule
因此,实验选择pH=8.6为反应的最佳pH值做进一步研究。
取100 mL废水于烧杯中,用质量分数为50%的 NaOH溶液调节废水pH为8.60,分别加入0 mg/L、100 mg/L、200 mg/L、300 mg/L、350 mg/L、375 mg/L、400 mg/L、450 mg/L、500 mg/L 的SDD溶液,实验结果见图 4。从图中可以看出,随着SDD投加量的逐渐增加,出水中Cu和Ni残留浓度呈下降趋势,其中SDD对Cu的去除效果较佳。SDD投加量增加至150 mg/L~500 mg/L时,出水中Cu浓度低于旧标准限值。当SDD投加量增加至300 mg/L时,上清液中Cu达到最低浓度0.27 mg/L,满足新标准限值Cu<0.3 mg/L。SDD虽对Ni去除效果亦显著,但始终未能实现达标排放,最低浓度为1.86 mg/L。Hhacket等[15]曾实验证明,DTC类重金属捕集剂对于不同的金属螯合能力按此顺序递减: Ag+>Hg>Cu>Sb3+>Pb>Cd>Ni>Zn>Co,本实验结果与其结论一致。当SDD投加量增加至300 mg/L以上时,Cu和Ni残留浓度略微升高。考虑到实际应用中经济成本的问题,在废水中ρ(Cu)=6.82 mg/L、ρ(Ni)=64.36 mg/L、pH=8.6时选择ρ(SDD)=300 mg/L为理想的投加量。

图4 投加量对二甲基二硫代氨基甲酸钠去除重金属效果的影响Fig.4 Effect of dosage on removal of heavy metals by dimethyl dithiocarbamate sodium
综上,SDD对综合电镀废水的处理效果优于传统中和沉淀法,在pH=8.6时处理效果最好,但需要的投加量较大且出水中Ni的剩余浓度大于表3的排放限值Ni<0.1 mg/L,废水仍然不能达标排放。
3.3 TE-6CSSNa沉淀法
在实验室合成一种新型树枝状聚合物TE-6CSSNa,其三维空间结构不同于传统药剂的二维结构,结构上的创新将带来了性能上的突破,具有自絮凝沉降作用,能够高效处理重金属废水。而且,有机捕集剂TE-6CSSNa与重金属离子的螯合沉淀物经过高温灼烧处理后可以回收重金属。
取100 mL废水于烧杯中,用质量分数为50%的NaOH溶液调节pH,废水pH从7.66变化到12.68,TE-6CSSNa投加量为200 mg/L,实验结果见图 5。从图中可以看到,在未调节pH的条件下加入TE-6CSSNa,出水中Cu和Ni残留浓度迅速下降。当废水pH在8~9之间时,Cu和Ni残留浓度维持在较低水平。相较于NaOH和SDD,TE-6CSSNa具有较广的pH作用范围,并且满足《电镀污染物排放标准》中表3对pH的要求(pH值为6~9)。pH在8.6时,TE-6CSSNa对废水中Cu和Ni处理效果最好。随着pH的继续升高,出水中Cu和Ni残留浓度逐渐增大。TE-6CSSNa分子中的螯合基团-CSS同样存在图3所示的离解平衡,溶液pH过高时絮体带有的负电荷导致沉降性能下降,重金属浓度升高。因此,从处理效果以及经济角度考虑,选择最佳pH为8.6。
用50%NaOH溶液调节废水pH为8.6,取100 mL废水于烧杯中,分别加入0 mg/L、50 mg/L、100 mg/L、150 mg/L、200 mg/L、225 mg/L、250 mg/L、275 mg/L、300 mg/L、325 mg/L、350 mg/L TE-6CSSNa溶液,实验结果如图 6所示。从图中可以看出,随着药剂投加量的增加,出水中Cu和Ni浓度呈迅速下降的趋势。在TE-6CSSNa投加量为250mg/L时,出水中Cu残留浓度为0.28 mg/L,低于0.3 mg/L的排放限值。当TE-6CSSNa投加量为300 mg/L时,出水中Cu残留浓度甚至在0.01 mg/L以下。在TE-6CSSNa投加量为275~325 mg/L时,Cu和Ni浓度都能稳定在标准以下,因为TE-6CSSNa中二硫代氨基甲酸盐与重金属空轨道结合,结合后重金属的其他空轨道又会与更多的树状聚合物结合,从而形成空间网状结构,沉降速度快,处理效果好。从经济成本的角度考虑,TE-6CSSNa用量越少成本越低,因此在废水中ρ(Cu)=6.82 mg/L、ρ(Ni)=64.36 mg/L、pH=8.6时选择ρ(TE-6CSSNa)=275 mg/L为最佳投加量。
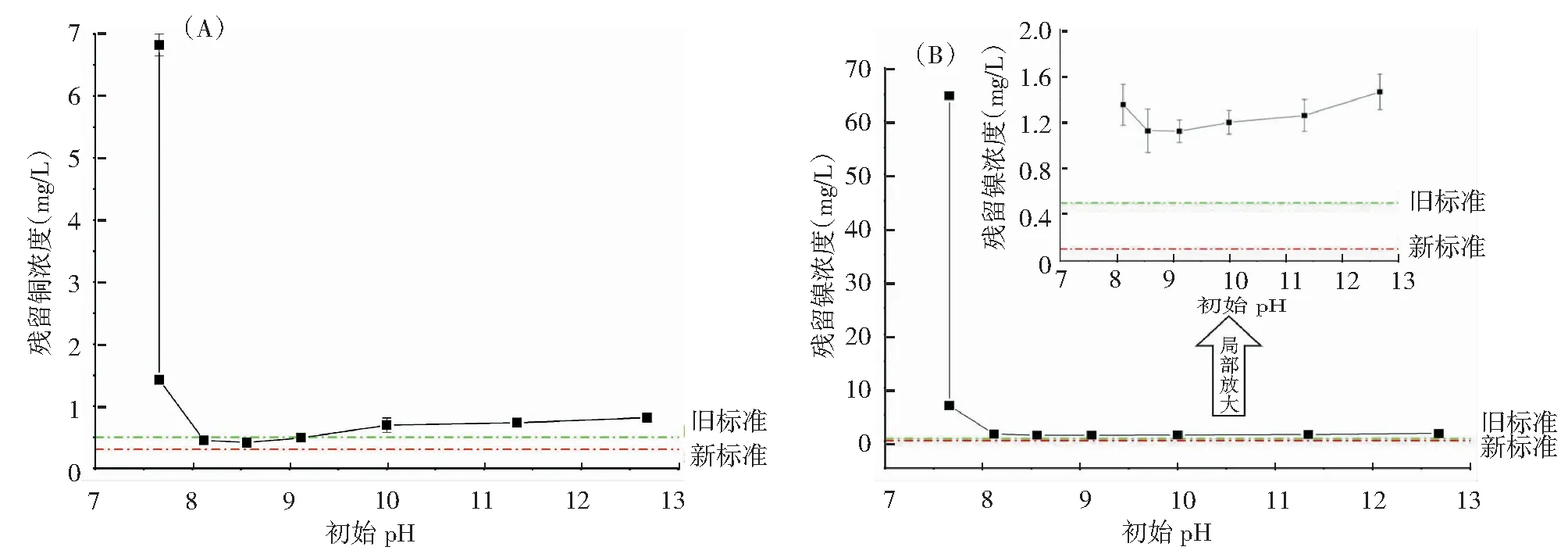
图5 初始pH值对TE-6CSSNa去除重金属效果的影响Fig.5 Effect of initial pH on the removal of heavy metals by TE-6cssNa
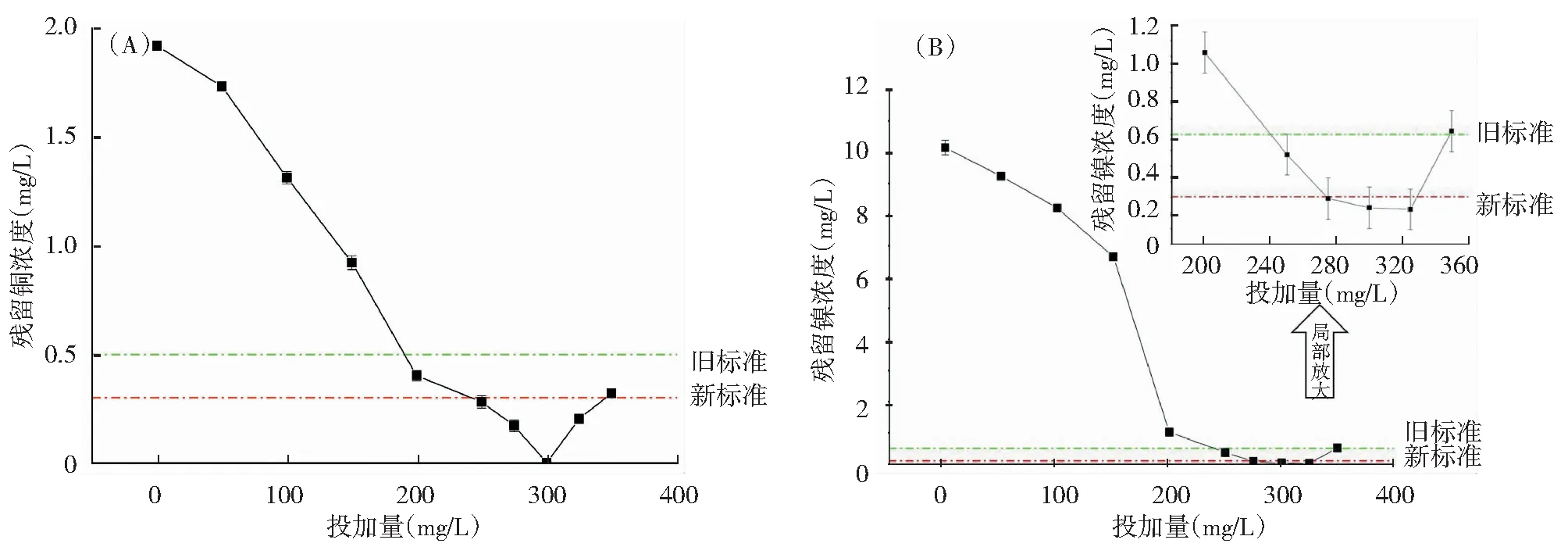
图6 投加量对TE-6CSSNa去除重金属效果的影响Fig.6 Effect of dosage on TE-6CSSNa removal of heavy metals
综上,TE-6CSSNa对综合电镀废水处理效果显著,在废水pH=8.6、ρ(Cu)=6.82 mg/L、ρ(Ni)=64.36 mg/L时投加275 mg/L药剂即可实现电镀废水的稳定达标,明显优于传统中和沉淀法和SDD沉淀法。
4 结 论
实验证明,DTC类重金属捕集剂对于电镀废水中金属Cu和Ni的螯合能力顺序为:Cu>Ni。电镀废水单纯采用NaOH或SDD,出水无法满足表3的排放标准,必须结合膜分离等技术,极大增加了处理成本。相较于传统药剂NaOH和SDD,TE-6CSSNa更加具有优越性,在较低药剂投加量的条件下就能实现达标排放。TE-6CSSNa处理电镀废水的高效性、经济性,为实际电镀废水处理工艺的改进提供了依据,具有极高的经济、环境和社会效益,应用前景十分广阔。

