Dppz配体10,13-位由芳香基取代的新型单核钌配合物的合成
李敏娜*
(首都医科大学药学院化学生物学系,北京 100069)
过渡金属配合物具有与DNA键合的特性,在DNA构象探针、化学药物治疗药物先导和细胞显像剂等方面具有潜在应用价值[1-6]。因此,具有高选择性的DNA结合特性的过渡金属配合物的设计和合成近年来一直是人们研究的热点。多吡啶合钌(Ⅱ) 配合物,尤其是二-(1,10-邻菲罗啉)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ){ruthenium bis(phenanthroline)-pyrido-(3,2-a:2′,3′-c)phenazine,[Ru(phen)2(dppz)]2+},详见图1,及其衍生物由于其优良的DNA“光开关”能力(在纯水溶液中不发光,但在水中加入DNA后,配合物的主配体dppz插入DNA碱基对中,吩嗪上的N原子脱离溶剂H2O的氢键作用,发出强光[7])而备受关注。研究[8]表明,与DNA作用的药物分子具有抗肿瘤活性,有两点至关重要:一是与DNA较强的键合力,二是从DNA解离出来具有较慢的解离速率。据报道[9-10]通过单键连接两个[Ru(phen)2(dppz)]2+的半刚性双核配合物四-(1,10-邻菲罗啉)-二联吡啶类(3,2-a:2′-3′-c)吩嗪基合二钌(Ⅱ){diruthenium tetra(phenanthroline)-dipyrido-(3,2-a:2′,3′-c)phenazine,[bidppz(phen)4Ru2]4+}解离DNA的速率非常慢,类似于具有抗癌活性的天然产物诺加霉素。双核配合物具有慢的解离速率是由于单核Ru部分较大空间构型,通过或解离DNA时需要至少一个碱基对瞬间打开或碱基对堆叠一起,空间位阻较大,同时也导致了配合物对DNA序列的选择性[10]。随后科学家们设计并合成了一系列双核类似物,并发现辅助配体的亲疏水性、桥联配体灵活性的大小也会影响DNA解离速率[11-14]。双核配合物虽然部分可获得较慢解离DNA速率,但由于相对分子质量过大,反应中易形成沉淀,影响其与核酸作用。假设对于单核配合物来讲,如果在主配体dppz长轴上引入大的取代基,当其插入DNA碱基对时,较大的空间位阻势必也能降低配合物解离DNA的速率,避免相对分子质量过大导致的后果。基于以上考虑,早期本课题组就合成了一系列单核[Ru(phen)2(dppz)]2+衍生物[15-16],尤其是芳基取代吡啶类(3,2-a:2′-3′-c)吩嗪配体的10和13位[16]。令人惊喜的是dppz配体含有噻吩取代的配合物与DNA结合与解离的速度都很慢,属于嵌插入结合方式,这是继双核配合物[11]后第二个能够以嵌插入模式结合DNA的钌配合物。而二苯基取代的类似物似乎只是取代基中的一个苯基部分插入DNA,从而更快的解离。在这些成果的鼓舞下,本课题组继而设计并合成了3种以2,2′-联吡啶(2,2′-bipyridine,bpy)为辅助配体,主配体dppz的10, 13位分别为噻吩、苯及呋喃的单核二-(2,2′-联吡啶)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ){ruthenium bis(2,2′-bipyridyl)-pyrido-(3,2-a:2′,3′-c)phenazine,[Ru(bpy)2(dppz)]2+}衍生物。结果表明3种配合物均以部分插入或沟槽结合与DNA作用,说明辅助配体的性质在DNA结合模式也起着重要的作用[17]。

图1 配合物二-(1,10-邻菲罗啉)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ)的结构Fig.1 Structure of complex ruthenium bis(phenanthroline)-pyrido-(3,2-a:2′,3′-c) phenazine
由于嵌插入方式是一个不寻常的DNA结合模式,显示出极其缓慢的动力学,它是细胞毒性的一个重要特征,该方式作用的化合物应是新的基于与DNA结合药物的模型化合物。正如上面提到的,这种结合方式的单核钌配合物目前报道的仅仅是10和13位含有二噻吩基取代dppz配体、邻菲罗啉为辅助配体的配合物。为此,进一步设计以邻菲罗啉辅助配体,dppz配体10, 13位取代的新的钌配合物并探索分子结构与DNA结合特性之间的关系具有十分重要的意义。因此,笔者设计并合成了新的单核[Ru(phen)2(dppz)]2+衍生物方案,为二-(1,10-邻菲罗啉)-10,13-二(2-噻吩基)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ)[ruthenium bis(phenanthroline)-10,13-di(2-thienyl)-pyrido-(3,2-a:2′,3′-c) phenazine, Ru-T];二-(1,10-邻菲罗啉)-10,13-二(2-呋喃基)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ)[ruthenium bis(phenanthroline)-10,13-di(2-furanyl)-pyrido-(3,2-a:2′,3′-c)phenazine, Ru-F];二-(1,10-邻菲罗啉)-10,13-二(4,7-苯并噻吩基)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ){ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo thienyl)]-pyrido-(3,2-a:2′,3′-c)phenazine, Ru-BT};二-(1,10-邻菲罗啉)-10,13-二(4,7-苯并呋喃基)-吡啶类(3,2-a:2′-3′-c)吩嗪合钌(Ⅱ){ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo furanyl)]-pyrido-(3,2-a:2′,3′-c,phenazine, Ru-BF}。为了研究芳香基上杂原子范德华半径及电子分布对钌配合物与DNA作用的影响,与前期报道的10,13-二(2-噻吩) 取代dppz配体的 [Ru(phen)2(dppz)]2+衍生物(Ru-T)进行对比,设计出由呋喃取代dppz配体的目标分子Ru-F。为了探讨取代基的大小对钌配合物与DNA作用的影响,分别对比Ru-T和Ru-F,设计出dppz配体分别由2-苯并噻吩和2-苯并呋喃取代的目标分子Ru-BT和Ru-BF。
1 材料与方法
1.1 试剂与仪器
本论文所用的溶剂均为分析纯,购于北京化工试剂公司。除无水乙醇外均直接用于实验中。氘代DMSO,氘代氯仿、2-呋喃硼酸、四-(三苯基磷)合钯(0)催化剂均从百灵威科技有限公司购置。
旋转蒸发仪(Laborota 4000)购自德国Heidolph Instruments公司;磁共振光谱仪上(500 MHz)、高分辨质谱仪 (Micro-TOF-Q)购自美国Bruker公司;紫外-可见分光光度计 (UV-2550)购自日本岛津公司。
中间体二氯-二-(1.10-邻菲罗林)合钌(Ⅱ){ruthenium di-(1,10-phenanthroline)dichloride,cis-[Ru(phen)2Cl2]}[18],二氯-二-(1.10-邻菲罗林)-1,10-邻菲罗啉-5,6-二酮合钌(Ⅱ){ruthenium di(1,10-phenanthroline)-1,10-phenanthroline-5,6-dione-dichloride),[Ru(phen)2(pq)]Cl2}[19]和4,7-二(2-噻吩基)-苯并噻二唑[4,7-bis(2-thienyl)-2,1,3-benzothiadiazole,T], 4,7-二(2-苯并(b)噻吩基)-苯并噻二唑[4,7-bis(2-benzo(b)thienyl)-2,1,3-benzothiadiazole,BT]和4,7-二(2-苯并(b)呋喃基-苯并噻二唑[4,7-bis(2-benzo(b)furanyl)-2,1,3-benzothiadiazole,BF] 根据文献[16-17]的制备程序得到。
1.2 实验方法
1.2.1 无水乙醇的干燥
将200 mL 99%(体积分数)的无水乙醇置于500 mL 圆底烧瓶中,加入5 g 镁条,回流4 h后,蒸馏,收集78~80 ℃馏分,待用。
1.2.2 4,7-二(2-呋喃基)-苯并噻二唑[4,7-bis(2-furanyl)-2,1,3-benzothiadiazole, F]的合成
F的制备方法和笔者前期报道[16]的4,7-二(2-噻吩基)-苯并噻二唑的合成相同,即是通过Suzuki 偶联反应。4,7-二溴苯并(1,2,5)噻二唑的混合物(88 mg,0.3 mmol),2-呋喃硼酸(111 mg,1 mmol)、碳酸钾(414 mg,3 mmol)和Pd(PPh3)4(47 mg,0.04 mmol)在二氧六环和水的混合溶剂 (体积比为4∶1, 8 mL)中,N2保护下回流。薄层色谱法监测反应过程(硅胶板,石油醚作展开剂,Rf= 0.3)。溶液的颜色由红色变为棕色,最后变成橙色。待原料消失,停止反应。将反应液冷却至室温,加入40 mL 水,然后采用二氯甲烷(3×10 mL)萃取。得到的萃取液经无水硫酸钠干燥,过滤除去硫酸钠,得到的溶液在减压下旋干。然后以石油醚为洗脱剂,在硅胶柱上进行分离,得到橙黄色固体32 mg,产率40%。1H NMR δH(500 MHz, CDCl3) 6.66 (2H, J=2.0 Hz, d), 7.62 (s, 2H), 7.72 (2H, J=3.0 Hz, d), 8.08 (s, 2H);13C NMR (500 MHz, CDCl3) 112.16, 112.48, 121.80, 123.52, (142.80), 150.017, 151.33; TOF-MS 269.043 5 ([M+H+]), 相对分子质量269.037 9。
1.2.3 3,6-二(2-呋喃基)-1,2-二胺基苯的合成
3,6-二(2-呋喃基)-1,2-二胺基苯的制备方法参考Dasilveria等[20]报道的3,6-二芳香基邻苯二胺的合成。4,7-二呋喃苯并(1,2,5)噻二唑(0.2 mmol),硼氢化钠 (11 mg,0.3 mmol)和CoCl2·6H2O (10 mg,0.04 mmol)溶解在5 mL干燥的乙醇中。在氩气保护下将得到的悬浮液回流10 min。溶液变成无色并且有黑色固体Co2B析出,同时有H2S气体放出。反应混合物冷却至室温,过滤。得到的滤液加入15 mL水,接着用乙醚萃取(3×10 mL)。萃取液组合在一起,加入无水Na2SO4干燥,减压下蒸干溶剂即得到无色固体即为目标产物。由于邻苯二胺类似物在空气中不稳定,为避免其快速分解,通常立即将其应用于下步的反应中,无表征数据。幸运的是,本课题组对得到的固体快速置于经K2CO3过滤的氘代氯仿中,经磁共振仪得到了3,6-二呋喃基邻苯二胺的磁共振图谱。1H NMR δH(500 MHz, CDCl3) 6.55 (s, 2H), 6.63 (2H, J=3.0 Hz, d), 7.08 (s, 2H), 7.55 (s, 2H);13C NMR (500 MHz, CDCl3) 106.92, 111.43, 116.74, 118.28, 132.63, 141.47, 153.65; TOF-MS 241.1019 ([M+H+]),相对分子质量 241.0972.
1.2.4 dppz配体的10,13-位由芳香基取代的几种单核[Ru(phen)2(dppz)]2+衍生物(Ru-T,Ru-F,Ru-BT和Ru-BF)的合成
几种目标配合物的合成方法相同。制备过程如下: 3,6-二芳香基邻苯二胺类中间体(0.05 mmol),[Ru(phen)2(pq)]Cl2(0.025 mmol,19 mg)溶解在1 mL乙腈中,加入一滴乙酸。反应液在暗处、氩气保护下回流10 min,冷却至室温。溶液颜色由深棕色变为深红色。向反应液中加入饱和NH4PF6水溶液1 mL,发现橙红色沉淀,过滤,先后用水(3 × 5 mL)和乙醚(3 × 5 mL)洗涤,真空干燥。得到的固体经氧化铝柱层析纯化,乙腈为洗脱剂,得到橙红色固体为目标产物的六氟磷酸盐形式。将六氟磷酸盐的产物溶于2 mL丙酮中,得到红色溶液,加入少量氯化铵,得到橙红色沉淀,过滤,先后用丙酮(3 × 3 mL)和乙醚(3 × 3 mL)洗涤,真空干燥。得到了目标产物的氯盐形式。每个单核[Ru(phen)2(dppz)]2+衍生物的表征数据如下。

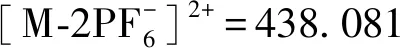
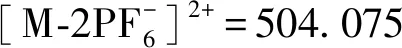

1.2.5 芳香基取代的苯并(1,2,5)噻二唑类中间体(T、F、BT和BF)及对应的单核[Ru(phen)2(dppz)]2+衍生物(Ru-T、Ru-F、Ru-BT和Ru-BF) 紫外-可见吸收光谱的测定
分别称量4种中间体5 × 10-3mmol,溶解于10 mL CH2Cl2中,配成500 μmol/L溶液。然后取100 μL该溶液用CH2Cl2稀释成1 mL即得到待测样品溶液。配合物样品溶液的配制方法同上。
2 结果
2.1 单核[Ru(phen)2(dppz)]2+衍生物(Ru-T、Ru-F、Ru-BT和Ru-BF)的合成过程
中间体配合物[(phen)2Ru(pq)] Cl2与相应的3,6位含有芳香基取代的邻苯二胺在含有乙酸的乙腈溶液中回流发生缩合反应得到4种对应的目标配合物。而邻苯二胺衍生物是首先通过典型的Suzuki 偶联反应,即4,7-二溴苯并噻二唑与硼酸类似物在(PPh3)4做催化剂,碱性条件下回流得到4,7-呋喃苯并(1,2,5)噻二唑。该物质再经CoCl2催化,NaBH4还原得到对应的3,6-二(2-呋喃基)邻苯二胺。最后,本研究对中间体和配合物进行了1H NMR、13C NMR和TOF-Mass的表征,详见图2。
2.2 芳香基取代的苯并(1,2,5)噻二唑类中间体(T、F、BT和BF)的紫外-可见吸收光谱
4种苯并噻二唑衍生物的紫外-可见光吸收光谱如图3。尽管4种中间体在结构上不同,它们在二氯甲烷溶液中的吸收光谱形状相似。在280~300 nm处出现一个狭窄的吸收,归属于芳香环部分的π-π*跃迁,440~460 nm 处宽的吸收带来源于分子内电荷转移(intramolecular charge transfer,ICT),即电荷从芳香基取代基转移到苯并噻唑部分。另外,随着共轭体系的增长,这两个吸收带均发生了红移。比较中间体F和T,低能级吸收带的最大吸收波长略有红移,这可能是杂原子不同的供电性造成的。相似的现象可以在比较BF和BT中观察得到。在高能级吸收带没有看到明显的该特点。

图2四种中间体(T、F、BT和BF)及对应的[(phen)2Ru(dppz)]2+衍生物(Ru-T、Ru-F、Ru-BT和Ru-BF)的合成路线
Fig.2Thesyntheticroutesoffourintermediates(T、F、BTandBF)andtheircorresponding[(phen)2Ru(dppz)]2+derivatives(Ru-T、Ru-F、Ru-BTandRu-BF)
Reaction conditions: 1) boric acid analogues, Pd(PPh3)4, K2CO3, dioxane/H2O (4/1), reflux; 2) NaBH4, CoCl2, EtOH, reflux; 3) [(phen)2Ru(pq)]Cl2, CH3CN, HOAc, reflux;Ru-T:ruthenium bis(phenanthroline)-10,13-di(2-thienyl)-pyrido-(3,2-a:2′,3′-c) phenazine;Ru-F:ruthenium bis(phenanthroline)-10,13-di(2-furanyl)-pyrido-(3,2-a:2′,3′-c) phenazine;Ru-BT:ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo thienyl)]-pyrido-(3,2-a:2′,3′-c)phenazine;Ru-BF:ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo furanyl)]-pyrido-[3,2-a:2′,3′-c]phenazine).

图3芳香基取代的苯并(1,2,5)噻二唑类中间体(T、F、BT和BF)在CH2Cl2中的紫外-可见吸收光谱(50μmol/L)
Fig.3UV-visabsorptionspectraof4,7-diaryl-2,1,3-benzothiadiazoles(T、F、BTandBF)inCH2Cl2(50μmol/L)
T:4,7-bis(2-thienyl)-2,1,3-benzothiadiazole;F:4,7-bis(2-furanyl)-2,1,3-benzothiadiazole;BT:4,7-bis[2-benzo(b)thienyl]-2,1,3-benzothiadiazole;BF:4,7-bis[2-benzo(b)furanyl]-2,1,3-benzothiadiazole.
2.3 单核[Ru(phen)2(dppz)]2+衍生物(Ru-T、Ru-F、Ru-BT和Ru-BF)的紫外-可见吸收光谱
4种[Ru(phen)2(dppz)]2+衍生物在水中的UV-Vis吸收光谱详见图4。由图可以看出,4种配合物具有相似的吸收光谱,主要包括4个特征吸收谱带。在最大吸收波长265 nm处有个强而窄的吸收,归属于两个辅助配体邻菲罗啉的π-π*跃迁;最大吸收波长450 nm处宽峰是典型的金属到配体的电荷转移(metal to ligand charge transfer,MLCT)产生的吸收;375 nm强度适中的谱带来源于dppz配体长轴 π-π*跃迁。与母体配合物[Ru(phen)2(dppz)]2+相比,dppz配体的10,13-位被两个芳香基团取代,375 nm 处dppz配体 π-π*跃迁导致的最大吸收波长略有红移,与MLCT吸收带发生部分重叠。来源于芳香基取代dppz配体的纵轴方向上的315 nm处π-π*跃迁在Ru-T,Ru-F和Ru-BF中相似,和Ru-BT相比略有蓝移,这可能是由整个分子的极性及共轭效应决定的。 Ru-F的315 nm处吸收强度比Ru-T、Ru-BT和Ru-BF低,可能归因于配合物在水中的π堆积效应。
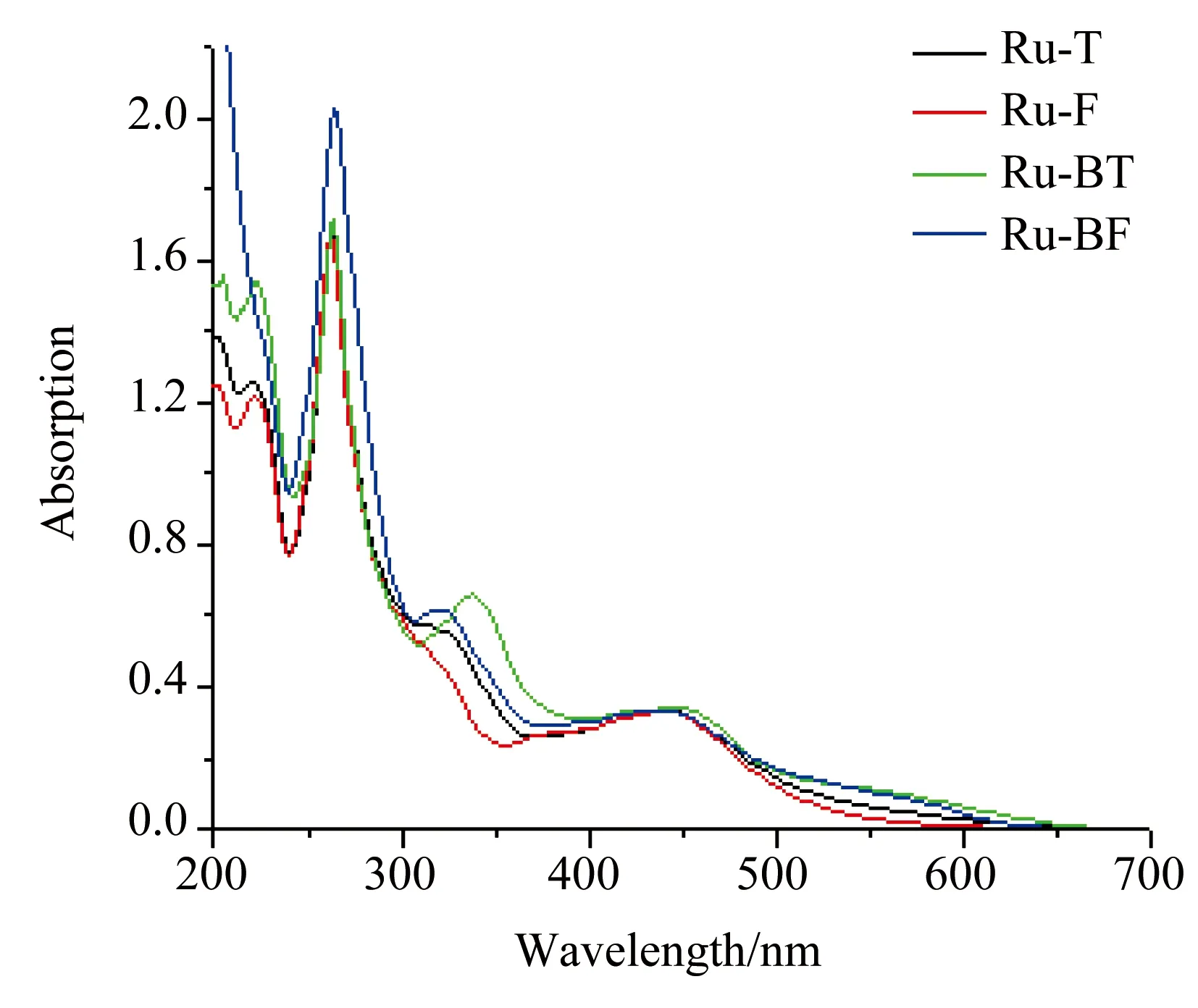
图44种[(phen)2Ru(dppz)]2+衍生物(Ru-T、Ru-F、Ru-BT和Ru-BF在水中的紫外-可见吸收光谱(150μmol/L)
Fig.4UV-visabsorptionspectraoffour[(phen)2Ru(dppz)]2+derivatives(Ru-T,Ru-F,Ru-BTandRu-BF)inwater(150μmol/L)
Ru-T:ruthenium bis(phenanthroline)-10,13-di(2-thienyl)-pyrido-(3,2-a:2′,3′-c) phenazine;Ru-F:ruthenium bis(phenanthroline)-10,13-di(2-furanyl)-pyrido-(3,2-a:2′,3′-c) phenazine;Ru-BT:ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo thienyl)]-pyrido-(3,2-a:2′,3′-c)phenazine;Ru-BF:ruthenium bis(phenanthroline)-10,13-[4,7-bis(2-benzo furanyl)]-pyrido-[3,2-a:2′,3′-c]phenazine);[(phen)2Ru(dppz)]2+:ruthenium bis(phenanthroline)-pyrido-(3,2-a:2′,3′-c)phenazine.
3 讨论
自从明星配合物[Ru(phen)2(dppz)]2+作为优良的DNA光开关被发现,化学家们开始对该配合物进行结构修饰,努力探索出分子结构与DNA作用动力学的关系,为开发出新型DNA探针及抗肿瘤药物奠定重要的基础。本论文通过化学合成方法制备出了dppz配体10,13-位由两个芳香基取代的4种[(phen)2Ru(dppz)]2+衍生物,并对苯并噻唑类中间体、目标配合物进行了核磁共振和质谱的表征。文献[20]报道的邻苯二胺类物质在空气中极其不稳定,通常是除去溶剂后直接用于下步反应。本研究对于不稳定的邻苯二胺衍生物通过快速溶解样品于经K2CO3过滤的氘代氯仿中,得到了该化合物的核磁共振图谱及质谱。同时,4种配合物具有与母体配合物相似的紫外-可见吸收光谱,进一步验证目标配合物结构。目标配合物与DNA的相互作用目前在研究中,有望为开发出新型DNA探针及基于DNA键合的药物奠定一定的理论基础。

