蟾蜍灵通过程序性坏死途径诱导人胃癌细胞SGC-7901死亡
宫鹏超 李艳兰 孔翠翠 田 昕*
(1.中国医科大学附属第一医院肿瘤研究所二室,沈阳 110001;2. 中国医科大学肿瘤医院中心试验室,沈阳 110001)
我国是肿瘤高发国家,胃癌是消化系统恶性肿瘤之一,多数患者发现时已属晚期阶段。晚期胃癌的治疗方法主要以化学药物治疗为主,但是在临床药物治疗过程中,肿瘤细胞会逐渐产生以抗凋亡为主要特征的耐药性[1],使抗肿瘤药物失去对其的杀伤作用。然而,在近年研究[2]中显示,当传统的凋亡途径受到抑制时,细胞会通过程序性坏死这种后备的细胞死亡途径引起细胞的死亡。蟾蜍灵(Bufalin)的抗癌作用在近年来成为了研究热点,其分子式为C24H34O4,相对分子质量为386.5,是从中华大蟾蜍或黑眶蟾蜍耳后腺及皮肤腺的干燥分泌物中提取的主要成分之一。蟾蜍灵通过凋亡途径诱导肿瘤细胞死亡的观点被大多数研究[3-4]所认同。但是在回顾既往研究[4]成果时发现,蟾蜍灵能够诱导肿瘤细胞发生非凋亡性死亡。本研究将蟾蜍灵(Bufalin)作用于胃癌SGC-7901细胞,探讨蟾蜍灵诱导胃癌SGC-7901细胞发生程序性坏死的机制,为蟾蜍灵诱导胃癌细胞死亡的机制提供新的理论依据。
1 材料与方法
1.1 材料
人胃癌SGC-7901细胞株由中国医科大学附属第一临床医院肿瘤研究所二室提供。胎牛血清(美国Mediatech公司),RPMI 1640培养基(美国HyClone公司),蟾蜍灵、MTT、DMSO(二甲基亚砜)(美国Sigma公司),4,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色试剂盒(碧云天生物技术研究所),碘化丙啶(propidium iodide,PI)(北京索莱宝科技有限公司),ECL发光液(美国Thermo Fisher Scientific公司),受体相互作用蛋白激酶1(receptor interacting protein kinase 1, RIP1)抗体(英国Abcam公司),HRP标记的山羊抗兔IgG抗体(北京鼎国昌盛生物技术有限公司),RIP1蛋白抑制剂(necrostain-1,NEC-1)。
1.2 检测方法
1.2.1 细胞培养及分组
将人胃癌SGC-7901细胞培养在含10%(体积分数)胎牛血清的RPMI 1640培养基中,细胞在37 ℃、5%(体积分数)CO2、饱和湿度下培养。对照组的SGC-7901细胞中加入RPMI 1640培养液继续培养,不加任何干预因素(蟾蜍灵浓度为0)。实验组的SGC-7901细胞按照实验目的加入不同浓度的蟾蜍灵(50、100、150、200 nmol/L)。两组细胞继续培养相应时间。
1.2.2 MTT法检测细胞存活率
每孔100 μL细胞悬液,将细胞以1×105/mL的密度种植在96孔板中,待次日待细胞处于对数生长期时,对照组中加入培养液,实验组中加入不同浓度蟾蜍灵继续培养相应时间。96孔板中每个浓度设6个平行孔。处理时间结束后,在每孔中加入5 g/L的MTT 20 μL,在37 ℃、5% (体积分数)CO2的条件下孵育4 h后吸除孔内上清液,加入150 μL DMSO震荡10 min,使沉淀充分溶解。酶标仪490 nm测定吸光度。根据MTT实验结果,选择蟾蜍灵浓度相同时,24、48 h两组差异较大的浓度作为后续实验组的蟾蜍灵浓度值。
1.2.3 DAPI染色法观察细胞核形态
将处于对数生长期细胞按适宜密度接种于6孔板中,对照组加入RPMI 1640培养液,实验组加入蟾蜍灵(100 nmol/L)处理24、48 h,待处理时间结束后,吸除对照组及实验组孔内液体,预冷PBS洗涤细胞,室温下固定15 min,吸除固定液并加入少量DAPI染色液,室温放置3~5 min后,用磷酸盐缓冲液(PBS)轻柔洗涤细胞5 min,3次,直接在荧光显微镜下观察并记录实验结果。
1.2.4 透射电镜观察细胞超微结构
离心收集对照组及实验组(100 nmol/L,24、48 h)细胞,在细胞沉淀中加入2.5%(体积分数)戊二醛,4 ℃固定细胞沉淀6~12 h后吸出固定液,加入预冷PBS放置4 h,加入1%(体积分数)锇酸固定1 h,PBS洗涤细胞后经过脱水、包埋、修块、切片、染色等步骤,透射电镜观察并记录实验结果。
1.2.5 流式细胞术检测细胞坏死率
将细胞按适宜密度种植于6孔板中,次日待细胞处于对数生长期时,对照组更换培养液继续培养,实验组1加入蟾蜍灵(50、100、150、200 nmol/L)继续培养48 h,实验组2经NEC-1(20 μmol/L)预处理2 h后加入蟾蜍灵(100 nmol/L)继续培养48 h。处理时间结束后,用不含EDTA的胰酶收集细胞,PBS洗涤细胞沉淀,1 000 r/min离心5 min,3次,加入5 μL PI,混匀细胞沉淀后流式细胞仪检测并记录结果。
1.2.6 Western blotting法检测RIP1蛋白表达量
用BCA蛋白定量试剂盒确定收集的两组细胞总蛋白浓度,确定浓度的样品煮沸后于-80 ℃保存。蛋白样品经聚丙烯酰胺凝胶电泳法10%(质量分数)分离胶分离,恒流湿转至聚偏二氟乙烯(PVDF)膜上,5%(质量分数)脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜或室温孵育2 h,洗膜后二抗室温孵育2 h,ECL法显色。Image J软件分析条带灰度值。
1.3 统计学方法

2 结果
2.1 蟾蜍灵对细胞活性的影响
蟾蜍灵对SGC-7901细胞活性的抑制作用有明显剂量依赖性,随着蟾蜍灵浓度的升高细胞活性呈现下降趋势。蟾蜍灵在24 h和48 h的IC50分别为(111.55±7.25)nmoL/L和(90.51±2.50)nmol/L。蟾蜍灵处理细胞24、48 h时,实验组与对照组相比,差异均有统计学意义(P<0.01)。药物浓度相同情况下,48 h与24 h实验结果相比,除50 nmol/L浓度组差异无统计学意义外,其余浓度组差异均有统计学意义(P<0.01),详见图1。

图1 不同浓度蟾蜍灵处理 SGC-7901细胞24、48 h后对细胞存活率的影响Fig.1 Effect of different concentrations of Bufalin on cell viability after 24 h and 48 h treatment of SGC-7901 cells
**P<0.01vscontrol group;#P<0.05,##P<0.01vs24 h at the same concentration.
2.2 DAPI染色法观察细胞核形态
RPMI 1640处理对照组, 蟾蜍灵(100 nmol/L)处理对照组,处理时间结束后(24 h、48 h),细胞核没有出现明显凋亡特征性改变,与对照组相比并无明显变化,详见图2。
2.3 透射电镜观察细胞超微结构
实验组经蟾蜍灵(100 nmol/L)处理24 h后观察发现,细胞膜连续性出现破坏,并伴有大量细胞内空泡的产生,细胞核无明显改变。蟾蜍灵(100 nmol/L)处理细胞48 h后观察发现,细胞膜完全崩解,细胞核未见明显改变,详见图3。
2.4 流式细胞术检测细胞坏死率
实验组细胞经不同浓度蟾蜍灵(50、100、150、200 nmol/L)处理细胞48 h后,随着药物浓度的逐渐升高,细胞坏死率由对照组的4.52%±0.84% 增高至实验组的8.88%±1.32%、20.26%±2.70%、41.5%±1.77% 和48.95%±2.92%,差异有统计学意义 (P<0.01)(图4)。细胞经RIP1蛋白抑制剂NEC-1预处理2 h后,再用蟾蜍灵(100 nmol/L)处理细胞48 h,细胞坏死率由未经NEC-1预处理时的24.36%±2.14% 降低至16.21%±4.28%,差异有统计学意义(P<0.05)(图5)。

图2 蟾蜍灵处理SGC-7901细胞24、48 h后对细胞核形态的影响Fig.2 Effect of Bufalin on the morphology of nuclear changes after 24 and 48 h treatment of SGC-7901 cells
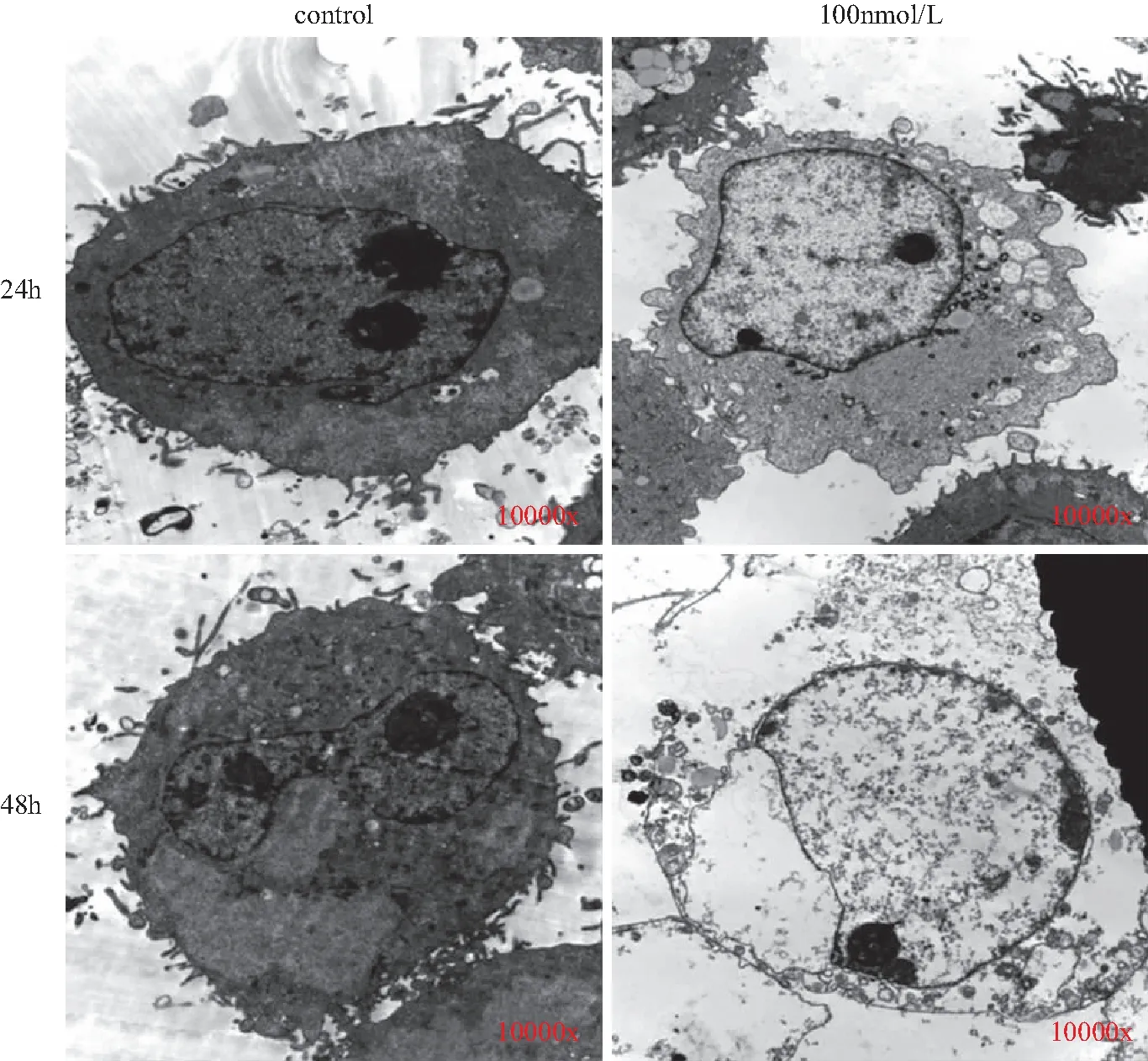
图3 蟾蜍灵处理SGC-7901细胞24、48 h后细胞形态学改变(10 000×)Fig.3 Morphological changes of cells treated with Bufalin after 24 and 48 h in SGC-7901 cells

图4 不同浓度蟾蜍灵处理SGC-7901细胞48 h后对细胞坏死率的影响Fig.4 Effect of different concentrations of bufalin on the necrosis rate of SGC-7901 cells after 48 h
2.5 Western blotting法检测RIP1蛋白的表达
用不同浓度蟾蜍灵(50、100、150、200 nmol/L)处理SGC-7901细胞48 h后,与对照组相比,蟾蜍灵浓度分别为100、150、200 nmol/L的实验组细胞RIP1蛋白的表达明显增加。50 nmol/L浓度组与对照组比较差异无统计学意义,其余浓度组与对照组相比,差异均有统计学意义(P<0.05),详见图6。

图5 RIP1蛋白抑制剂NEC-1处理后对细胞坏死率的影响Fig.5 Effect of RIP1 protein inhibitor NEC-1 on cell necrosis
**P<0.01vscontrol group;#P<0.05vsBufalin at the same concentration and time;NEC-1:necrostain-1.
3 讨论
胃癌在全世界及我国范围内均位于恶性肿瘤死亡前列。在临床治疗过程中,晚期胃癌患者占较大比重,而晚期胃癌的治疗手段主要以化学药物治疗为主。虽然现阶段的临床药物治疗针对的靶点与治疗机制并不相同,但都是以诱导肿瘤细胞发生凋亡为主,从而达到杀死肿瘤细胞的目的[5-6]。但是,在实际临床治疗过程中,肿瘤细胞对药物产生凋亡抵抗的问题,是临床治疗过程中一个难以克服的障碍[7]。

图6 不同浓度蟾蜍灵处理SGC-7901细胞48 h后对RIP-1表达量的影响Fig.6 Effect of different concentrations of Bufalin on the expression of RIP-1 in SGC-7901 cells after 48 h treatment
*P<0.05,**P<0.01vscontrol group.
在2005年Degterev等[8]首次提出了坏死性凋亡(necroptosis)这一概念。程序性坏死发生时的形态学改变是以坏死样的改变为主要特征,细胞膜完整性的破坏和细胞器的肿胀发生于程序性坏死的早期,并且在局部会伴有严重的炎性反应[9-10],同时,又受到特定的细胞信号通路调控,是一种不依赖于凋亡信号通路中Caspase信号分子调控的有序的细胞死亡过程。程序性坏死途径可由各种因素所激活,而由肿瘤坏死因子(tumor necrosis factor-α,TNF-α)这种传统的多效性的细胞因子所诱导的“死亡受体-RIP1/RIP3-MLKL-PGAM5”程序性坏死途径研究的最为深入[11-13]。在该信号通路中,能够传递死亡信号的必要条件,就是形成RIP1、RIP3和MLKL所组成的坏死复合物(necrosome)[14-15],而形成复合物的重要启动分子就是RIP1。随着RIP1的活化,RIP3、MLKL及PGAM5等下游分子相继活化。因此,本研究通过MTT、流式细胞术检测坏死率、透射电镜观察细胞超微结构和Western blotting法检测等一系列方法,探讨蟾蜍灵诱导胃癌SGC-7901细胞程序性坏死的可能机制。
MTT法检测细胞活性常用于研究药物对细胞增生的影响[16]。本研究MTT实验结果表明,蟾蜍灵对SGC-7901细胞生长的抑制作用呈时间和剂量的依赖性。DAPI染色后荧光显微镜观察细胞核形态是否发生改变,可以初步判断细胞是否发生凋亡。荧光显微镜观察结果表明,细胞经蟾蜍灵处理后并不会发生典型的凋亡性改变,说明蟾蜍灵诱导SGC-7901细胞死亡还可能通过其他途径。细胞发生程序性坏死时在形态学上的改变主要以细胞坏死的特点为主。透射电镜是观察细胞超微结构改变的金标准。透射电镜结果中可以发现,实验组中细胞膜与胞质的变化最为明显,表明细胞死亡的方式并不是凋亡,而是坏死。随后,笔者通过PI染色后流式细胞仪检测这种检测细胞坏死的常用手段发现,随着蟾蜍灵的浓度升高,细胞的坏死率随之升高,呈明显的剂量依赖性。RIP1特异性抑制剂NEC-1可以使细胞坏死率降低,进一步证明了蟾蜍灵可以使SGC-7901细胞发生程序性坏死。Western blotting法检测结果表明,随着蟾蜍灵浓度的增加,程序性坏死关键分子RIP1的表达量随着蟾蜍灵浓度的升高而逐渐升高。
综上所述,本研究以胃癌SGC-7901细胞作为模型,来评估蟾蜍灵诱导的程序性坏死。实验结果证明蟾蜍灵可以通过RIP1介导的程序性坏死途径诱导胃癌SGC-7901细胞死亡。本研究为蟾蜍灵诱导胃癌细胞死亡的机制提供新的理论依据。

