联合CRP/ALB比值和NLR对宫颈鳞状细胞癌预后的评估价值
,,
宫颈癌是女性常见的恶性肿瘤之一,是仅次于乳腺癌的女性第二大恶性肿瘤[1]。宫颈癌的发病率约为1/1 000,死亡率为30.5/10万,5年总生存率为54%~90%[2]。宫颈癌以鳞状细胞癌(squamous cell carcinoma,SCC)为主,约占全部病理分型的85%左右。因此,寻找可靠、简单经济的预后评估指标显得尤为重要。近年来有研究显示各种炎症指标可以用于肿瘤的预后分析[3]。本研究回顾性分析SCC患者临床资料以及常见炎症指标对预后的影响。
1 资料与方法
1.1 一般资料 选取2008年9月—2010年12月中山大学肿瘤医院收治的SCC患者168例和2009年1月—2010年12月南方医科大学附属小榄医院收治的SCC患者30例,中位年龄44(28~79)岁,所有病例均经病理诊断为SCC。
1.2 纳入标准 ①经病理诊断确诊为原发性宫颈癌,并按照国际妇产科协会标准确定临床分期[4],具有完整的临床及随访资料;②排除合并其他恶性肿瘤或基础疾病、临床及随访资料不全的患者;③未合并其他肿瘤、感染性疾病、血液系统疾病、严重的肝、肾功能紊乱等;④术前1周内有进行血常规和生化常规检查结果。
1.3 治疗方案与随访 治疗方案根据宫颈癌患者的临床分期确定,分为3种:手术治疗、手术加放化疗、放疗和(或)化疗。术后对患者进行随访,采取门诊复诊和电话随访方式,第一年随访1次,第二年起半年随访1次,随访截至2016年12月31日。失访患者按删失值处理,纳入生存分析。
1.4 临床资料收集 详细记录患者的年龄、性别、肿瘤位置、肿瘤大小等临床病理参数,收集所有患者术前1周内的血常规和生化报告单,包括白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数、血清C反应蛋白(creactive protein,CRP)和白蛋白(albumin,ALB)浓度,并计算得出中性粒细胞/淋巴细胞比值(neutrophils-to-lymphocytes ratio,NLR)、CRP/ALB比值和血小板淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)。CRP和ALB采用日本日立公司生产的7600生化分析仪和上海罗氏诊断生产的Cobas702进行检测;NLR、WBC、PLR采用希森美康公司生产的XE5000和XE-2100血细胞计数仪及其配套试剂进行检测。
使用均值作为最佳分界点。NLR以1.60为界,分为低值组(NLR≤1.60)和高值组(NLR>1.60);CRP/ALB比值以0.022为界,分为低值组(CRP/ALB≤0.022)和高值组(CRP/ALB>0.022)。
1.5 统计学处理 采用SPSS 19.0统计软件;生存率采用Kaplan-Meier法,并用log-rank法分析;预测价值采用多因素Cox回归分析法;应用MedCalc软件比较ROC曲线下面积(area under curve,AUC)的差异;以P<0.05为差异比较有统计学意义。
2 结果
2.1 患者的临床资料特征 共纳入198例患者。中位年龄44(28~79)岁,中位生存时间为83个月,3年、5年、7年生存率分别为82%、80%、78%;3年、5年、7年中位生存时间分别为35个月、59个月、83个月。患者的临床资料特征见表1。
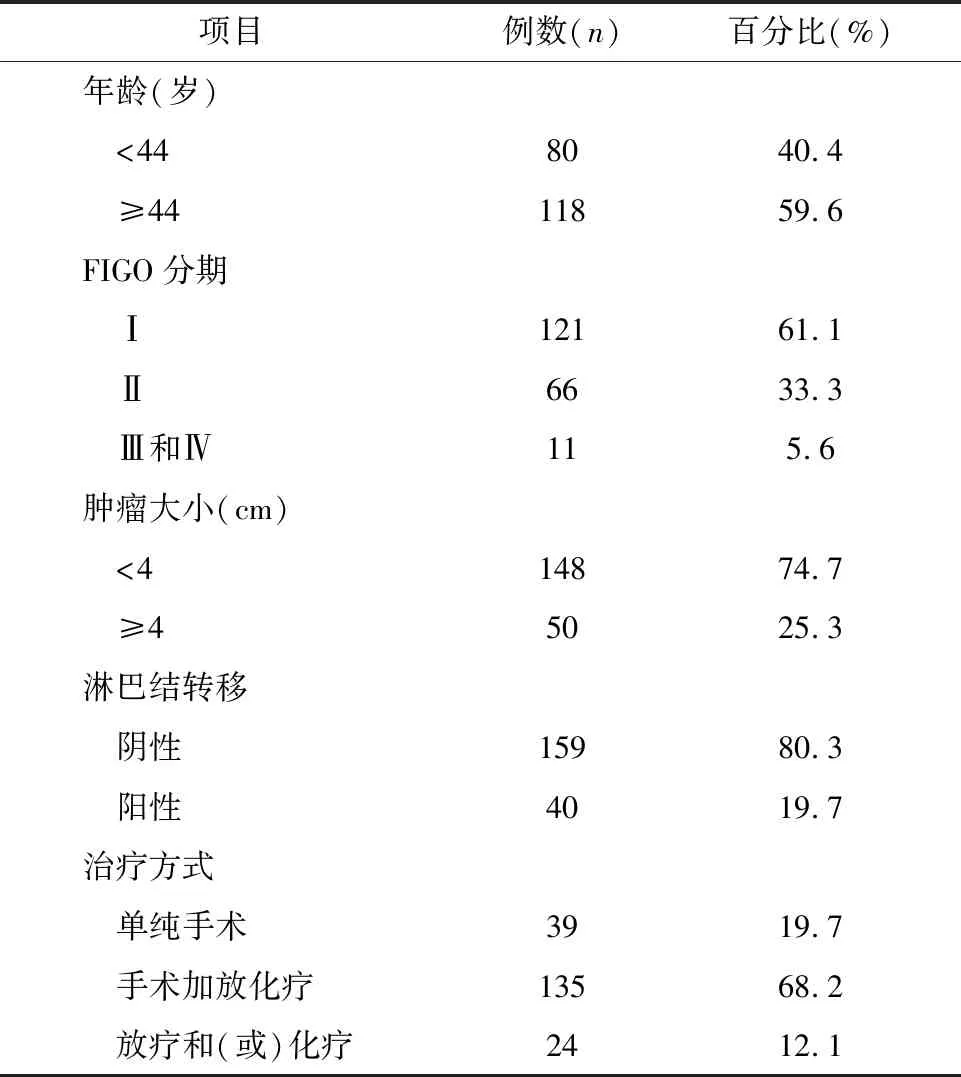
表1 SCC患者的主要临床资料特征
2.2 术前NLR、CRP/ALB比值与临床各病理因素单因素和多因素分析 对可能影响SCC患者生存的因素,分别进行了单因素和多因素Cox回归分析。淋巴结转移(HR=0.41;95%CI: 0.22~0.79;P=0.008)、治疗方式(HR=2.72;95%CI: 1.46~5.07;P=0.002)、CRP/ALB比值(HR=2.36;95%CI: 1.02~5.47;P=0.045)和NLR(HR=2.28;95%CI: 1.05~4.97;P=0.038)与SCC的预后相关,表2。
2.3 术前NLR、CRP/ALB比值与SCC患者预后的关系 Kaplan-Meier生存分析显示SCC患者7年生存率在CRP/ALB比值高组和CRP/ALB比值低组分别为71%和91%(图1A),而在NLR高组和低组分别为74%和88%(图1B)。根据以上的结果,将患者分为4组,分别为NLR低组和CRP/ALB比值低组、NLR高组和CRP/ALB比值低组、NLR低组和CRP/ALB比值高组、NLR高组和CRP/ALB比值高组,7年生存率分别为97%、84%、82%和68%,图2。
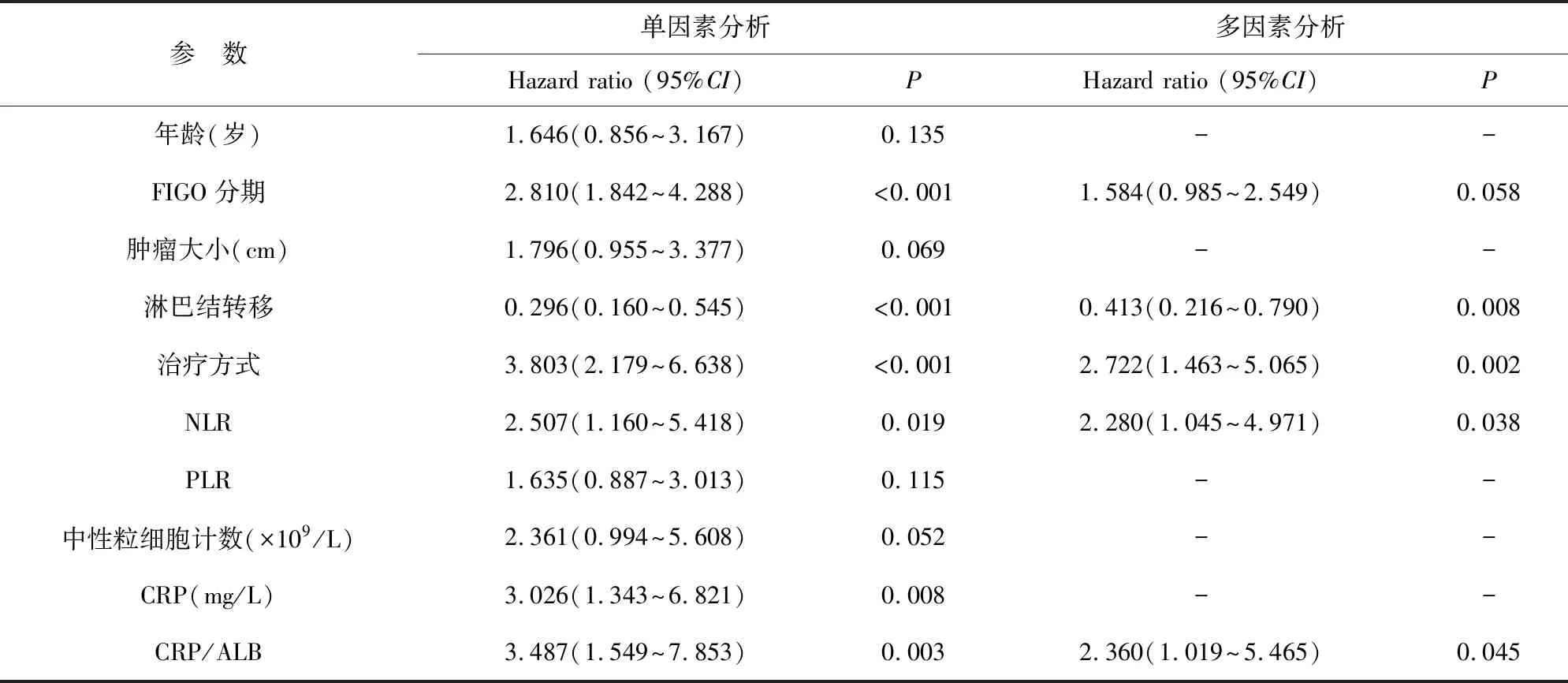
表2 各项参数的单因素和多因素分析结果
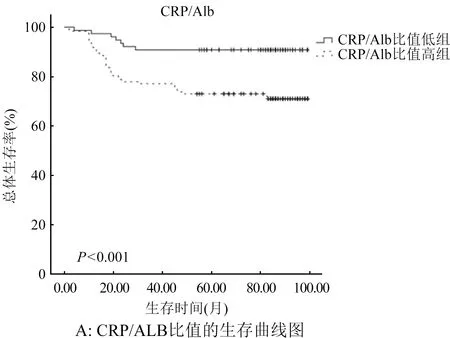
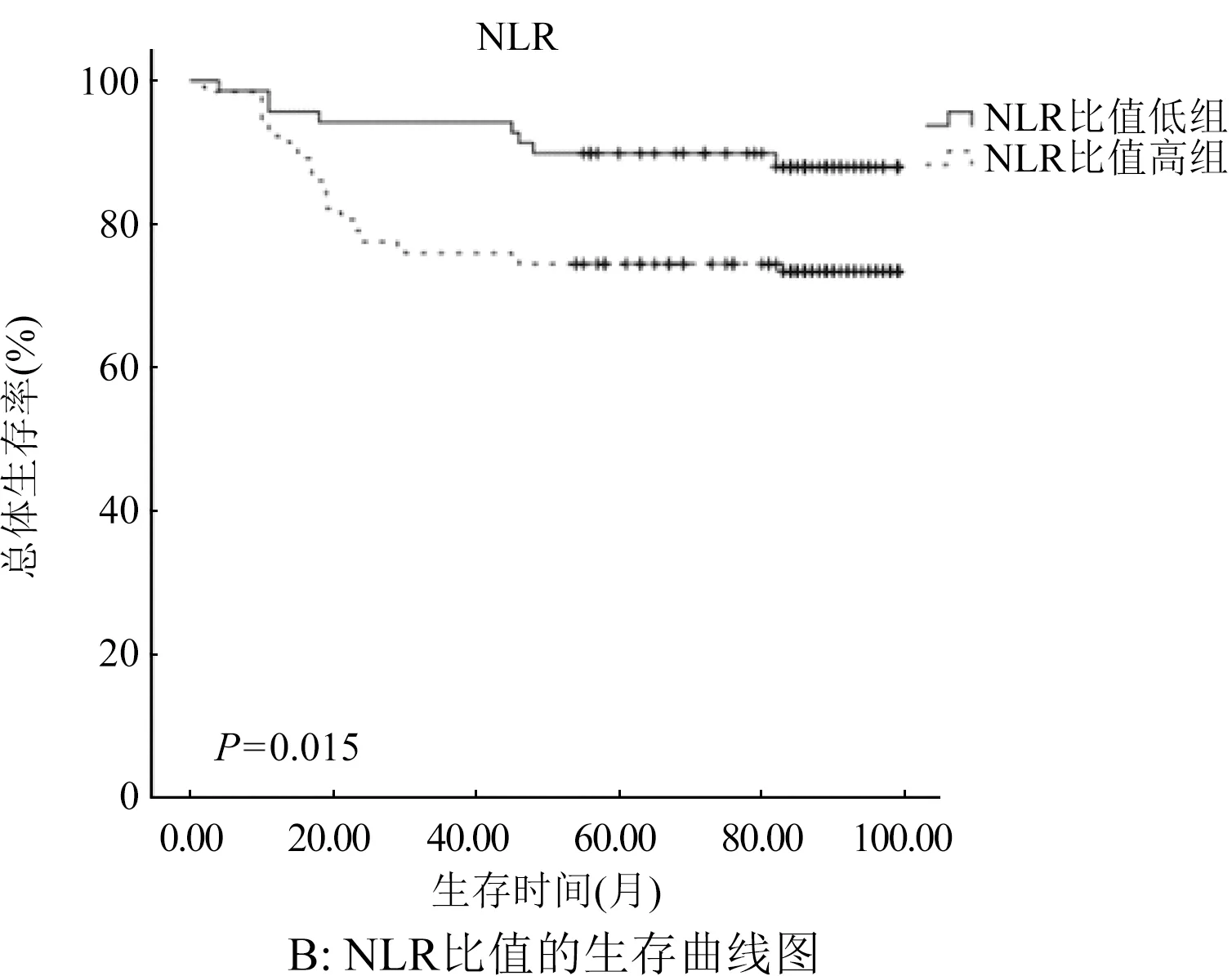
图1 CRP/ALB比值和NLR独立分组的生存曲线
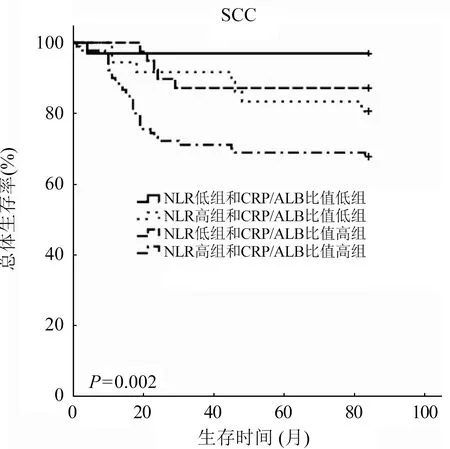
图2 NLR和CRP/ALB比值分组的生存曲线
2.4 CRP/ALB比值、NLR、分期和治疗方式的预后价值比较 在预测患者7年生存率方面,CRP/ALB比值联合NLR、分期和治疗方式的AUC分别为0.678、0.702、0.679(图3);3项指标预测生存率的能力无明显差别(P>0.05)。
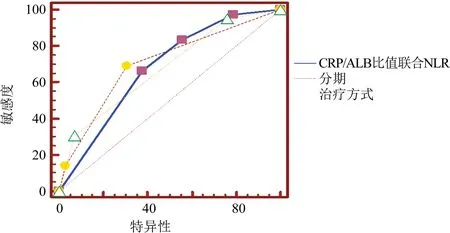
图3 CRP/ALB比值联合NLR与分期和治疗方式预测SCC患者生存率的ROC曲线
3 讨论
机体的炎症反应与癌变、肿瘤进展和转移密切相关。炎症因子能够对人体造成损伤,促进了肿瘤的恶性进展。因此,系统性炎症反应与肿瘤的预后有明显的联系,有大量研究表明,宿主全身炎症反应是癌症患者的重要独立预后预测因子,并且治疗前全身炎症参数可用于预测癌症生存期[5-6]。
本研究探讨了临床指标(分期、年龄、肿瘤大小、淋巴结转移、治疗方式)以及临床常用的炎症指标及其比值(CRP、CRP/ALB比值、NLR、PLR、中性粒细胞数)与SCC预后的关系。本研究为双中心研究,患者分别来自中山大学肿瘤医院和南方医科大学附属小榄医院,单因素和多因素分析显示是否淋巴结转移、不同的治疗方式、CRP/ALB比值和NLR与SCC的预后相关。
Bodner-Adler等[7]研究发现CRP水平可作为宫颈少见组织学亚型腺癌患者的独立预后参数。血清ALB浓度降低与营养不良、体重减轻及肿瘤密切相关[8]。CRP是一种急性时相反应蛋白,是全身性炎症反应的标志物。ALB不仅反映机体的营养水平,也能反映机体的炎症状态。近年来,越来越多的研究关注CRP/ALB比值与肿瘤预后的联系,研究结果证实,CRP/ALB比值能独立判断肝癌、食管鳞状细胞癌、肺癌、胃癌、肠癌的预后生存[9-11]。本研究也证实CRP/ALB比值可以预测SCC患者的生存率,是SCC的独立预后因素。
中性粒细胞和淋巴细胞是机体免疫系统和肿瘤微环境的重要组成成分,NLR是机体炎症和免疫状态的一个重要指标。中性粒细胞数量升高或淋巴细胞数量减少均可引起NLR升高。中性粒细胞浸润可增加肿瘤细胞的增殖和迁移能力,而淋巴细胞总数减少或者亚群的变化则会引起机体细胞免疫功能下降,减弱其对肿瘤细胞的杀伤效果。因此,高NLR往往提示肿瘤患者预后不良[12-13]。黄金兰等[14]研究表明:患者治疗前NLR水平可作为独立预后因子,在胶质母细胞瘤的临床预后判别中具有重要应用价值。本研究也发现NLR升高是SCC一个独立的预后因素,NLR低组与高组相比较,生存期均有明显的统计学差异(P=0.015),而PLR则与SCC的预后不相关。Lee等[15]对1 061例宫颈癌患者的研究结果也显示NLR是宫颈癌的一个独立预后因素,与本研究结果相似。
术前检测CRP/ALB比值和NLR是经济、简便的临床预后评估指标,在各级医院中,血常规和生化常规是术前常规检查项目,只需在患者治疗前常规的检查中调取数据,不需要额外的检查,大大减轻患者的经济负担和优化临床资源的使用。
本研究还发现联合CRP/ALB比值和NLR可以提高SCC的预后价值。CRP/ALB比值和NLR均升高组和均下降组,7年生存率分别为68%和97%,两组生存时间差异明显(P<0.001)。但是,CRP/ALB比值和NLR与临床分期和治疗方式相比,在预测SCC患者7年生存率的能力无明显差别。CRP/ALB比值和NLR是一个连续性的变量,而分期、治疗方式都是分段变量,连续性变量对预后判断有明显的优势。
综上所述,NLR和CRP/ALB比值是简便、低廉的SCC预后评估指标,联合两者可以更好的预测患者的生存期。

