MiR-514与胃癌细胞凋亡的关系及机制
, , ,, ,
凋亡异常是肿瘤细胞生存能力强的重要因素,许多恶性肿瘤细胞都具有较强的凋亡抵抗能力,这种能力使癌细胞具有较强的生存能力,导致肿瘤进展[1]。胃癌是我国常见的恶性肿瘤,发病率、死亡率居于我国恶性肿瘤第2位[2],对人民危害极大。胃癌具有进展迅速、生长快的特点,患者的综合治疗效果不佳,预后较差[3]。胃癌具有这些恶性生物学特点其中重要原因在于胃癌细胞具有较强的凋亡抵抗能力,这种能力使胃癌细胞存活能力强,从而导致肿瘤进展[4]。因此,如果能够逆转胃癌细胞的凋亡抵抗能力,使其易于凋亡,则有可能抑制肿瘤的进展,从而改善治疗效果及预后。近期通过促进肿瘤细胞凋亡而抑制肿瘤进展的研究已成为本领域研究的热点,但迄今为止尚未取得突破性进展。
胃癌细胞的凋亡是由多种基因、通路等共同作用而导致的,肿瘤细胞的凋亡情况是这些因素共同作用的结果[5]。近年来,有关微小RNA(microRNA,miRNA)与肿瘤关系的研究越来越受到关注。MiRNA是一种由22~28个碱基组成的单链核苷酸,在细胞内基因的转录调控过程中发挥了重要作用[6]。研究发现miRNA与胃癌关系密切,在胃癌的增殖、侵袭、凋亡过程中都发挥了重要作用[7-9]。MiR-514是miR家族的成员之一,有研究表明,miR-514在肾癌组织中表达降低,具有抑癌基因的功能[10]。但miR-514在胃癌中的表达情况还未见报道,miR-514在胃癌中是否发挥了作用及其机制也不明确。本研究分析miR-514表达与胃癌细胞凋亡的关系及其作用机制,为胃癌治疗新靶点的阐明做出贡献。
1 资料与方法
1.1 临床资料 选取2016年1月—2017年10月在河北医科大学第四医院普通外科住院并手术的胃癌患者80例,均经开腹或腹腔镜手术切除原发病灶。取新鲜的胃癌组织及癌旁正常胃黏膜组织标本,置于液氮保存。患者中男性58例,女性22例;患者年龄36~80(61.4±10.3)岁。肿瘤长径≥5 cm者53例,<5 cm者27例;肿瘤浸润位于浆膜内者42例,浸润达浆膜外者38例;根据国际抗癌联盟第8版TNM分期标准,Ⅰ、Ⅱ期者27例,Ⅲ、Ⅳ期者53例;肿瘤为中高分化者43例,低分化者37例;淋巴结转移阳性者61例,阴性者19例;有远处转移者9例,无远处转移者71例。患者手术前均未接受过化疗、放射治疗、靶向治疗等针对胃癌的治疗。患者不合并严重免疫系统疾病、严重感染及其他恶性肿瘤。研究经河北医科大学第四医院医学伦理委员会批准并取得患者的知情同意。
1.2 细胞株及主要试剂 人低分化细胞株MGC803购自中国科学院上海典型物保藏中心,于河北医科大学第四医院科研中心保种传代。MiR-514、Bcl-2、Bax、x连锁凋亡抑制蛋白(x-linked inhibitor of apoptosis protein, xIAP)及内参照基因U6、GAPDH的引物序列由上海生工生物公司合成。miR-514模拟物及阴性对照序列由美国Ambion公司合成。TaqMan Real-Time PCR试剂盒为美国Applied Biosystems公司产品。PCR试剂及反转录试剂盒为美国Invirtogen公司产品。噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)为美国Sigma公司产品。实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)仪(AB-7900型)为美国Thermo Fisher公司产品。
1.3 RT-PCR技术检测miR-514及Bcl-2、Bax、xIAP表达水平 分别从组织及细胞株中提取总RNA,测定其浓度及纯度。测定完毕后进行逆转录实验合成各靶基因的cDNA单链。然后取2 μL的cDNA进行PCR反应。检测miR-514应用TaqMan RT-PCR试剂盒,严格按试剂盒指示说明进行操作,以U6为内参照基因。Bcl-2、Bax、xIAP的基因检测应用PCR试剂盒按说明书进行操作。建立20 μL的PCR体系,包括10 μL of 2×miRcute miRNA Premix(检测miR-514)或SYBR Green Mix(检测Bcl-2、Bax、xIAP基因)、上下游引物各0.5 μL、2 μL反转录产物、DEPC处理水7 μL。进行PCR循环,共进行40个循环。2-ΔΔCt法计算目的基因的表达水平,以目的基因的表达水平与内参照基因的表达水平的比值代表目的基因表达强度。
1.4 细胞培养及miR-514模拟物转染、分组 MGC803细胞在含有10%胎牛血清的DMEM培养基中培养,2~3 d传代一次,当细胞处于生长期,融合达到60%~70%时进行后续实验。细胞分为不转染组(空白组)、miR-514模拟物转染组(转染组)及阴性对照序列转染组(阴性组)。按操作说明进行转染,于转染后48 h进行后续实验。
1.5 MTT法检测各组细胞活性 各组MGC803细胞调整浓度接种于96孔板,每孔接种细胞为1×105个,继续培养细胞至附壁。实验结束前4 h向各孔内加入浓度为5 mg/mL的MTT共20 μL,继续培养4 h弃去培养液,然后在每孔内加入150 μL的二甲基亚砜(dimethyl sulfoxide, DMSO)。震荡15 min后用酶标仪在450 nm处读数,用光密度值(optical density, OD)代表细胞的活性。实验重复3次。
1.6 流式细胞术检测胃癌细胞的凋亡率 各组MGC803细胞转染后48 h进行流式细胞术检测。以磷酸盐缓冲液漂洗、胰酶消化后收集细胞,将细胞浓度调整为5×105/mL加入到500 μL缓冲液中。分别加入10 μL of Annexin V-FITC和10 μL of Pl染液,继续孵育15 min。将样品上机检测,每个样品检测105个细胞。计算细胞的凋亡率。实验重复3次。
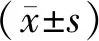
2 结果
2.1 胃癌组织和癌旁正常胃黏膜组织miR-514的表达 胃癌组织中miR-514的相对表达量为(0.3619±0.2103),癌旁正常胃黏膜组织miR-514的相对表达量为(0.6943±0.3032)。胃癌组织中miR-514水平明显低于癌旁正常胃黏膜组织(t=-8.0573,P<0.001)。
2.2 胃癌组织中miR-514表达强度与患者临床病理特征的关系 MiR-514表达与肿瘤的淋巴结转移有关(t=-2.5620,P=0.0123),与性别、年龄、肿瘤长径、浸润深度、TNM分期、分化程度、远处转移情况均无关(P>0.05)。表1。
表1 胃癌组织中miR-514表达水平与临床病理特征的关系

例数(n)miR-150表达水平性别 男580.3697±0.2139 女220.3414±0.2037年龄 ≥60岁490.3562±0.1945 <60岁310.3708±0.2362肿瘤长径 ≥5 cm530.3768±0.2105 <5 cm270.3326±0.2108浸润深度 浆膜内420.3336±0.1991 浆膜外380.3931±0.2204TNM分期 Ⅰ~Ⅱ期270.3240±0.2119 Ⅲ~Ⅳ期530.3812±0.2088分化程度 中高分化430.3525±0.2265 低分化370.3728±0.1922淋巴结转移 阳性610.3294±0.2084 阴性190.4662±0.1850远处转移 有90.3552±0.1924 无710.3627±0.2137
2.3 MiR-514转染对人胃癌细胞株MGC803活性的影响 MiR-514模拟物转染人胃癌细胞株MGC803后48 h检测,转染组细胞活性(0.522±0.062),阴性组细胞活性(1.108±0.145),转染组细胞的活性明显降低(P<0.05)。图1。
注:∗与阴性组比较,P<0.05图1 miR-514模拟物转染对人胃癌细胞株MGC803活性的影响
2.4 MiR-514转染对人胃癌细胞株MGC803凋亡的影响 MiR-514模拟物转染人胃癌细胞株MGC803后细胞的凋亡率明显增高(F=36.451,P<0.001)。表2、图2。
表2 各组人胃癌细胞株MGC803凋亡率情况
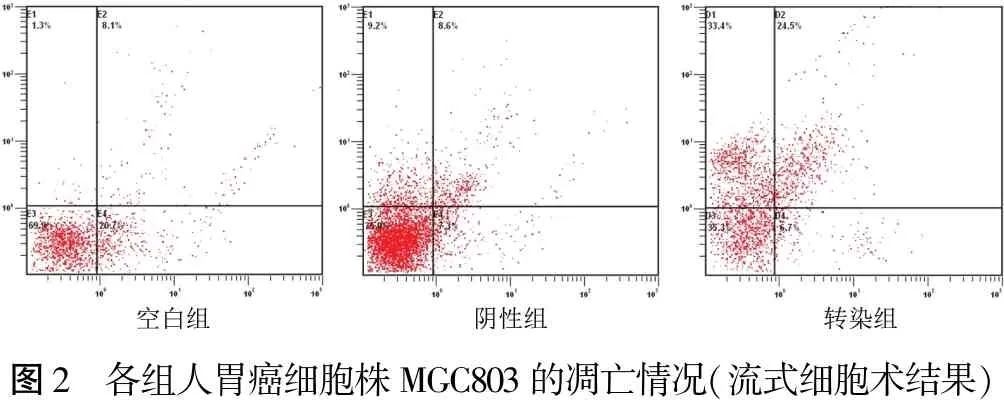
图2 各组人胃癌细胞株MGC803的凋亡情况(流式细胞术结果)
2.5 MiR-514转染对人胃癌细胞株MGC803凋亡相关基因Bcl-2、Bax、xIAP的影响 转染后凋亡相关基因Bcl-2、xIAP的mRNA和蛋白表达明显降低,而Bax的mRNA和蛋白表达明显增高(均P<0.05)。图3。
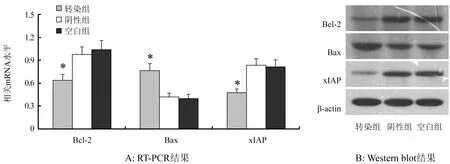
注:*与阴性组和空白组相比,P<0.05图3 各组细胞Bcl-2、Bax、xIAP基因mRNA和蛋白表达水平
3 讨论
胃癌是我国的高发恶性肿瘤之一,居各种恶性肿瘤发病率的第3位[11]。近年来发病率虽然略有下降,但总体疗效并未获得明显改善,5年生存率一直在30%左右。迄今为止,外科手术仍被认为是治疗胃癌的最主要手段,但其复发与转移是导致治疗失败的主要原因,也是胃癌患者的主要死因[12-13]。胃癌进展迅速的重要原因之一在于胃癌细胞具有较强的凋亡抵抗能力,这种能力使胃癌细胞易于存活,难以被机体自身的抗体或外界的药物杀灭,进而导致肿瘤进展。目前研究已证实胃癌细胞对铂类化疗药物的耐药形成主要来源于其具有的凋亡抵抗能力[14],胃癌细胞的这种能力严重影响化疗效果。因而近年来调控胃癌细胞凋亡已成为胃癌治疗领域的一个热点。由于胃癌细胞的凋亡调控是由包括多种基因、通路蛋白、miR、长链非编码RNA(long noncoding RNA,lncRNA)等多种分子互相作用而形成的网络式调控体系共同决定的,其机制复杂,迄今尚未找到在网络中存在的关键分子,因而胃癌凋亡调控也未取得突破性进展。
在参与胃癌基因调控的分子中,近年来miR已受到越来越多的关注,并在胃癌研究中取得了很多成果。MiR属于一类小RNA(small RNA),一般长约22~28个核苷酸,不编码蛋白质;它普遍存在于生物界,具有保守性﹑基因簇集现象和时空特征等生物学特性。MiR的作用极为广泛,参与了生物体的各种生命现象,如发育﹑细胞分化﹑增殖和凋亡途径[15]。miR的作用在于它能调控成组的靶基因,因而与单个基因相比,miR具有更为强大的调控功能。迄今已发现多种miR在胃癌中存在异常表达并发挥了重要作用。研究发现miR-30可以通过调节胃癌细胞的自噬功能而减弱其耐药性[16]。MiR-203a可以通过转录调控抑制胃癌细胞的增殖[17]。还有研究发现miR-93可以促进胃癌的侵袭[18]。这些研究表明miR在胃癌中发挥了广泛的调控作用,且作用的方式多样,有的具有原癌基因的功能,有的具有抑癌基因的作用。深入研究miR在胃癌中的作用效果及机制有良好的前景。本研究中的miR-514也是近年来发现与肿瘤密切相关的miR之一,在肾透明细胞癌中表达降低,可能参与了肿瘤的侵袭转移过程[19]。本研究结果显示,miR-514在胃癌组织中的表达水平比癌旁组织明显减低,提示miR-514的表达缺失可能是胃癌发生及进展的原因。进一步研究发现,miR-514表达与肿瘤的淋巴结转移有关,存在淋巴结阳性转移的患者胃癌组织中miR-514表达更低,说明miR-514在胃癌的进展中发挥了作用,有可能成为胃癌新的治疗靶标志。
有关miR-514在胃癌中作用的具体调控机制还不明确,因此我们进一步检测了在胃癌细胞株MGC803中过表达miR-514后细胞凋亡能力的改变。结果发现,转染miR-514模拟物后MGC803细胞的凋亡率明显升高,提示miR-514可能是通过调控胃癌细胞凋亡而发挥作用。Bcl-2是细胞线粒体凋亡途经中的主要基因,其主要功能是维持细胞稳定、减少凋亡[20]。Bcl-2在细胞中可以通过多种途径发挥其凋亡抵抗作用,在肿瘤中Bcl-2存在表达增高现象,是肿瘤细胞产生凋亡抵抗的重要原因[21]。Bax则是促进肿瘤细胞凋亡的重要基因,其主要作用是与Bcl-2结合成为二聚体,其中二者的比例决定了肿瘤细胞的凋亡程度[22]。在肿瘤细胞凋亡调控的研究中,选用合适的方法促进Bax表达、从而促进肿瘤细胞凋亡是目前研究的一个重要领域。xIAP是凋亡抑制蛋白家族中的重要成员之一,具有类似锌指的结构,在多种肿瘤组织中广泛表达,其作用主要是通过直接或间接的作用调控caspase家族中的casepase-3、7、8、9而抑制细胞凋亡,使肿瘤细胞产生凋亡抵抗[23]。进一步检测miR-514模拟物转染前后MGC803细胞中凋亡相关基因Bcl-2、Bax、xIAP的表达情况。本研究结果显示,转染miR-514模拟物后MGC803细胞中Bcl-2、xIAP的mRNA表达明显降低,而Bax的mRNA表达明显增高,提示miR-514通过调控这些基因的转录而发挥了作用,但具体的机制还需要深入研究。
本研究发现miR-514在胃癌组织中存在表达减低的现象,与胃癌患者的淋巴结转移情况有关。miR-514可能通过调控Bcl-2、Bax、xIAP的转录而使细胞出现凋亡抵抗,从而抑制胃癌细胞凋亡、促进胃癌进展。本研究初步证实了miR-514在胃癌凋亡过程中的调控作用,但研究还不够深入,需要进一步的动物实验予以证实,还需要全面的分子间调控研究进行分析。

