长链非编码RNA肿瘤抑制因子对阿霉素诱导的A549细胞凋亡的影响
, , ,翠云,,
癌症是当今人类面临的巨大问题之一,肺癌的发病率和死亡率均位居全部恶性肿瘤之首,并且肺癌的发病率逐年上升,肺癌的发病因素很多,主要包括环境污染、吸烟、作息不规律以及酗酒等。由于肺癌的早期临床表现不典型,在一定程度上限制其早期发现与治疗,肺癌的中晚期治疗以化疗为主[1-4]。阿霉素(doxorubicin,DOX)是临床上被广泛应用于治疗多种恶性肿瘤的化疗药物,但是肿瘤的耐药性影响了其应用[5]。因此探究某些分子在DOX诱导肿瘤细胞凋亡过程中的作用与机制,将为肺癌的治疗提供新的途径。
线粒体是能量代谢中心,线粒体含有很多的膜蛋白,如线粒体融合蛋白1和线粒体融合蛋白2、视神经蛋白1;线粒体分裂蛋白,如动力相关蛋白1、金属肽酶OMA1、线粒体分裂蛋白1[6-7],这些膜蛋白参与线粒体的分裂与融合的过程。有文献报道,线粒体的分裂是细胞凋亡的早期过程,线粒体在介导细胞凋亡过程中发挥重要作用[8]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200 nt且缺乏蛋白质编码功能的RNA,能够在表观遗传水平、转录水平和转录后水平调控基因的表达,广泛参与机体的生理和病理过程[9]。相关研究报道,肺腺癌转移相关转录子1[10]、HOX基因的反义基因间RNA[11]、lncRNA SOX2重叠转录本[12]在非小细胞肺癌中高表达,能够促进肺癌细胞的侵袭与迁移,可以作为肺癌早期诊断的生物标志分子。越来越多的研究发现lncRNAs作为原癌基因或者抑癌基因参与肿瘤的发生过程以及lncRNAs在肿瘤治疗中存在着重要的作用[13-14]。
本研究拟通过研究lncRNA对DOX诱导的肺癌细胞系A549细胞凋亡的影响,进一步了解其作用机制,寻找预防和治疗肺癌的新靶点,为肺癌治疗提供新的视野与理论依据。
1 材料与方法
1.1 实验材料 人源肺癌细胞系A549细胞(上海中国科学院细胞库);293T细胞(上海中国科学院细胞库);肺癌组织和癌旁组织样本(山东青岛大学附属医院);DMEM培养基和胎牛血清(美国Gibco公司);DOX(上海阿拉丁生化科技股份有限公司);嘌呤霉素(美国Invotrogen公司);TRIzol(美国Thermo Fisher Scientific公司);RNA反转录试剂盒和Mir-X miRNA qRT-PCR SYBR试剂盒以及SYBR Premix EX TaqTMⅡ(日本TaKaRa公司);MitoTracker线粒体染色试剂(美国Molecular Probes公司);细胞凋亡检测试剂盒(碘化丙啶、异硫氰酸荧光素双染法)(上海七海复泰生物科技有限公司)。
1.2 基因芯片 将A549细胞分为2组,一组加2 μmol/L的DOX进行处理,另一组作为对照不做处理,24 h后提取细胞的总RNA,送上海欧易生物医学科技有限公司做lncRNAs基因芯片分析。根据生物公司的芯片分析结果,挑选了差异倍数大且P值小的lncRNAs在细胞水平通过实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术进行复筛,最终筛选出差异显著,表达稳定的lncRNA,lnc-ZMYM6-2-1,我们命名为lncRNA肿瘤抑制因子(tumor inhibitory factor,TIF)。
1.3 qRT-PCR 采用Trizol法提取细胞和组织样本的总RNA,使用NanoDrop 2000检测RNA的纯度与浓度,分别取1 μg RNA作为模板,使用反转录试剂盒将总RNA反转录为cDNA,通过qRT-PCR检测lncRNA TIF的表达。LncRNA TIF上游引物序列为:TAAACATACGTGTGCATGTGTCT,下游引物序列为:TCAGTGTGGCGATTCCTCAG;GAPDH作为内参基因,其上游引物序列为:GTCGGAGTCAACGGATTTG,下游引物序列为:TGGGTGGAATCATATTGGAA。
1.4 载体的构建 通过青岛擎科生物技术有限公司合成lncRNA TIF的shRNA引物,将引物稀释后在PCR仪内进行退火;将pLKO.1-puro载体通过AgeI和EcoRI进行双酶切,酶切后的pLKO.1-puro和退火后的shRNA片段通过T4连接酶进行连接并转化DH5α涂布氨苄抗性平板,挑取阳性克隆进行测序,将测序结果正确的克隆提取质粒备用。
1.5 慢病毒细胞系的构建 将慢病毒表达质粒pLKO.1-TIF-shRNA与空载体pLKO.1-puro分别和慢病毒包装质粒(PMD2.G和PSPAX2)通过磷酸钙方法转染到293T细胞中,12 h后,换成无青、链霉素双抗的培养基继续培养24 h后,收集病毒液,用0.45 μm针头式滤器过滤后感染A549细胞,48 h后添加嘌呤霉素筛选感染成功的细胞。
1.6 MitoTracker 线粒体染色 在24孔板内放置灭菌的0.5×0.5盖玻片,用1%的多聚赖氨酸在37 ℃培养箱中处理1 h,PBS洗涤2遍,接种细胞并进行培养与处理后,用0.02 μmol/L的MitoTracker染色20 min,PBS洗涤2遍,4%多聚甲醛固定10 min,PBS洗涤3遍,将细胞面扣在含有DAPI封片剂的载玻片上,通过双光子激光共聚焦显微镜拍片并计算发生线粒体分裂的细胞所占比值。
1.7 流式细胞仪检测细胞凋亡 将细胞用无EDTA的胰酶消化并制备细胞悬液,在4 ℃离心机内以900 r/min的转速离心10 min,去上清,加入预冷的PBS在4 ℃离心机内以900 r/min的转速离心10 min,去上清,重复洗涤3次。然后按照凋亡试剂盒说明书进行操作,通过流式细胞仪进行检测。
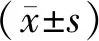
2 结果
2.1 LncRNAs基因芯片结果和目的lncRNA TIF的确定 基因芯片结果显示2 μmol/L DOX处理组与对照组比较,含有差异表达的lncRNAs 3 036个,其中包括1 115个上调的lncRNAs,1 921个下调的lncRNAs。挑选出18个差异倍数大的lncRNAs通过qRT-PCR进行复筛,最终确定了差异显著且稳定表达的目的lncRNA TIF,qRT-PCR结果显示DOX处理后lncRNA TIF的表达明显高于对照组(n=3;t=6.4,P<0.01,图1)。
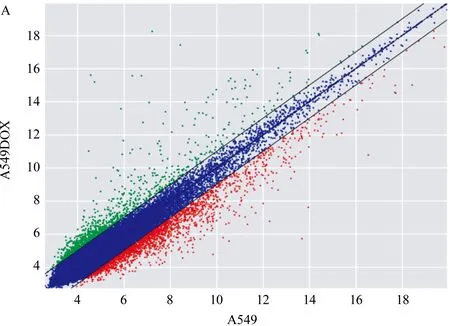
注:与对照组比较,**P<0.01;n=3;t=6.4;A:DOX处理24 h后,基因芯片初步筛选出差异表达的lncRNAs;B: qRT-PCR检测DOX处理24 h后, DOX处理组与对照组中lncRNA TIF的表达情况图1 lncRNAs基因芯片结果和目的lncRNA TIF的确定
2.2 肺癌组织中lncRNA TIF的表达 通过qRT-PCR检测19例肺癌患者临床组织样本肺癌组织和癌旁组织中lncRNA TIF的表达情况,结果显示肺癌组织中lncRNA TIF的表达量低于癌旁组织,差异比较具有统计学意义(n=19;t=18.5,P<0.01,图2)。
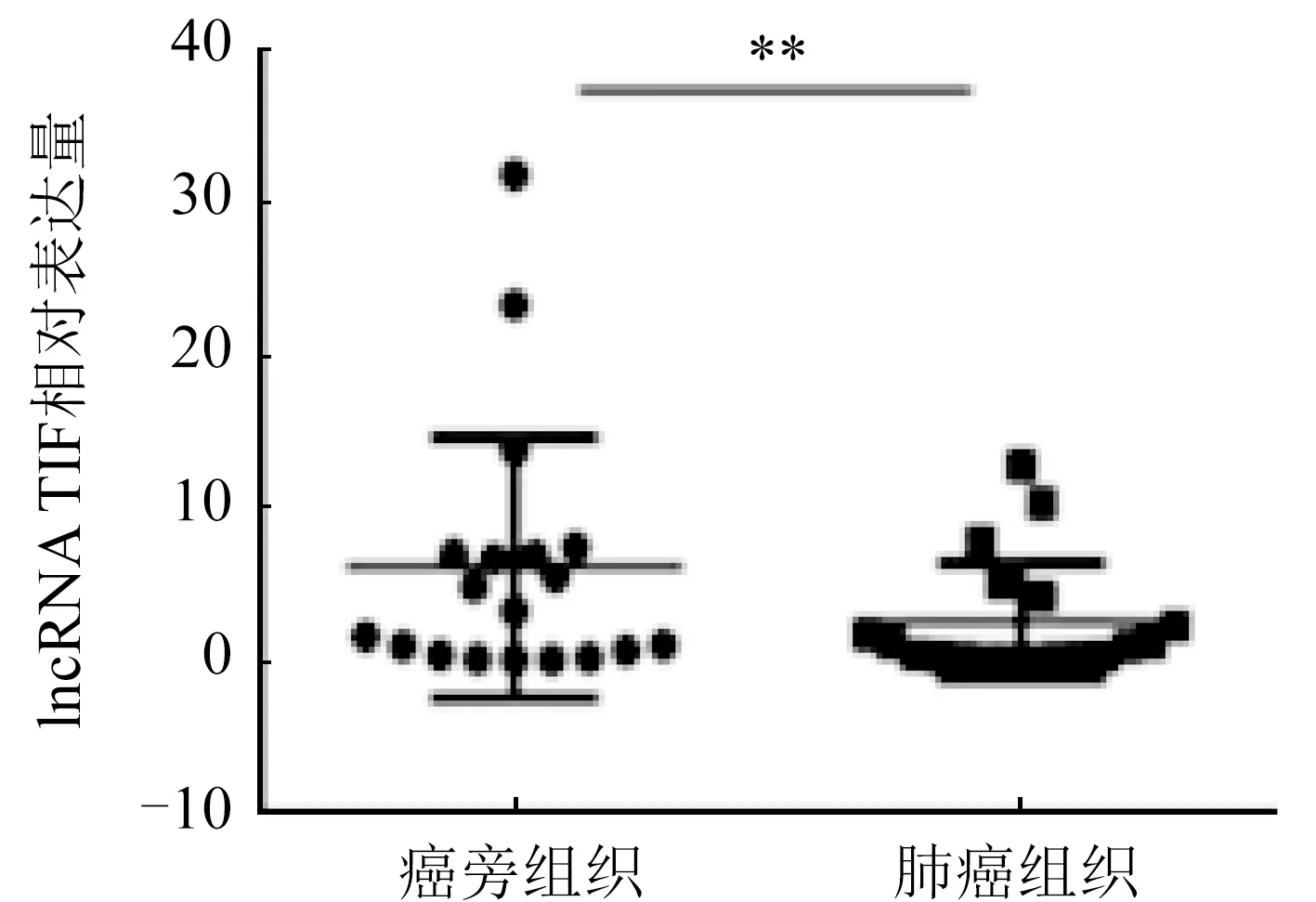
注:与癌旁组织组比较,**P<0.01;n=19;t=18.5图2 肺癌组织与癌旁组织中lncRNA TIF的qRT-PCR检测结果
2.3 LncRNA TIF沉默细胞系的鉴定 通过qRT-PCR检测沉默细胞系(shlncRNA TIF)与沉默对照细胞系(shCtrl)中lncRNA TIF的表达,结果显示shlncRNA TIF沉默细胞系中lncRNA TIF的表达量明显低于沉默对照细胞系,差异比较具有统计学意义(n=3;t=11.18,P<0.001,图3)。
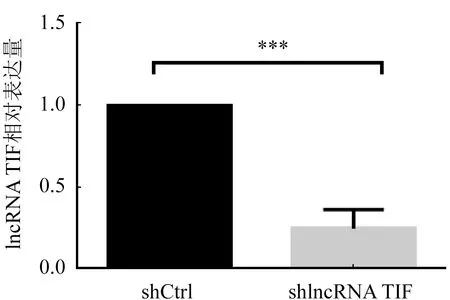
注:与沉默对照组比较,***P<0.001;n=3;t=11.18图3 shlncRNA TIF沉默细胞系与沉默对照细胞系中lncRNA TIF的表达
2.4 沉默lncRNA TIF抑制DOX诱导的线粒体分裂 通过DOX处理24 h后,线粒体断裂呈现点状,当沉默A549细胞中的lncRNA TIF后,线粒体分裂数显著降低,差异比较具有统计学意义(n=3;t=21.69,P<0.01),沉默A549细胞中lncRNA TIF的表达能够抑制DOX诱导的线粒体分裂,在A549细胞中lncRNA TIF具有促进线粒体分裂的功能,图4。
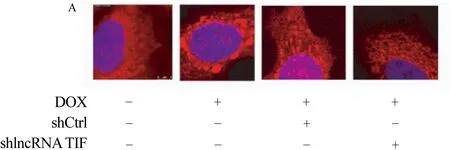

注:与沉默对照组比较,**P<0.01;n=3;t=21.69;A: 线粒体分裂(点状分布)与融合状态(网状分布)的形态。红色:MitoTracker染色的线粒体;蓝色:DAPI染色的细胞核。标尺:10 μm。B: 线粒体分裂情况的量化。图4 各组线粒体分裂情况比较
2.5 沉默lncRNA TIF抑制DOX诱导的细胞凋亡 通过DOX处理24 h后,A549细胞明显发生凋亡,当沉默A549细胞中的lncRNA TIF后,细胞凋亡显著降低,差异比较具有统计学意义(n=3;t=8.75,P<0.05,图5),在A549细胞中lncRNA TIF具有促进细胞凋亡的功能。
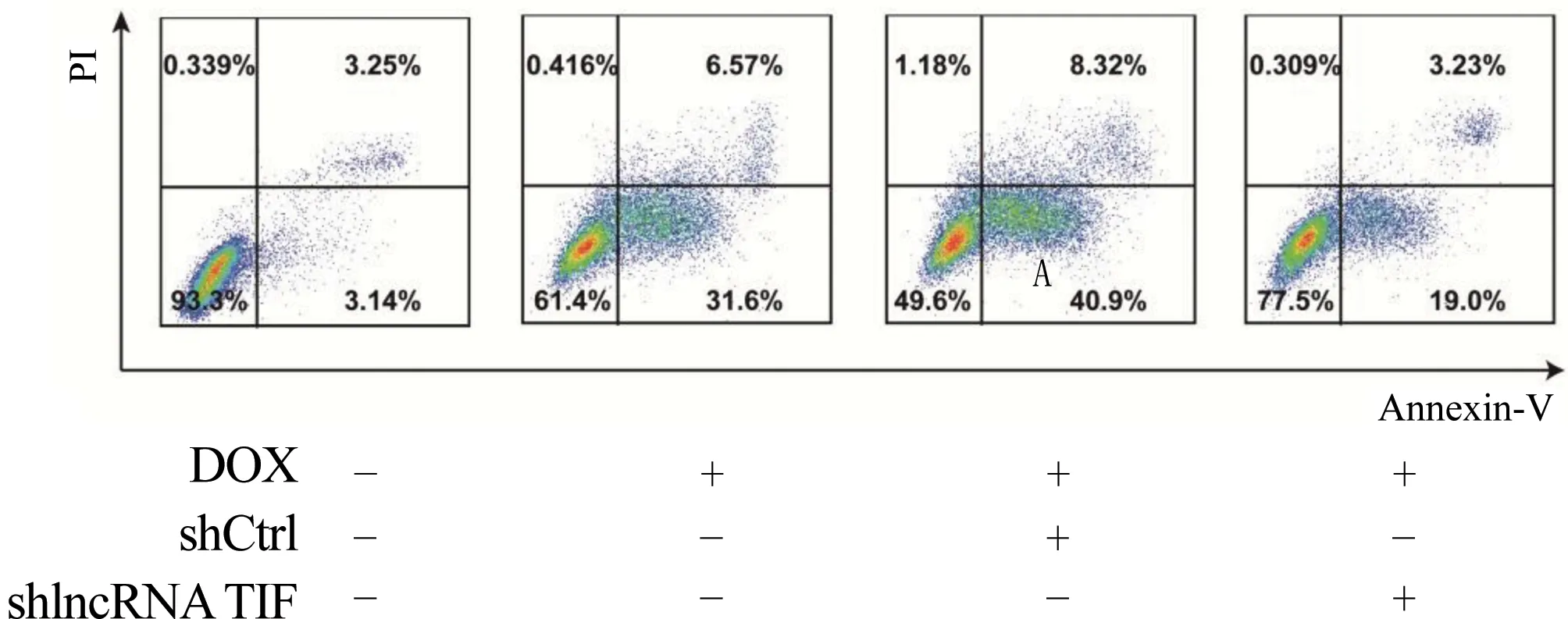
图5 各组细胞凋亡情况比较
3 讨论
肺癌具有高发病率和高死亡率的特点,其中非小细胞肺癌所占比例高达85%[15]。化疗是肺癌治疗的一种策略,DOX在临床上作为广谱的肿瘤化疗药物,通过诱导肿瘤凋亡、自噬、坏死发挥抗肿瘤的作用,但是肿瘤的耐药性在一定程度上限制了DOX的应用[16]。
近年来,对于肺癌的早期诊断以及治疗取得了进展,但是结果还是不容乐观[17],伴随着生物信息学的快速发展,发现lncRNA与肺癌的发生和发展有着密切关系,探究其机制具有重大意义[18]。采用基因芯片技术以及RNA序列分析技术对肺癌组织和癌旁组织进行分析,发现上千个lncRNAs与肺癌的发生相关[19]。研究发现CARLo-5是与肺癌发生相关的lncRNA,在肺癌组织中高表达,通过RNA干扰技术沉默其表达能够抑制肿瘤细胞的增殖、迁移、侵袭[20]。P27是肿瘤抑制因子,LUADT1在表观遗传水平通过抑制其表达促进肺腺癌细胞的增殖[21]。P53作为一个重要的肿瘤抑制因子,H19通过抑制P53的表达发挥致瘤因子的功能,而MEG3能够通过多种机制促进P53的表达发挥抑制肿瘤的功能[22]。LncRNA TP73-AS1作为内源竞争RNA,通过靶向miR-449a的3′非翻译区发挥原癌基因的功能,敲低lncRNA TP73-AS1能抑制肿瘤的发生[23]。
本研究采用基因芯片技术,筛选到DOX处理后差异表达的lncRNAs,通过qRT-PCR复筛得到差异最显著的lncRNA,lncRNA TIF。结果显示DOX处理后能够诱导lncRNA TIF的表达,进一步通过检测临床肺癌组织样本,发现lncRNA TIF在肺癌组织中低表达。因此说明lncRNA TIF可能作为一种抗肿瘤的lncRNA。而lncRNA TIF又是如何发挥抗肿瘤的呢?作者在细胞水平上通过MitoTracker线粒体染色和流式细胞仪检测了lncRNA TIF在DOX诱导的线粒体分裂和细胞凋亡中的作用,发现DOX能够诱导线粒体分裂和细胞凋亡,而敲低lncRNA TIF能够抑制DOX诱导的线粒体分裂和细胞凋亡。
综上所述,化疗药物DOX能够诱导lncRNA TIF的表达进而诱导细胞凋亡,lncRNA TIF可能通过促进线粒体分裂来促进细胞凋亡,线粒体中含有大量的膜蛋白,lncRNA TIF可能通过与线粒体膜蛋白相互作用从而促进细胞凋亡,而这一过程的具体机制还有待于进一步研究。这一发现为肺癌的治疗提供了新的视野,lncRNA TIF有希望成为肺癌治疗的新靶点。

