对比能谱CT与超声监测骨搬移过程的价值
陈雪峰,赵卫东,张永红,石华南,史晓丽
(1.山西医科大学医学影像系,山西 太原 030001;2.山西医科大学第二医院影像科,3.骨科, 山西 太原 030001;4.开封市中心医院骨科,河南 开封 475000)
肢体复杂创伤后遗留的大段骨缺损为目前创伤骨科较常见的疾患,骨搬移术也称骨段滑移术,是常用治疗手段[1]。在骨搬移过程中,新生组织的情况在一定程度上决定着搬移区成骨结果,故在搬移过程中需要一些监测手段评估新生组织形成情况,以指导后续搬移进程。既往主要依靠X线检查评价搬移过程中新生骨痂质量,但X线对早期骨痂显示有限,不能作为早期评价手段。超声可早于X线评估早期骨痂形成,已逐渐用于监测早期骨搬移过程[2-4],但不能全面评估新生组织,且监测过程明显受时间及探头频率的限制[5-7]。单能量成像使能谱CT的密度分辨力明显提高,能谱曲线可用于鉴别物质、分析其同源性,物质分离技术可定量测定物质组成成分的浓度及含量[8],有效原子序数可分析物质成分,已广泛应用于临床。本研究比较能谱CT与超声监测骨搬移过程的价值,探讨采用能谱CT监测骨搬移过程中再生组织形成的可行性。
1 资料与方法
1.1 一般资料 收集2016年11月—2018年10月在我院接受骨搬移术治疗的18例胫骨骨缺损患者,男15例,女3例,年龄20~60岁,平均(45.1±1.0)岁;骨搬移前骨缺损长度4~9 cm,平均(5.21±1.23)cm。纳入标准:①胫骨骨缺损行骨搬移术;②随访依从性好。排除标准:①骨搬移过程中感染复发;②无完全民事行为能力。18例中,11例为交通事故,3例摔伤,4例骨髓炎;骨缺损位于左侧8例,右侧10例;胫骨上段5例,中段9例,下段4例。所有患者均签署知情同意书。
1.2 仪器与方法 于原骨进行低能量截骨,固定12日后,每日搬移1 mm,分别在术后第2、4、6、8周对搬移区进行超声探查和能谱CT扫描。
1.2.1 能谱CT扫描 采用GE Revolution能谱CT机。嘱患者仰卧,双下肢并拢,足尖朝上。扫描范围为髌骨上缘至胫骨下缘,管电压80 kVp/140 kVp瞬时切换,自动毫安秒,40%的自适应迭代重建(adaptive statistical iterative reconstruction, ASIR)扫描,层厚5 mm,层间距5 mm,螺距0.992∶1,重建层厚及层间距1.25 mm,加用Mar后处理技术。
1.2.2 超声检查 采用GE Logiq E9彩色多普勒超声诊断仪,探头频率6~15 MHz,于骨搬移处12点及3点方向做纵横切扫查(图1;6点及9点方向由于穿过组织层过厚,不宜作为探查点),由同1名超声专业医师完成所有操作。
图1 胫骨超声探查点示意图
1.3 图像分析 将能谱CT扫描Mar后处理数据传至AW 4.7工作站,由2名影像学诊断主治医师采用GSI Volume Viewer软件共同观察,并达成共识。首先获取最佳单能量图像,采用伪彩着色,分别在矢状位、冠状位、轴位图像观察外侧骨痂搭建情况、髓腔内骨痂形成情况、机化血肿范围及液性囊泡区性质,并测量骨延长区及机化血肿范围长度。于液性囊泡及同层面血管划定ROI,大小为该层面液性囊泡密度均匀区及血管直径的1/2~2/3,尽量避开边缘[9],根据50、60、70、80、90 keV的CT值获得能谱曲线,并计算液性囊泡和血管ROI斜率。
于超声图纵横切面观察外侧骨痂搭建情况、髓腔内骨痂形成情况、机化血肿范围及液性囊泡区性质,并测量骨延长区长度及机化血肿范围长度。机化血肿范围定义为髓腔内及其周围与肌肉密度或回声相当、但低于骨痂密度或回声的软组织。
表1 2种方法不同时间点测得机化血肿范围长度的比较(mm,±s,n=18)
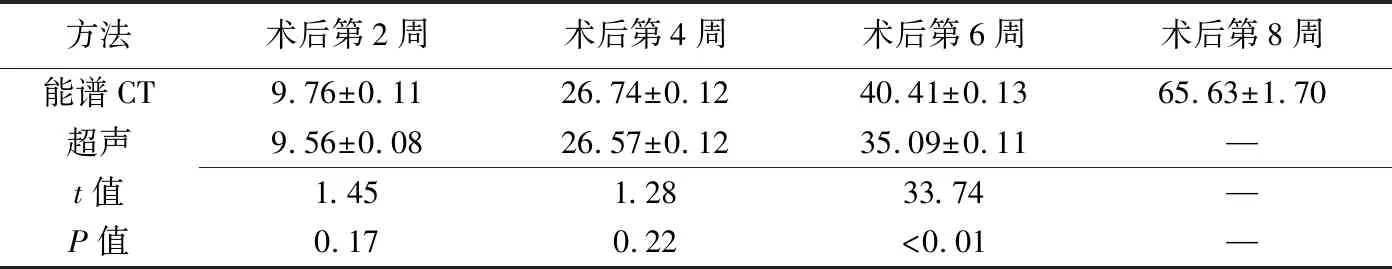
表1 2种方法不同时间点测得机化血肿范围长度的比较(mm,±s,n=18)
方法术后第2周术后第4周术后第6周术后第8周能谱CT9.76±0.1126.74±0.1240.41±0.1365.63±1.70超声9.56±0.0826.57±0.1235.09±0.11—t值1.451.2833.74—P值0.170.22<0.01—
1.4 辐射剂量 记录CT容积剂量指数(CT dose index volume, CTDIvol)、剂量长度乘积(dose-length product, DLP),计算有效剂量(effective dose, ED),ED=K×DLP,K值参照欧盟CT质量标准指南K=0.002 3[9]。
1.5 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,不同时间点2种方法测得的骨延长区及机化血肿范围长度比较采用配对t检验,液性囊泡检出率比较采用配对χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 CT与超声表现 术后第2、4、6周CT和超声均可测得机化血肿范围长度,第8周超声不能明确测量机化血肿范围长度。2种方法不同时间点测得机化血肿范围长度的比较见表1。
外侧骨痂搭建情况(图2~5):术后2~8周,CT和超声均可见截骨间隙近截骨端及沿截骨方向的原始骨痂搭建。随搬移进程,CT显示骨痂边缘逐渐清晰,超声显示新形成骨痂边缘逐渐模糊,第8周时超声已经不能区分新形成骨痂与骨皮质。
机化血肿范围及髓腔内骨痂形成情况(图2~5):术后第2周,CT可见沿骨皮质及截骨间隙的线样机化血肿,近截骨边缘骨痂可见矿化;超声可见沿骨皮质的骨痂,沿截骨间隙机化血肿显示不清,后方髓腔骨痂无法探及。术后第4周,CT和超声均可见机化血肿范围随骨搬移进程延长,CT可见髓腔内及软组织周围机化血肿及其内点线状骨痂形成,超声不能完全探及髓腔内机化血肿,血肿内点状骨痂较CT显示更多。术后第6周,机化血肿情况同术后第4周,CT和超声均可见点线状骨痂连成片。术后第8周,CT和超声显示骨痂形成均较术后第6周增多,骨痂由小片状连成大片状。
液性囊泡:术后第2周,超声和CT未发现液性囊泡;术后第4周,CT均未发现液性囊泡,超声探及3例液性囊泡,2例位于胫骨12点方向骨痂内,1例位于胫骨3点方向、截骨近端2.64 cm骨痂内,分别命名为囊泡a、b、c;术后第6周,超声未发现新液性囊泡,囊泡a、c体积增大,形态更加饱满,囊泡b形态未见变化,将囊泡a、b对应于CT图像相同位置,获得囊泡及相应层面血管的CT值和能谱曲线斜率;距截骨近端2.62 cm胫骨3点方向CT发现液性囊泡,与超声囊泡c位置相同,由于液性囊泡密度不均匀,故在液性囊泡区分别划定3个ROI(c1、c2、c3),并在相应层面血管划定1个ROI,能谱曲线见图6D;50~90 keV单能量各囊泡和血管CT值及能谱曲线斜率见表2;术后第8周,超声仍未发现新液性囊泡,囊泡a、b、c均变小,囊泡a、b内可见点状高回声,囊泡c回声未见增高,CT未发现新液性囊泡,囊泡c减小(图6)。
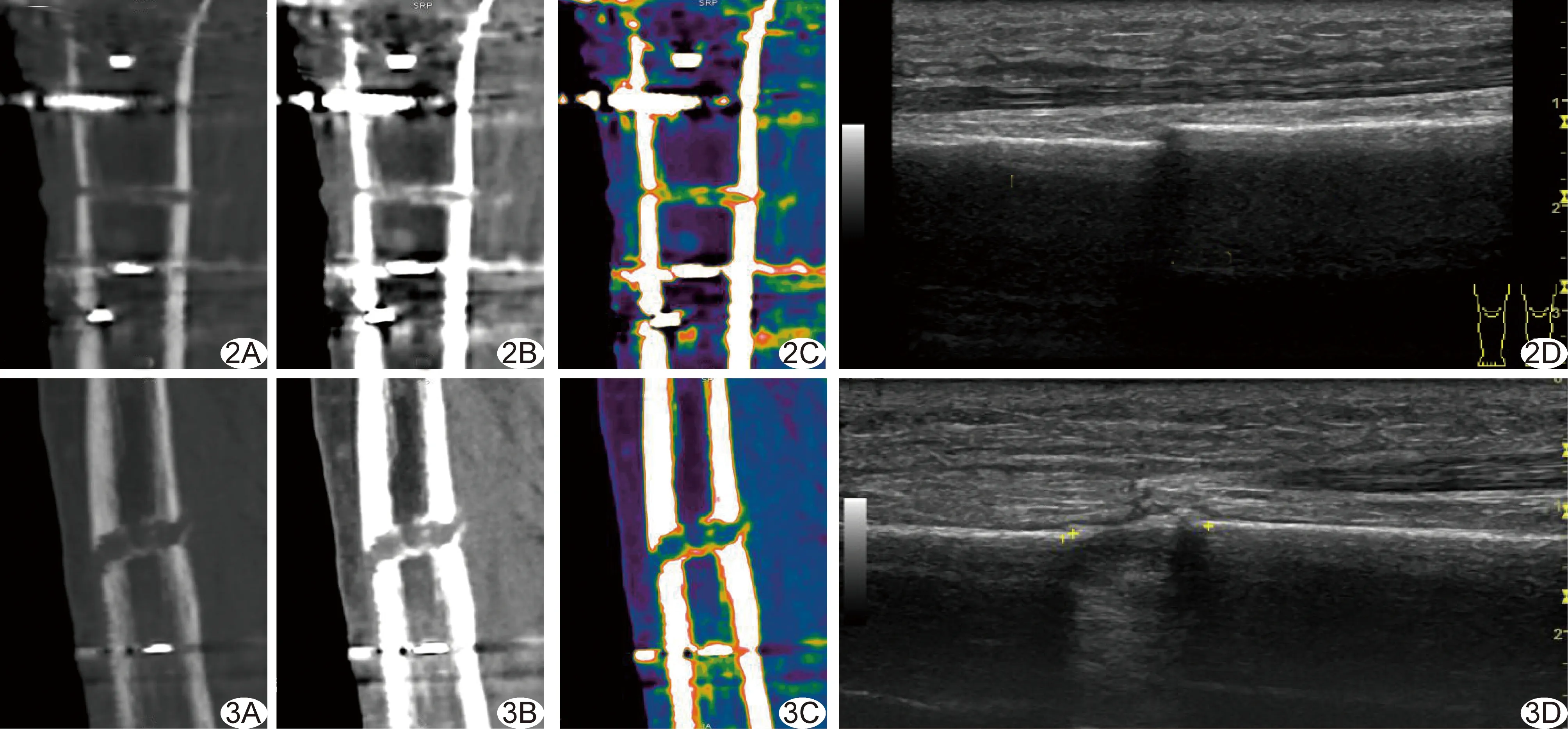
图2 术后第2周,单能量图像和超声表现 A.骨窗; B.软组织窗; C.伪彩图; D.声像图 图3 术后第4周,单能量图像和超声表现 A.骨窗; B.软组织窗; C.伪彩图; D.声像图
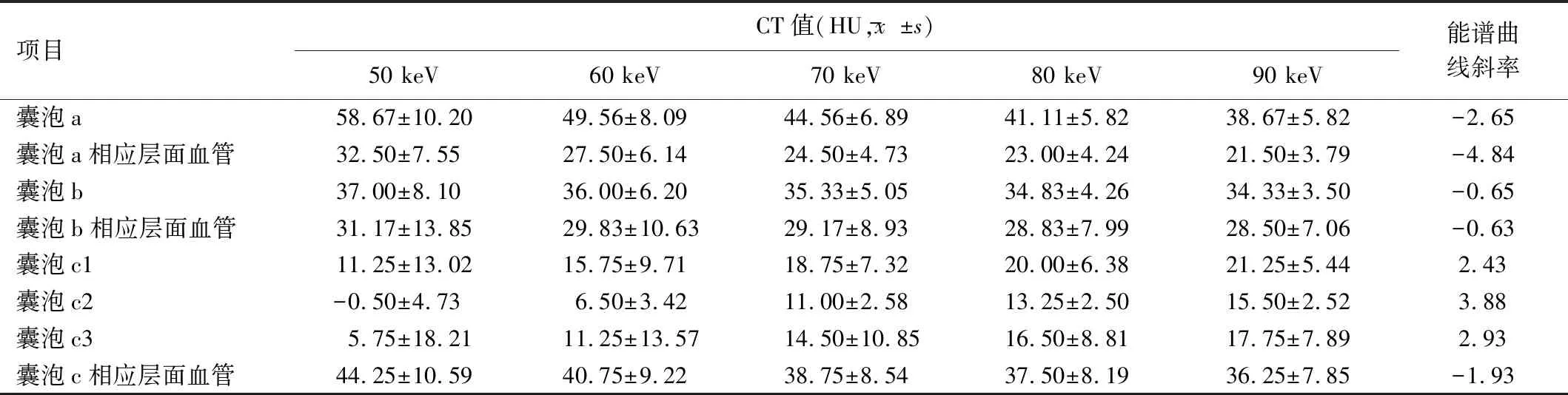
表2 术后第6周各液性囊泡和相应层面血管50~90 keV单能量CT值及能谱曲线斜率
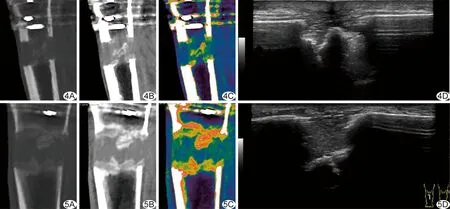
图4 术后第6周,单能量图像和超声表现 A.骨窗; B.软组织窗; C.伪彩图; D.声像图 图5 术后第8周,单能量图像和超声表现 A.骨窗; B.软组织窗; C.伪彩图; D.声像图
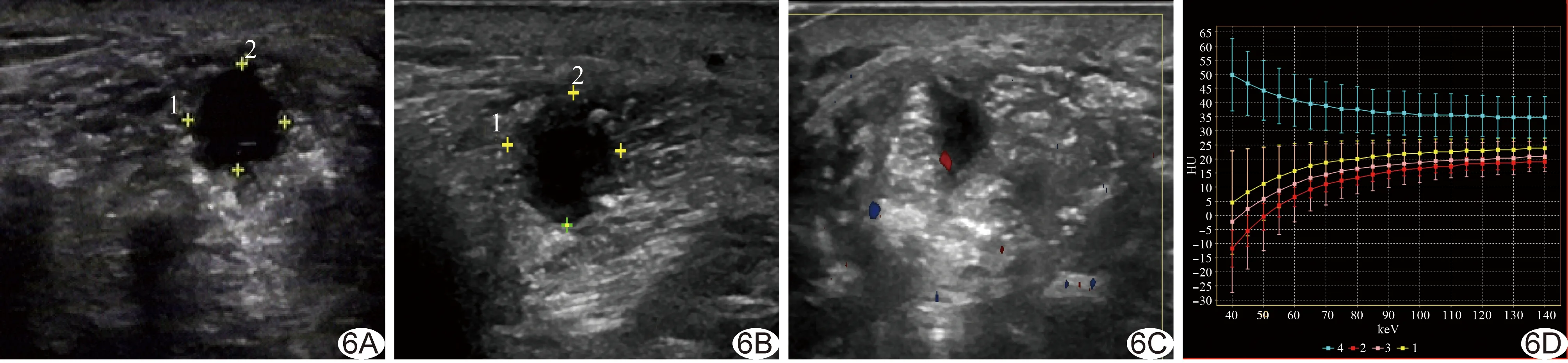
图6 患者男,46岁 A~C.囊泡c在术后第4(A)、6(B)、8(C)周的声像图; D.术后第6周囊泡c的3个ROI(黄色、粉色、红色)及血管(蓝色)的能谱曲线图
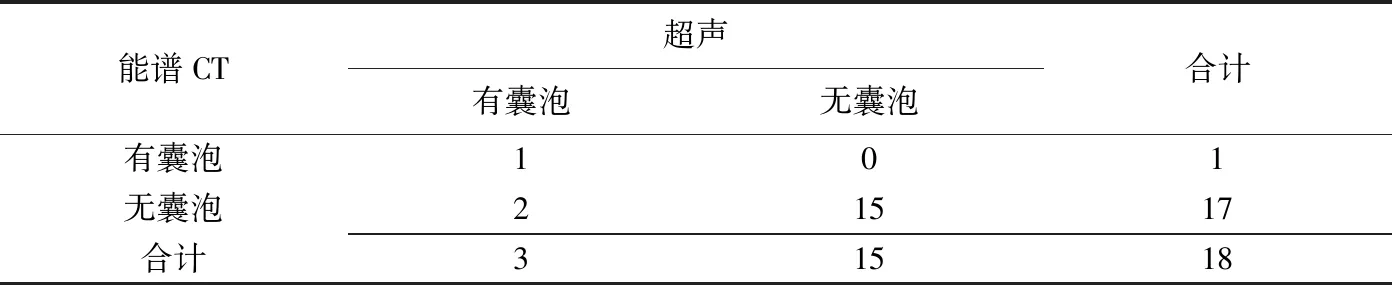
能谱CT超声有囊泡无囊泡合计有囊泡101无囊泡21517合计31518
表4 2种方法不同时间点测得骨延长区长度的比较(mm,±s,n=18)
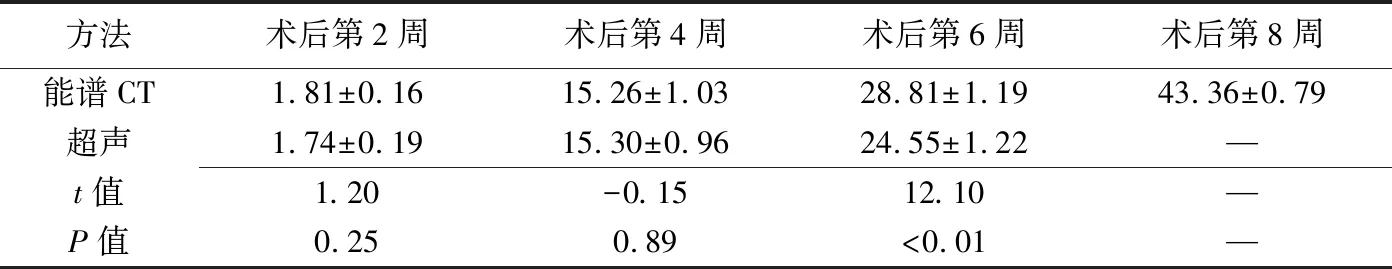
表4 2种方法不同时间点测得骨延长区长度的比较(mm,±s,n=18)
方法术后第2周术后第4周术后第6周术后第8周能谱CT1.81±0.1615.26±1.0328.81±1.1943.36±0.79超声1.74±0.1915.30±0.9624.55±1.22—t值1.20-0.1512.10—P值0.250.89<0.01—
超声与CT对液性囊泡检出率分别为16.67%(3/18)、5.56%(1/18),差异无统计学意义(χ2=0.50,P>0.05),见表3。
骨延长区长度:术后第2、4周,CT和超声测得骨延长区长度差异均无统计学意义(t=1.20、-0.15,P=0.25、0.89);术后第6周,2种方法测得骨延长区长度差异有统计学意义(t=12.10,P<0.01);术后第8周,超声不能明确区分骨痂与骨皮质及测量骨延长区,见表4。
2.2 能谱扫描剂量 CTDIvol为(5.64±0.14)mGy,DLP为(309.29±4.55)mGy·cm,ED为(0.71±0.71)mSv。
3 讨论
Ilizarov技术是目前国际公认的治疗四肢伴有感染及严重骨缺损等复杂骨不连的金标准[10],其核心生物力学理论是“张力-应力法则”,通过给予活体组织持续而稳定的缓慢牵拉,可刺激某些组织细胞再生,骨与软组织也因有效牵拉而再生[11]。在骨搬移过程中,新形成组织在一定程度上决定着搬移成骨的形成结果,故在牵拉过程中应采取监测手段对新生组织形成情况进行评估。
在肢体延长过程中,采用多普勒超声可评估骨痂早期形成及周围血流情况,及时发现相关并发症[2-4]。本研究对比能谱CT与超声在早期骨搬移过程中的监测结果,发现术后第2周能谱CT与超声均能观察到骨痂形成,随时间推移,两者均能监测到外侧骨痂及髓腔内骨痂量的增多及密度增高;术后第6周,超声测得延长区长度及机化血肿范围长度明显小于CT测值,与截骨端边缘变钝模糊有关;术后第8周超声已不能区分骨皮质和新生外侧骨痂及测量延长区长度和机化血肿,而能谱CT测量延长区长度、机化血肿范围长度及观察外侧及髓内骨痂不受时间影响,且超声在监测过程中由于胫骨6点及9点钟方向组织较厚,无法清楚探测胫骨外侧缘及后侧的骨痂形成情况,而能谱CT观察不受影响。本组超声和能谱CT液性囊泡检出率差异无统计学意义,可能与病例数少有关。Young等[12]采用超声发现骨延长过程中延长区液性囊泡会影响骨痂形成和矿化,早期利用超声技术将囊性结构中的液体抽出,可避免囊性结构带来的骨痂生长缓慢及矿化延长。张宇[5]发现囊性样结构并未影响骨痂形成及矿化,且后期延长过程中囊性样结构逐渐减小、消失,推测为血肿。本组囊泡a、b与相应层面血管能谱曲线斜率基本一致,确定囊泡a、b与血液同源,且随时间延长超声可见囊泡内点状骨痂形成,确定囊泡a、b为血肿,与能谱分析结果一致。1例在术后第8周囊泡变小,但其内未见回声增高,能谱曲线走行与血管走行不一致,CT值始终低于血管,提示囊泡性质与血液不同源,推测为囊肿,但此点是否可作为鉴别要点,还需长期大样本观察。
超声和能谱CT均可观察外侧骨痂搭建情况、髓腔内骨痂形成及其数量。超声可通过观察骨痂周围血流情况、预测骨痂形成情况;能谱CT则在测量骨延长区长度、鉴别液性区囊泡区性质及显示机化血肿范围方面具有优势。Eyres等[13]发现骨密度达到正常骨45%时超声波已无法穿透骨皮质,故超声不能监测后期骨痂矿化情况;而能谱CT观察不受骨密度影响,且可在保证图像质量的情况下显著降低辐射剂量[14]。
总之,对于监测早期骨搬移过程,能谱CT可作为一种新的手段,与超声互补,早期指导临床治疗。

