蛛网膜下腔注射阿霉素对家兔运动及感觉功能的影响
袁 杰,王斯玮,余守洋,姚 刚
(1.遵义医科大学附属医院 疼痛科暨麻醉与器官保护基础研究重点实验室,贵州 遵义 563099;2.遵义医科大学附属口腔医院 种植科,贵州 遵义 563099;3.遵义医科大学 麻醉与器官保护基础研究重点实验室,贵州 遵义 563099;4.安顺市人民医院 疼痛科,贵州 安顺 561000)
阿霉素(adriamycin,ADM)是一种临床常用抗肿瘤抗生素,有较强的细胞毒性和神经毒性。阿霉素能损害周围神经系统的神经元,尤其是脊髓背根神经节(Dorsal root ganglion,DRG)和自主神经节神经元[1]。目前临床常用于损毁神经节来治疗三叉神经痛、带状疱疹后遗神经痛等神经病理性疼痛[2]。近几年的研究发现阿霉素可选择性地对神经节细胞产生不可逆变性、坏死作用[3-4]。但蛛网膜下腔注射阿霉素是否会对肢体感觉和运动功能产生影响仍有待进一步研究。据此,本实验的主要目的是观察在蛛网膜下隙注射0.4 mL阿霉素后,观察阿霉素对家兔后肢运动及感觉功能的影响。
1 材料与方法
1.1 主要药品与仪器 阿霉素(分子量543.52,万乐药业,深圳);蒸馏水(Millipore,美国);JL-F光热测痛仪(2411013,明克斯仪器,上海);生物光学显微镜(BX43,Olympus,日本);小动物手术器械包(SP0004-M,瑞沃德,深圳);全自动热痛刺激仪(BME-410C,凯辉盛达科技发展有限公司,北京)、电子测痛仪(Electronic Von Frey,IITC公司,美国)。
1.2 实验动物 健康成年雄性家兔24只,SPF级,体重1.5~2 kg,由第三军医大学动物实验中心提供[许可证号:SCXK(渝)2012-0005]。所有动物均饲养于遵义医科大学“贵州省麻醉与器官保护基础研究重点实验室”SPF级动物房。动物房内室温维持在22~25 ℃,08∶00~20∶00开灯,20∶00~次日08∶00关灯,动物可自由获得标准化饮食和饮水。动物饲养和操作遵循世界动物保护协会和国际疼痛研究学会相关规定,并获得遵义医科大学实验动物伦理委员会批准。
1.3 方法
1.3.1 分组 将家兔随机分为2组,每组6只,NS组:蛛网膜下腔注射生理盐水(0.4 mL); ADM组:蛛网膜下腔注射浓度为1%的阿霉素(0.4 mL)。
1.3.2 后肢运动和感觉功能评价
1.3.2.1 后肢运动功能评价 术前及术后1~8周每周评价后肢运动功能[1]。在宽阔场地观察家兔自发活动。0级:无后肢运动,无负重;1级:幅度微弱的后肢运动,无负重;2级:后肢较强有力,有轻微运动,无负重;3级:后肢可负重,可行走1至2步;4级:轻微跛行;5级:正常行走。
1.3.2.2 后肢感觉功能评价 机械缩足阈值(mechanical withdrawal threshold, MWT):将家兔置于底部均匀分布大小0.5 cm × 0.5 cm孔径的透明玻璃笼中。适应30 min后,利用von Frey测痛仪垂直刺激家兔左后肢足掌部,刺激力度以von Frey丝轻微弯曲为准,持续5 s或直至出现缩足反应。出现缩足反应记为阳性,否则视为阴性。采用up-and-down法[5]计算50%缩足阈值(MWT),缩足阈值=最大值-(最大值-最小值)/[最大值×(最大百分比-50%)]。测定时间为阿霉素注射前1周至注射后8周,每天上午08∶00-10∶00。
热缩足潜伏期(thermal withdrawal latency,TWL):参照之前文献报道的方法[6],家兔适应环境30 min后,使用热痛刺激仪,辐射热对准小鼠左足掌正中照射,自动记录缩足反应的潜伏期作为热痛阈。每只家兔测定3次,取3次平均值作为热痛缩足阈值(TWL)。测定时间为每天下午15∶00~17∶00。所有观察和记录均在双盲条件下进行。
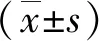
2 结果
2.1 ADM蛛网膜下腔注射对家兔运动功能的影响 与注射前比较,家兔在注射生理盐水1和2周后,分别有25%(3/12)和16.7%(2/12)出现轻微跛行。阿霉素注射1和2周后,分别有33%(4/12)和25%(3/12)出现轻微跛行。1和2周出现跛行的阳性率两组间无统计学差异(P>0.05)。3~8周两组家兔后肢运动功能未见异常(见表1)。
表1家兔后肢出现跛行的阳性率

组别后肢跛行阳性率注射前注射后1周注射后2周 NS03(25%)∗2(16%)∗ADM04(33%)#3(25%)#
*:与NS组注射前比较,P<0.05;#:与ADM注射前比较,P<0.05。
2.2 ADM蛛网膜下腔注射对家兔MWT的影响 2组家兔MWT基础阈值比较无统计学差异(P>0.05)。生理盐水组注射前后,MWT值无统计学差异。与注射前对比,ADM组注射后1、2、3周MWT值明显降低(P<0.05),4~8周MWT值明显增加(P<0.05,见表2)。
2.3 ADM蛛网膜下腔注射对家兔TWL的影响 2组家兔TWL基础阈值无统计学差异(P>0.05)。生理盐水组注射前后,TWL值无统计学差异(P>0.05)。同上,ADM组注射后1、2、3周TWL值明显降低(P<0.05),4~8周TWL值明显增加(P<0.05,见表3)。
表2家兔蛛网膜下腔注射生理盐水或阿霉素前后的MWT变化

组别基础痛阈术后1周术后2周术后3周术后4周NS43.89±3.4241.48±4.7742.79±3.2741.91±3.9439.88±3.39ADM42.73±4.2727.43±3.64∗#29.33±4.39∗#26.96±4.38∗#62.74±3.77∗#续表组别基础痛阈术后5周术后6周术后7周术后8周NS43.89±3.4242.49±3.2141.53±2.9642.58±3.7741.43±4.27ADM42.73±4.2764.33±4.29∗#61.27±3.25∗#59.57±4.29∗#2.44±4.21∗#
*:ADM与注射前比较,P<0.05;#:ADM与NS组比较,P<0.05。
表3家兔蛛网膜下腔注射生理盐水或阿霉素前后的TWL变化

组别基础痛阈术后1周术后2周术后3周术后4周NS18.32±3.8717.43±2.4519.23±3.1117.85±4.4519.51±2.49ADM19.61±2.999.34±4.89∗#8.32±3.74∗#11.47±3.92∗#39.33±3.51∗#续表组别基础痛阈术后5周术后6周术后7周术后8周NS18.32±3.8717.83±2.8718.45±2.9220.27±3.3719.73±3.48ADM19.61±2.9942.69±3.59∗#41.67±3.54∗#39.98±2.98∗#41.62±4.39∗#
*:ADM与注射前比较,P<0.05;#:ADM与NS组比较,P<0.05。
3 讨论
阿霉素可抑制RNA和DNA的合成,具有较强的细胞毒性和神经毒性[7]。是近年来广泛用于治疗三叉神经痛等神经病理性疼痛的一种神经毁损药物。目前的研究认为,阿霉素主要通过两种途径对组织细胞造成损伤:①促进有害羟自由基的产生及膜脂质过氧化;②能嵌入DNA碱基对,通过阻止转录过程,抑制RNA合成,从而阻止DNA的复制[8]。此外,阿霉素可被神经纤维末梢吸收并沿轴浆逆行性运输(lethal retrograde axoplasmic transport)和自杀性运输(suicide transport)[9]。阿霉素还对背根神经节(DRG)有较高的亲和性[10],前期研究发现脊髓前角运动神经元对阿霉素的敏感性和易损性不同于DRG,并且小剂量的阿霉素还对DRG具有选择性破坏作用[11]。
本实验后肢运动功能检测结果显示,家兔蛛网膜下腔注射生理盐水1和2周后,分别有25%(3/12)和16%(2/12)的家兔出现跛行。注射阿霉素后1周和2周后,分别有33.3%(4/12),25%(3/12)的家兔出现跛行。注射生理盐水及阿霉素后跛行阳性率较于注射前出现明显差异(P<0.05),NS组和ADM组比较阳性率未见明显差异(P>0.05)。据此,我们认为注射1~2周后造成的跛行与阿霉素注射没有相关性,可能是蛛网膜下腔注射对局部肌肉组织造成的创伤所导致。
本实验感觉功能实验结果显示,家兔蛛网膜下腔注射生理盐水后,1~8周机械缩足阈值(MWT)未见明显差异(P>0.05);注射阿霉素后,1~3周MWT明显低于注射前,4~8周明显高于注射前。家兔蛛网膜下腔注射生理盐水后,1~8周热缩足潜伏期(TWL)未见明显异常(P>0.05);注射阿霉素后,1~3周TWL明显低于注射前,4~8周明显高于注射前。实验表明,注射阿霉素1~3周,家兔后肢MWT及TWL值均出现明显降低,可能与DRG细胞受损初期出现兴奋性增强及痛觉过敏有关[12]。注射阿霉素后4~8周,MWT及TWL值出现明显增高,表明阿霉素蛛网膜下腔注射可能导致了DRG坏死。家兔在蛛网膜下腔注射阿霉素4周后出现痛阈值升高,可能与DRG细胞坏死需要一定的时间有关。之前的病理实验报道了注射后4周DRG细胞出现明显坏死[13-14],我们的感觉功能检测结果与病理实验相符。这一结果提示蛛网膜下腔注射阿霉素治疗顽固性的神经病理性疼痛时,常需要4周以上的时间才能判断阿霉素注射的镇痛效果,应避免在短时间内重复多次注射。
DRG是躯体和内脏感觉的重要传入通路,在多种神经病理性疼痛的发生和维持过程中扮演关键的角色。我们的研究证实,家兔选择性的损毁相应节段的DRG,后肢痛阈在注射4周后明显增高,而运动功能不受影响。阿霉素蛛网膜下腔注射可达到化学切除DRG的目的,这一方法较于外科手术切除DRG,可减少手术伴随的并发症[15]。这一方法有望对临床治疗顽固性病理性神经病理性疼痛提供一新思路。

