代谢综合征患者罹患结直肠腺瘤的风险及其与中性粒细胞/淋巴细胞比值的关系
陈丹丹, 吴克俭, 周 婷
1.宿迁市第一人民医院消化科,江苏 宿迁 223800; 2.徐州医科大学附属医院消化内科
结直肠癌(colorectal cancer,CRC)是世界上死亡率高居第三位的肿瘤[1],结直肠腺瘤(colorectal adenoma,CRA)被认为是CRC的癌前病变,“腺瘤-癌”是已经被公认的序列[2]。CRA的早期发现、及时诊疗对于预防CRC至关重要,但CRA临床表现不典型,对于该疾病的早期发现仍主要依靠结直肠镜检查,由于结直肠镜检查为一种有创性检查且需要进行充分的肠道准备,并且还会有出血、穿孔等并发症风险,很多人对于该项检查不能接受。因此需要积极寻找CRA发病的危险因素,并加强针对易感人群进行结直肠镜的筛查。近年来一些研究逐渐证明代谢综合征(metabolic syndrome,MetS)会增加CRC的患病率[3-4],本研究旨在探讨MetS患者罹患CRA的风险,及其与中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)的关系。
1 资料与方法
1.1一般资料收集2015年9月至2017年3月徐州医科大学附属医院所有接受肠镜检查的患者(包括住院及体检中心检查人员),排除标准:(1)炎症性肠病(IBD)患者,包括溃疡性结肠炎(UC)、克罗恩病(CD)和IBD分型待定;(2)肠结核、肠寄生虫等感染性疾病;(3)已经确诊的CRC或其他恶性肿瘤患者;(4)应激性因素导致一过性血糖、血脂异常;(5)家族腺瘤性息肉病患者;(6)服用非甾体类、糖皮质激素或免疫抑制剂;(7)医学已经明确会影响血常规结果的疾病;(8)临床资料缺失或描述不明确者。
1.2MetS诊断标准现国际上WHO、中华医学会糖尿病学分会、美国成人胆固醇教育计划成人组、欧洲胰岛素抵抗工作组、国际糖尿病联盟均对MetS进行了不同的诊断标准,各诊断标准侧重点不一样,但总体符合率较高。卢艳慧等[5]通过大宗病例比较,认为中华医学会糖尿病分会的MetS诊断标准更适合中国人。因此本研究选用中华医学会糖尿病分会制定的诊断标准:(1)超重或肥胖:体质量指数(BMI)≥25 kg/m2;(2)高血糖:空腹血糖≥6.2 mmol/L,或已确诊为糖尿病并接受治疗者;(3)高血压:收缩压≥140 mmHg和(或)舒张压≥90 mmHg,或已确诊为高血压并接受降压治疗者;(4)血脂紊乱:空腹甘油三酯≥1.7 mmol/L和(或)空腹高密度脂蛋白(HDL)异常(男性<0.9 mmol/L,女性<1.0 mmol/L);符合四项中的三项即诊断为MetS。
1.3数据搜集回顾性分析患者肠镜检查资料,但因本院部分病区缺失患者身高数据,因此对于该部分患者进行电话随访进一步确认患者的身高,所得患者男性平均身高168.39 cm,女性平均身高156.55 cm,2015年6月30日国务院新闻办发布的《中国居民营养与慢性病状况报告》[6]显示,我国18岁及以上成年男性平均身高167.1 cm,女性155.8 cm,电话随访所得身高的数据与全国人口调查对于身高的总结之间差异无统计学意义(P<0.05),因此考虑该项指标为可以纳入且使用的指标。患者入院次日清晨空腹抽取静脉血进行生化、血常规分析,肠镜检查前1 d晚上开始口服复方聚乙二醇电解质散(恒康正清,江西恒康药业有限公司生产,一次服药2盒)进行常规肠道准备,最后排出大便呈清水或淡黄色,无粪渣,为最佳的肠道清洁效果。次日下午进行肠道检查,均由专业内镜医师操作,组织学病理切片经HE染色后由2名以上病理科医师独立、双盲阅片后进行病理回报。
1.4研究方法根据患者肠镜检查结果分为肠镜检查无异常组(对照组)、CRA组。
根据息肉的病理类型分为CRA组及非腺瘤性息肉(非CRA)组;根据腺瘤病理组织异型的程度,分为轻度异型组和中-重度异型组。
以1.62为临界点,将NLR分为低中性粒细胞/淋巴细胞比值组(low neutrophil-lymphocyte ratio,LNLR)和高中性粒细胞/淋巴细胞比值组(high neutrophil-lymphocyte ratio,HNLR)两组。对照组中无MetS的患者为对照2组;CRA组中未合并MetS的患者为腺瘤2组;非CRA组与对照组中有MetS的患者为MS组;CRA组中合并MetS的患者为MetS+CRA组。
统计各组患者身高、体质量、空腹血糖、甘油三酯、HDL、中性粒细胞计数、淋巴细胞计数及是否有糖尿病、高血压等合并症。

2 结果
2.1CRA组与对照组的比较
2.1.1 CRA组与对照组的比较:CRA组患者BMI、甘油三酯高于对照组,HDL低于对照组,差异均有统计学意义(P<0.05),而两组患者的空腹血糖差异无统计学意义(P>0.05)(见表1)。

表1 MetS相关计量指标的比较Tab 1 Comparison of MetS related parameters in each group
注:与对照组比较,▲P<0.05。
CRA组中超重或肥胖、血脂紊乱、高血糖、MetS及男性的检出率均高于对照组,差异有统计学意义(P<0.05)(见表2),但是无法确定是否为独立危险因素,因此,继续行Logistic回归分析进行探索。
行Logistic回归分析进一步明确CRA的独立危险因素,根据结果可知MetS、高血糖及男性为CRA的独立危险因素(见表3)。
2.1.2 轻度异型组与对照组的比较:轻度异型组与对照组进行对比,轻度异型组中BMI、甘油三酯高于对照组,HDL低于对照组,差异有统计学意义(P<0.05)(见表1)。
轻度异型组中超重或肥胖、高血糖、血脂紊乱、MetS及男性的检出率均高于对照组,差异有统计学意义(P<0.05)(见表2)。
轻度异型组与对照组进行对比,高血糖及男性为轻度异型腺瘤的独立危险因素。轻度异型组MetS的阳性检出率高于对照组,但MetS并非是其独立危险因素(见表4)。

表2 MetS及其相关组分与CRA发生的关系Tab 2 The relationship of MetS, related components with the occurrence of CRA 比例/%
注:与对照组相比,▲P<0.05。
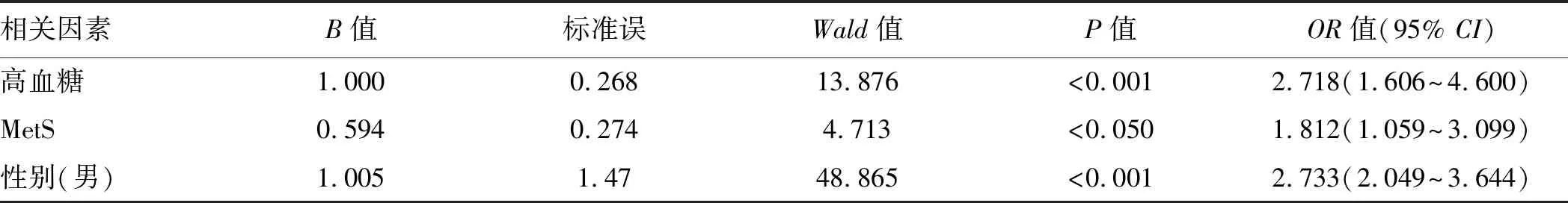
表3 CRA组Logistic回归分析结果Tab 3 Logistic regression analysis of CRA group

表4 轻度异型组Logistic回归分析结果Tab 4 Logistic regression analysis of mild heterotypic group
2.1.3 中-重度异型组与对照组的比较:中-重度异型组BMI、甘油三酯高于对照组(P<0.05),而空腹血糖及HDL两组比较差异无统计学意义(P>0.05)(见表1)。中-重度异型组超重或肥胖、血脂紊乱、高血压、高血糖、MetS及男性的检出率高于对照组,差异有统计学意义(P<0.05)(见表2)。由Logistic回归分析得到,MetS及男性为腺瘤伴中-重度异型的独立危险因素,其中MetS的OR值为4.578(2.611~8.026),提示高度危险因素(见表5)。

表5 中-重度异型组Logistic回归分析结果Tab 5 Logistic regression analysis of moderate-severe variant
2.1.4 CRA组与对照组NLR的比较:腺瘤2组、对照2组、MetS患者的NLR比值进行分析,应用Cox回归分析的最小P值法获得NLR的最佳临界值为1.62。因此选取1.62作为分界点,将NLR>1.62定义为HNLR组,NLR<1.62定为LNLR组。对照2组(n=299)中HNLR(50.85%)与LNLR(49.15%)比较,差异无统计学意义(P>0.05)。腺瘤2组(n=474)与MetS(n=39)组中HNLR所占比例分别为52.11%和51.28%,较各自LNLR组差异无统计学意义(P>0.05)。MetS+CRA组HNLR比例升高到70.83%,与LNLR相比,差异有统计学意义(P<0.05)(见图1)。所有MetS患者在LNLR组中CRA的发病率为59.57%,在HNLR组中CRA的发病率为77.27%,差异有统计学意义(P<0.05),OR值为2.307(1.072~4.967)(见图2)。

注:HNLR与LNLR相比,*P<0.05。图1 NLR在不同分组中的比例Fig 1 The proportion of NLR in different groups
2.2非CRA组与对照组比较非CRA组BMI和HDL与对照组比较,差异有统计学意义(P<0.05)。超重或肥胖、高血压、MetS及男性的检出率高于对照组,差异有统计学意义(P<0.05)。超重或肥胖、男性为非CRA的独立危险因素,而MetS并不是非CRA的独立危险因素(见表1~2、表6)。
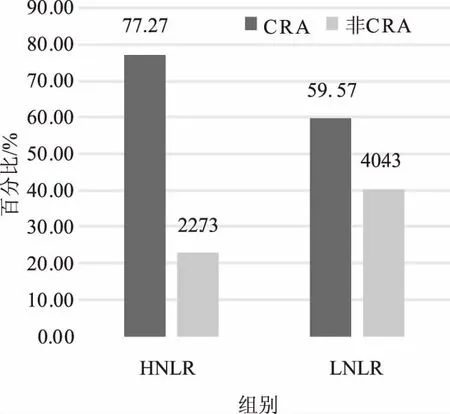
图2 MetS不同NLR组中CRA的比例Fig 2 The proportion of CRA in different NLR groups of MetS

相关因素 B值 标准误 Wald值 P值 OR值(95% CI)性别(男) 0.795 0.156 25.976 <0.001 2.214(1.631~3.006)超重或肥胖 0.323 0.160 4.095 <0.050 1.381(1.010~1.889)
3 讨论
MetS是一组由中心性肥胖、糖耐量受损、高血压与血脂紊乱所组成的复杂代谢性疾病[7]。MetS与CRC的发生呈高风险相关,但MetS与CRA的发病关系研究较少。CRA作为CRC的癌前病变,与MetS的关系也值得研究,进一步明确,有望在早期降低CRC的发病率。MetS的相关因素与CRA之间有相关性,可能与以下机制有关:
肥胖的患者体内脂肪细胞增多,脂肪细胞可以导致体内瘦素增加,可以多种途径调节血管生成,激活核因子κB(NF-κB)通路而产生感应炎性细胞因子如TNF-α、IL-6、CRP等,这些因子均会促进细胞的不正常生长;脂联素是一种可以抑制炎性细胞因子,抑制细胞生长和血管生成,诱导细胞凋亡的因子,而脂肪细胞会导致该因子的减少[8-9]。2型糖尿病与CRA的关系,如今比较认可的理论为“胰岛素样生长因子Ⅰ(IGF Ⅰ)-高胰岛素血症理论”,IGFⅠ具有促进结肠细胞增殖、减少正常凋亡的作用;胰岛素一方面可以进入细胞质膜发挥诱导突变效应,促进Ras原癌基因的激活,另一方面增强血管生成,促进肿瘤细胞的生长与转移;合并糖尿病神经病变患者,肠道动力障碍,肠内容物排空时间延长,使肠上皮细胞与肠道内容物致癌物质接触时间延长[8,10-11]。血脂异常导致机体在氧化应激的情况下激活细胞凋亡信号传导通路,影响结直肠上皮细胞的生长、发育和稳态,持续刺激结直肠上皮细胞增殖;胆固醇的升高有利于早期肿瘤的生长、浸润和转移;内源性游离胆固醇分解为次级胆酸,可通过激活NF-κB、诱导结肠细胞DNA损伤、激活表皮生长因子-MAPK信号传导通路及诱导正常细胞凋亡等机制诱发癌变[12]。高血压与CRA之间的关系考虑“TNF-2A途径”[13],该途径一方面可以促进内皮细胞内皮素的异常表达,使血管壁增厚、外周阻力增加、动脉顺应性减退导致高血压;同时促进c-sis、c-myc、c-fos等原癌基因的表达导致细胞的异型增生。
NLR升高导致结直肠腺瘤的发生风险增加,研究显示体外培养的中性粒细胞不产生TNF-α,并能够抑制其余细胞产生TNF-α,机体内的该项抗炎因子的减少导致细胞的不规律增殖概率增加;并且能够释放多种炎症介质损伤内皮细胞,提高血管通透性,均会损伤正常结直肠上皮细胞[14]。
本研究对患有CRA或(和)MetS的患者进行了NLR的比较,患者单独患有CRA或MetS时HNLR与LNLR差异无统学意义,同时罹患CRA和MetS时HNRL比例升高,MetS伴HNLR时CRA的发病率升高。有研究[15-16]证明,NLR在CRC患者中明显升高,是判断CRC进展及预后的潜在指标。KIM等[17]的研究认为,慢性炎症与结直肠腺瘤的发生有关。《中华医学会糖尿病分会关于代谢综合征的建议》中指出MetS患者机体处于持续低度炎症反应状态[18]。JABLONSKA等[19]研究表明,中性粒细胞不产生TNF-α,并能抑制其余细胞产生TNF-α。TNF-α是一种抗炎因子,机体内该抗炎因子的减少导致细胞异常增生概率的增加。慢性炎症使体内炎症细胞和炎症因子蓄积,多种炎症介质损伤内皮细胞、提高血管通透性均会影响结直肠上皮细胞的正常生长周期。但具体发病机制仍需大量研究进一步明确。
综上所述,MetS会使结直肠息肉患病率升高,且为CRA的独立危险因素,腺瘤合并瘤变时则为高度危险因素。MetS的相关组分,肥胖或超重、高血糖、血脂紊乱也会增加CRA的发生率,其中高血糖为CRA的独立危险因素。但对于高血压与CRA发病的关系,本研究未能得出明确的结论,需要更多研究进一步证实。同时罹患CRA和MetS的患者HNLR增多,考虑与此类患者机体处于持续炎症状态有关,炎症导致CRA的具体机制需要进一步的深入研究。

