血色病心肌病一例
徐亚妹 钱菊英
1 病例资料患者男,37岁。因“胸闷乏力、双下肢浮肿1个月”入院。患者入院前1个月开始出现活动后胸闷、乏力,继而出现双下肢浮肿,症状进行性加重,爬3楼气促明显,夜间尚能平卧。半个月前开始出现腹胀纳差,浮肿加重。当地医院就诊发现轻度肝功能异常,B型利钠肽(BNP)水平升高,心脏扩大伴收缩功能减退。超声提示:肝淤血、少量胸腔积液、腹腔积液。经治疗1周效果不佳,转入复旦大学附属中山医院。患者入院前5年发现糖尿病,外院诊断为1型糖尿病,行胰岛素治疗,血糖控制不佳。否认烟酒嗜好。已婚已育,有1女,父母子女体健,否认家族性疾病史。入院体格检查:体温 36.2℃,脉搏 88 次/min,呼吸 20次/min,血压 107/64 mmHg(1 mmHg=0.133 kPa)。神志清楚,精神佳,营养发育可,自主体位,对答流畅。休息状态无明显气促。面部皮肤粗糙晦暗,四肢暴露部位肤色偏暗,无肝掌、蜘蛛痣。头颅无异常,视力、听力正常。颈软,颈静脉显露。两肺呼吸音清。心前区无隆起,心界临界大小,心率88 次/min,律齐,未闻及明显杂音。腹部平软,肝肋下4指,剑下2指,脾肋下1指,肝区无明显压痛,肠鸣音无亢进,移动性浊音阴性。双下肢水肿至膝下。外周动脉搏动佳。四肢肌力Ⅴ级。神经系统检查未见异常。入院后查血常规:血小板计数72×109/L(下降),白细胞计数2.62×109/L(下降), 中性粒细胞比例 0.397(下降),网织红细胞比例 0.021(上升)。尿、粪常规未见异常。肝肾功能:总胆红素15.5 μmol/L,结合胆红素 8.2 μmol/L,丙氨酸转氨酶(ALT)110 U/L (上升),天冬氨酸转氨酶(AST) 119 U/L(上升), 尿素氮(BUN)67 μmol/L(上升),血肌酐(sCr)453 μmol/L(上升)。血电解质:Na+135 mmol/L,K+4.6 mmol/L,Cl-93 mmol/L,血脂正常范围。糖代谢:空腹血糖 14.3 mmol/L(上升),糖化白蛋白 27.8%(上升),糖化血红蛋白7.5%(上升),酮体阴性。凝血功能:凝血酶原时间 15.4 s(上升),活化部分凝血活酶时间(APTT) 30.4 s,INR 1.42(上升),纤维蛋白原 1.98 g/L(下降),D-二聚体正常范围。心肌损伤标志物:心肌肌钙蛋白T (cTnT) 0.032 μg/L(上升),N末端B型利钠肽前体(NT-proBNP) 2 085 ng/L(上升),肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)正常。血气分析示:pH值为7.39,动脉血氧分压(paO2) 92 mmHg,动脉血二氧化碳分压(paCO2) 42 mmHg,碱剩余(BE) -1.0 mmol/L,动脉血氧饱和度(SaO2)98%。甲状腺激素:游离三碘甲腺原氨酸(FT3) 4.0 pmol/L,游离甲状腺素(FT4) 14.4 pmol/L,超敏促甲状腺激素(s-TSH) 13.89 μIU/mL(上升)。风湿免疫:抗核抗体(ANA)、抗盐水可提取性抗原多肽抗体谱(ENA)、抗双链DNA抗体(dsDNA)、抗中性粒细胞胞质抗体(ANCA)均正常。红细胞沉降率正常范围,超敏CRP(hs-CRP) 6.4 mg/L(上升)。肿瘤标志物: CA12553.25 U/mL(上升),CA19-962.72 U/mL(上升)。免疫固定电泳阴性,免疫球蛋白正常。其他辅助检查:心电图窦性心律,肢体导联电压偏低,V1至V4导联R波递增不良(图1)。
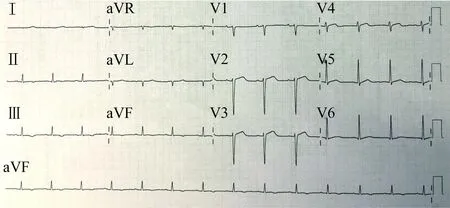
图1 入院心电图
超声心动图示:左心房(LA)内径 43 mm,左心室舒张末期内径(LVEDd) 57 mm,左心室收缩末期内径(LVEDs)42 mm,室间隔(IVS)厚度7 mm,左心室后壁(LVPW)厚度 7 mm,左心室射血分数(LVEF)32%,肺动脉收缩压(PAP)28 mmHg,右心房内径(RA)56 mm,右心室内径(RVEDd)51 mm,三尖瓣环收缩期位移(TAPSE) 10 mm。全心扩大伴左、右心室收缩活动减弱,以右心室为著,重度三尖瓣返流(图2)。胸部X线示两肺渗出,两侧胸腔积液,心影增大(图3)。腹部CT示肝内小钙化灶,肝脾肿大,胰腺较细小,双侧少量胸腔积液。

A 四腔心切面可见左右心房心室扩大,右心房右心室扩大明显 B E/A值下降,提示舒张功能异常 图2 超声心动图
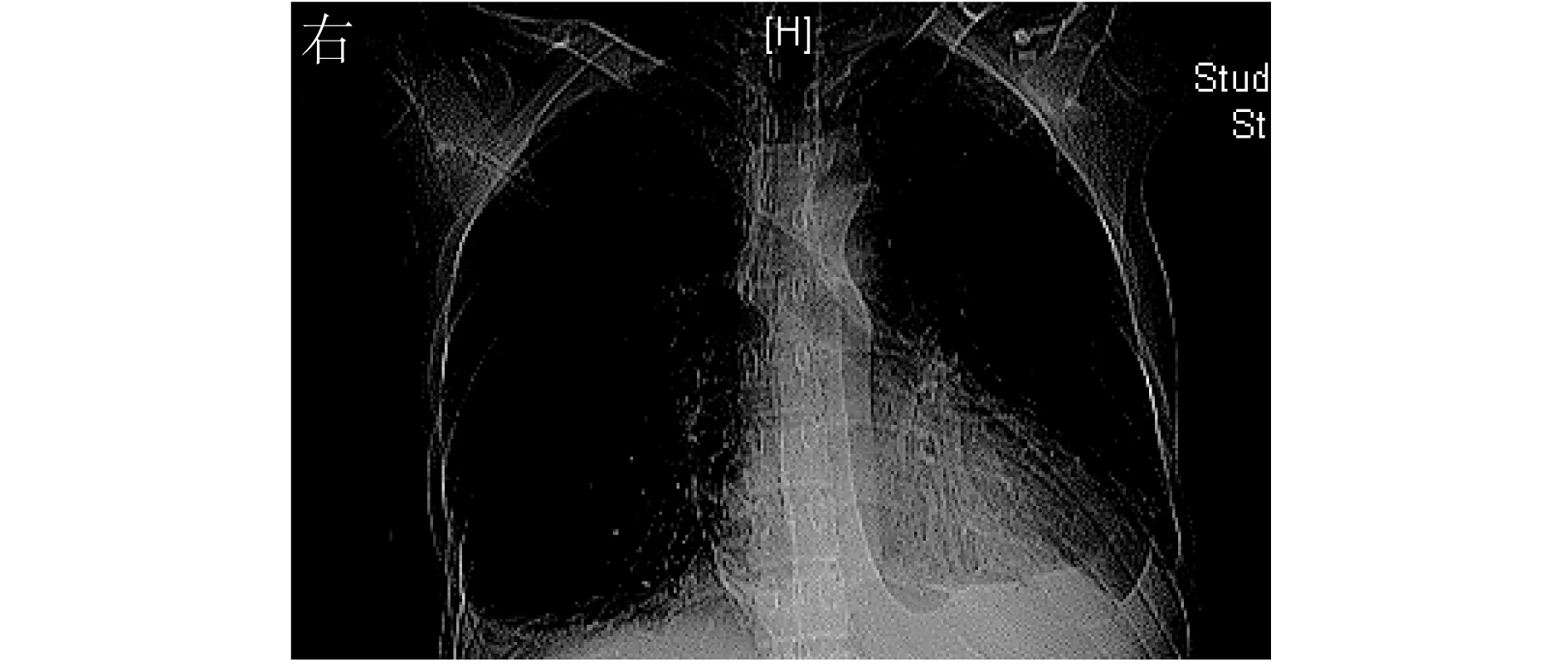
图3 入院胸X线部正位片
入院后心电遥测提示2次发作阵发性心房颤动(简称房颤)(图4),持续0.5~2 h自行转律。住院期间患者因腹胀纳差、进食不佳,自行停用胰岛素治疗。2 d后出现纳差、乏力明显加重,测随机血糖 37.5 mmol/L(上升),血酮体1.96 mmol/L(上升),血乳酸 1.5 mmol/L。在吸氧(3 L/min)条件下行血气分析示pH值为7.28(下降),paO2149 mmHg,paCO246 mmHg,BE-5.1 mmol/L(下降),SaO299%。给予降糖、补液等对症处理后血糖水平下降、酮体转阴性,症状改善。患者入院时肾功能严重异常,但1个月前外院检查肾功能正常,考虑为急性肾功能不全,可能与心力衰竭加重、利尿剂的使用相关,住院期间给予改善灌注、抗氧化等治疗后sCr逐渐下降至正常水平。
2 首次MDT会诊
心内科:年轻男性,起病前无明显诱因,症状表现为心力衰竭,以左心衰竭起病,且LVEF明显降低,很快出现右心衰竭症状,且右心衰竭症状短时间内进行性加重,出现多浆膜腔积液、肝脾肿大。除了原发性的心肌病外,因病情发展较迅速,还需要考虑是否存在急性或继发性病因,如心肌炎、肺栓塞、系统性疾病累及心脏等。从患者病史和体格检查还发现以下问题:①肤色异常;②糖尿病;③合并性功能异常。心力衰竭与糖尿病、肤色改变之间是否存在相互联系尚待明确。进一步完善心脏MRI检查,协助诊断心肌病病因。
心脏超声室:超声心动图提示左、右心室收缩功能均减弱,扩张型心肌病出现右心室扩张多继发于严重左心室功能异常,但此患者相对左心扩张而言右心扩张情况更明显,与临床右心衰竭症状为主相符合,同时超声心动图发现患者舒张功能受限明显,应高度警惕浸润型心肌病可能。
内分泌科:患者既往诊断为1型糖尿病,但是未见自身抗体和胰岛细胞功能评估的结果。同时患者病史补充提示有性功能异常,建议完善性激素水平检测,另外建议进一步查垂体黄体生成激素(LH)、卵泡生成激素(FSH),明确定位诊断。
3 首次MDT后完善各项检查
发现激素水平异常:睾酮 <0.087 nmol/L(下降),硫酸脱氢表雄酮 0.4 μmol/L(下降),生长激素正常范围,甲状旁腺素正常范围,胰岛相关抗体阴性。铁代谢异常:血清铁 26.9 μmol/L,铁蛋白>2 000 μg/L(上升),总铁结合力 30 μmol/L(下降),转铁蛋白饱和度 90%(上升),转铁蛋白 1.22 g/L(下降)。肌电图示:糖尿病周围神经损害改变。心脏MRI示:①左心室稍增大,壁厚度尚可,中部舒张末内径约55 mm,左心室整体收缩舒张活动度减弱。②结构相T2加权像(WI)信号较低。③增强后左心室间壁心肌中层少许延迟强化灶(图5、6)。
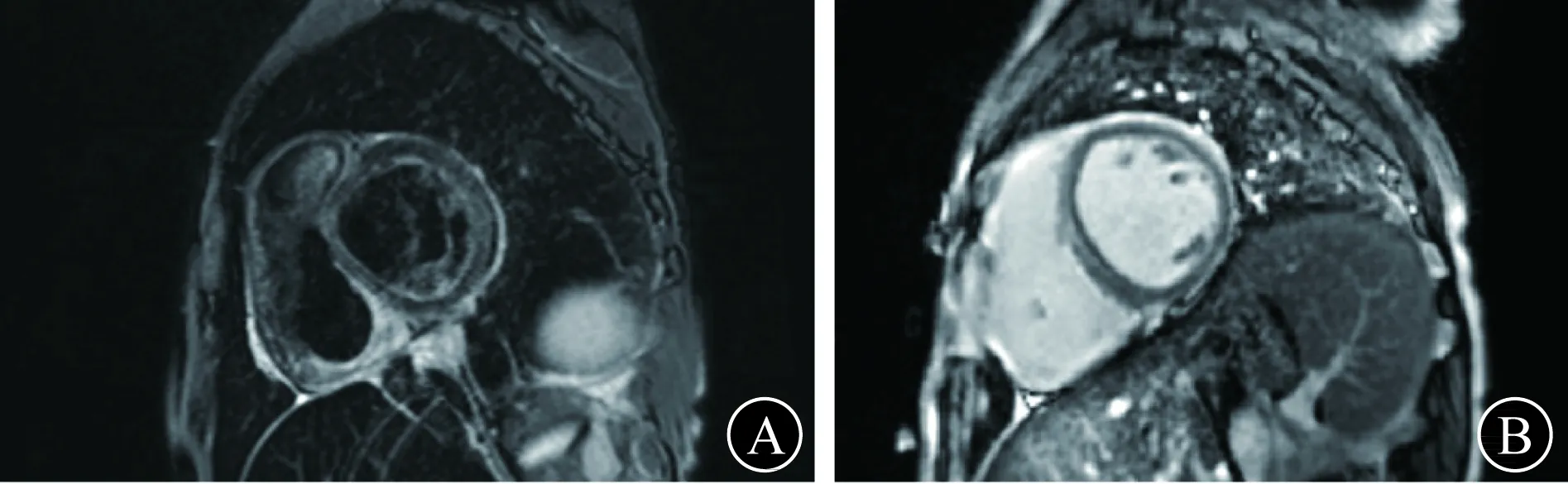
A T2WI可见心脏信号低下 B 延迟强化可见室间隔心肌中层延迟强化图5 心脏MRI
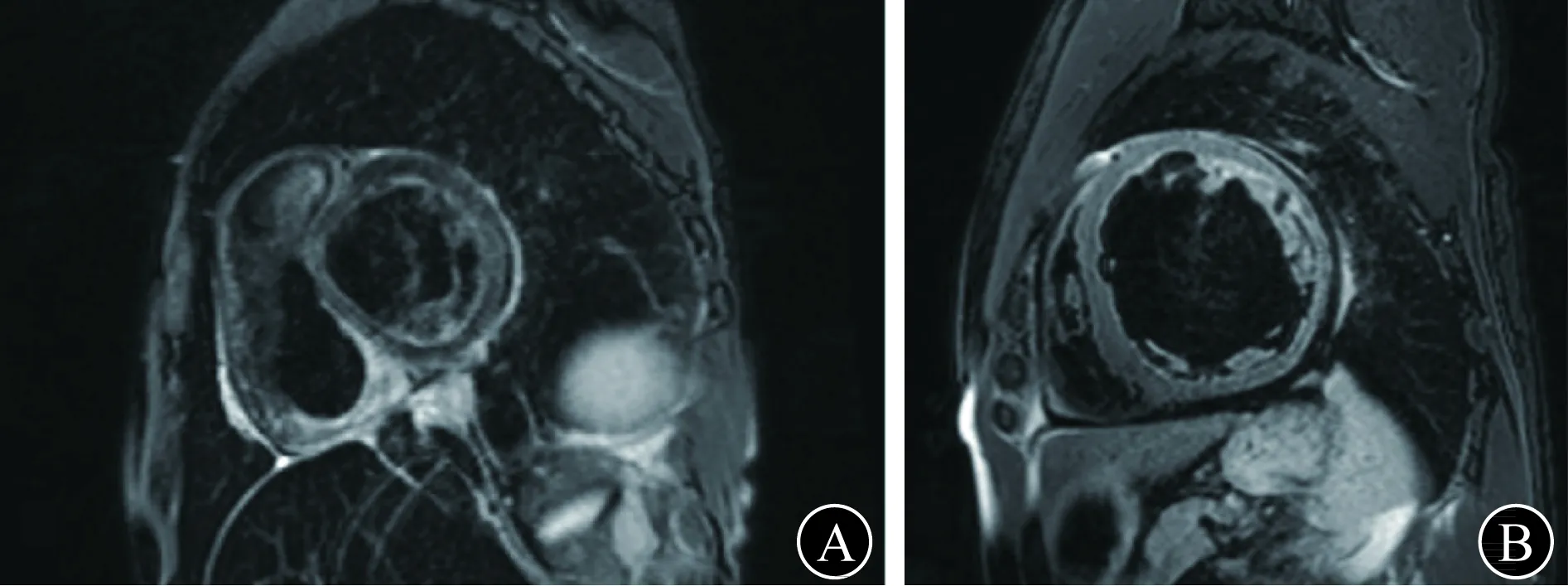
图6 本例患者(A)与扩张型心肌病患者(B)心脏MRI对照
与扩张型心肌病的心脏MRI左心室明显扩大、室壁变薄(图B)相比,本例患者左心室轻度扩大,但右心房、右心室扩张明显,同时左、右心室肌信号明显减低。
腹部MRI示肝脏增大,实质信号不均,T1WI、T2WI信号明显减低,动态增强后未见异常强化灶。脾脏体积增大,信号减低。胰腺和双侧肾脏无殊。后腹膜未见淋巴结(图7)。骨髓穿刺示骨髓增生活跃,髓象中粒系增生活跃伴轻度成熟受限;红系增生活跃且有轻度核小浆少;巨核系增生可。 铁染色:细胞外铁(++),细胞内铁85%(+)。肝脏穿刺活组织病理学检查示肝细胞显著色素沉积,汇管区纤维组织增生,少量炎性细胞浸润。铁染色(+),铜染色(-)(图8)。
追问家族病史,患者父母体健,无肝肾功能异常、 糖尿病、 肤色异常等,未能完善生化等检查。患者女儿无症状,肤色无改变。生化检查:血清铁 30 μmol/L(上升),铁蛋白133.5 μg/L(正常),总铁结合力 63 μmol/L(正常),转铁蛋白饱和度 48%(上升),转铁蛋白 3.07 g/L(正常)。肝肾功能、血糖、性激素水平均正常。腹部MRI肝脾未见明显信号低下。

图7 本例患者(A)与正常人(B)肝脏MRI比较,可见本患者肝脾显著低信号

A H-E染色×200 B 普鲁士蓝染色,颗粒状蓝色即为铁沉积×200图8 肝组织病理学检查
4 再次MDT会诊
心内科:临床表现为心脏扩大、心力衰竭的患者常常被简单诊断为扩张型心肌病,但扩张型心肌病是一个排他性诊断,务必需要排除继发性疾病可能。此患者临床上引起关注的点较多:合并有糖尿病、肤色异常,超声心动图表现为收缩功能异常的同时合并有明显的舒张功能异常,右心衰竭症状明显,故高度警惕系统性疾病累及心脏可能。目前,本院心力衰竭患者常规检测铁代谢指标,此患者铁代谢发现铁蛋白、转铁蛋白饱和度明显升高,结合患者肤色、糖尿病,不难考虑到患者血色病可能,但当时MRI初次结果仅提示心脏扩大、收缩活动减弱、存在延迟强化,并未提示T2WI心肌低信号情况。当重新解读并与磁共振室沟通,确实发现低信号情况,同期扫描到肝脏低信号尤为明显。可见,MRI对于血色病诊断的巨大价值尚依赖于临床医师和技术员的经验水平,临床医师结合病史解读影像资料也是提高临床能力的重要基础。
放射科:该例患者的MRI很有意义。MRI在心脏方面的优越性是可以各个方位成像,疾病结构更清楚,对于病变心肌的检出率比较高,当然对于一些特殊类型的心肌病具有重要的诊断价值,血色病心肌病即其中之一。回看影像资料,该患者心脏的收缩和舒张功能均有降低,LVEF低于正常值,有特征性心肌T2信号明显降低。肝脏的T1和T2信号普遍减低,考虑铁沉积,血色病可能性大。血色病毕竟属于罕见病,没有经验的医师容易漏诊,但是一经过目,终生难忘。也很感谢临床医师提供的临床资料和提醒,临床与辅助科室的沟通对于双方更好地认识疾病具有重要意义。
血液科:铁代谢中,铁蛋白是反映铁储存的可靠指标,在血色病中,铁蛋白水平都会显著升高,然而,铁蛋白本身是个炎性指标,在某些疾病(比如风湿病急性期、嗜血细胞综合征、恶性肿瘤等)中其水平也会显著升高。因此,在铁代谢指标中,转铁蛋白饱和度升高更有意义。骨髓铁染色能更准确地反映患者的铁储存状态,此患者细胞内铁、外铁都显著升高,符合血色病的铁储存升高。铁过度沉积综合征按照病因可分为遗传性血色病(HH,即狭义的血色病,HFE或非HFE基因缺陷)、继发性铁过度沉积(最常见的病因为无效红细胞造血、胃肠外铁超负荷和慢性肝病等),以及混合型。继发性的血色病大多由于输血过多或长期血红蛋白破坏产生,有些患者长期铁摄入过多,也会造成血色病,但此患者目前均无这些继发性因素。遗传性血色病是常染色体隐性遗传性疾病,在该病中HFE基因的突变造成了肠道铁吸收增加,绝大多数HH患者的HFE蛋白有C282Y的纯合子突变。血色病主要采用放血或铁螯合剂治疗,但目前铁螯合剂费用昂贵且相对不易获得,原始的放血疗法也颇具临床治疗价值。
病理科:此例患者病理形态较为典型。肝穿刺组织获得的肝细胞内可以见到明显的色素颗粒沉积,汇管区纤维组织有增生,可以看到少量炎性细胞浸润。看到这种形态,应当考虑到血色病的可能性。此时可以借助特殊染色,通过普鲁士蓝染色证实肝细胞内铁颗粒的存在。该患者肝组织普鲁士蓝染色,可以看到蓝色的铁颗粒的存在。病理学表现符合血色病。血色病可以分为原发性和继发性,病理形态上是有所区别的:原发性通常铁沉积在肝细胞内(正如这个患者),继发性铁通常分布在肝窦组织细胞内,所以病理形态上支持原发性血色病的。
5 诊断与治疗
患者最终诊断为原发性血色病(累及肝脏、心脏、胰腺、性腺、皮肤),阵发性房颤,慢性全心功能不全(NYHA Ⅲ级),糖尿病(继发性),急性肾功能损伤。首先,针对原发病控制饮食中铁摄入量。患者因经济原因无法承担静脉铁螯合剂治疗,遂采用放血疗法,初期每周1~2次,每次放血200~400 mL。病程中出现2次轻度贫血(血红蛋白<100 g/L),暂停放血治疗,恢复后再次启动,逐渐减少放血量至每2~3月放血1次,每次200~400 mL。同时,针对心肌病和阵发性房颤予华法林抗凝治疗,ACEI、β-受体阻滞剂不断优化剂量,最小剂量利尿剂维持干体重,并予胰岛素控制血糖、保肝治疗等。
6 后续随访
出院后2个月复查血红蛋白124 g/L,血清铁22.9 μmol/L,铁蛋白>2 000 μg/L(升高),转铁蛋白饱和度82%(升高)。ALT 48 U/L,AST 35 U/L,sCr 92 μmol/L。出院后6个月查超声心动图提示左、右心房心室内径恢复正常,静息状态收缩功能未见异常,LVEF 57%(图9),与入院时(图2A)比较,各心房、心室明显缩小,尤以右心房、右心室明显,收缩功能改善。出院后1年查血红蛋白134 g/L,血清铁 18.6 μmol/L,铁蛋白1 656 μg/L(上升),转铁蛋白饱和度 75%(上升)。

图9 患者出院6个月随访超声心动图
7 讨 论
铁在生物代谢氧化还原反应中是必不可少的,但当过量时,铁可因其生化特性而损害各种细胞结构,称为血色病。肝脏、皮肤、内分泌系统和心脏是最常累及的器官,临床往往表现为肝损害、肝硬化甚至肝癌,皮肤特征性的金属颜色或石板灰色,糖尿病、性功能障碍,心力衰竭等。对于合并多器官病变的心肌病患者需要高度警惕。临床上对于扩张型心肌病、限制型心肌病,以及怀疑浸润型心肌病患者建议常规行铁代谢检查,转铁蛋白饱和度>45%和血清铁水平升高者需要高度警惕并完善进一步MRI、肝活组织检查,必要时基因检测。
血色病根据病因分为原发性和继发性血色病。原发性血色病是基于遗传相关,由于编码铁调节相关基因突变导致负反馈调节铁吸收的铁调素表达下降而铁吸收过量。原发性血色病具有明显的地域分布差异,在欧洲白人中最常见。继发性血色病主要发生在遗传性贫血患者,包括α-地中海贫血,β-地中海贫血和镰状细胞性贫血等,由于反复输血和在无效红细胞生成的情况下胃肠道铁吸收增加导致过量铁暴露和继发性铁超负荷。
心脏受累是血色病长期预后的主要相关因素[1]。早期主要表现为舒张功能障碍,随着病情进展,射血分数进行性下降最终进展为终末期射血分数降低的心力衰竭(HFrEF),病程中可合并瓣膜功能异常、快速型心律失常或房室传导阻滞等。由于在疾病的早期呈隐匿状态,常被忽略[2]。铁沉积导致的心肌病变往往是可逆的,即使在疾病的发展阶段,故早期发现并治疗是改变患者预后的关键[3]。
铁沉积的部位和严重程度与血中铁含量不呈线性相关,存在明显个体差异,心脏磁共振是铁超载心脏累及早期筛查的主要方法,也是评估铁沉积、纤维化程度和随访治疗效果的优选方法。MRI用于诊断血色病的主要技术为T2和T2 WI技术[4-6],但T2或T2WI不是定量技术,并不反映真实的器官损伤,延迟强化技术能用于评估心肌纤维化等不可逆改变。
血色病累及心肌的管理包括早期发现心肌铁超负荷和去铁治疗,以及指南指导下的心力衰竭的治疗[7]。在可行的情况下,静脉放血疗法仍然是治疗金标准,当合并严重贫血时铁螯合疗法应该优选。
此患者在经过积极放血治疗原发病,联合药物治疗心力衰竭后心脏结构和功能明显改善,考虑心脏受累尚处于早期阶段。急性肝肾功能异常考虑与心力衰竭、药物相关,在改善心功能治疗后也得到稳定,但糖尿病未能恢复,长期依赖胰岛素治疗。目前认为,去铁治疗对于已经发生的显著胰腺功能异常很难逆转,尤其是病程较长者,大部分患者需要长期胰岛素治疗。对于肝脏累及者其预后同样与病程明显相关,一旦出现肝脏严重纤维化甚至癌变,去铁治疗也只能延缓病情。因此,早期诊断和治疗是该病救治的关键[8]。

