oar-miR-133的表达对巴什拜羊骨骼肌细胞增殖和分化的影响
张 伟,王世银 ,邓双义,石国庆
(1. 新疆农业职业技术学院,新疆昌吉 831100;2. 新疆农垦科学院,新疆石河子 832000)
羊肉是人类重要的动物蛋白质来源,提高绵羊产肉量和肉品质始终是绵羊育种的重要方向。绵羊产肉量主要受两个因素的影响,一是骨骼肌中肌纤维的数量;二是骨骼肌纤维的粗细和长度[1]。已有的研究结果表明,动物骨骼肌纤维数量在初生前已经基本确定。在胚胎发育阶段,来源于胚胎中胚层的成肌细胞(myoblast)迁移到躯干和四肢,先进行分裂增殖,达到一定数量后单核的成肌细胞相互融合为多核的肌管(myotube)并最终发育成肌纤维[2],少量成肌细胞转变为骨骼肌卫星细胞(skeletal muscle satellite cell),以静息状态存在于肌纤维肌膜与基底膜之间[3]。动物初生后,肌纤维的数量不再发生变化,肌肉组织的生长、肌肉量的增加,主要靠肌纤维长度的生长以及周径的增加来实现[2]。但是当肌肉组织受到损伤或者外界的刺激,例如人的体育锻炼、赛马的训练以及役用家畜参加高强度的劳动等,肌肉组织需要修复或者再生,以维持组织的完整性或者使肌组织能够适应高强度的工作时,骨骼肌卫星细胞便被激活而完成上述过程[4]。
miRNA(microRNA)是一类小分子非编码RNA,约为22个核苷酸大小,通过与其靶基因mRNA互补结合造成mRNA降解或翻译抑制,从而参与细胞增殖、分化、凋亡、代谢、发育和肿瘤转移等多种生物学过程,超过35%的人类基因受miRNA调控[5],目前miRBase已收录miRNA的已达38 592条(http://www.mirbase.org/,Release 22)。近年来,miRNA对绵羊骨骼肌发育的调控机制已有相关文献报道,其中对Texel羊双肌性状分子机制的阐释最为经典。Texel羊是优良的肉羊品种,具有明显的双肌性状。Clop等[6]的研究结果表明,Texel羊myostatin基因3′-UTR区发生了g+6223G/A突变,恰好成为miR-1和miR-206的靶位点,使该基因的表达受到抑制,其对骨骼肌发育的抑制作用解除,进而引起Texel羊骨骼肌过度发育,表现出双肌性状。
oar-miR-133在小鼠骨骼肌和心肌中高表达,通过促进成肌细胞的增殖而参与小鼠肌肉组织生长发育的调控[7]。绵羊oar-miR-133位于13号染色体上[8],但其在绵羊骨骼肌发育过程中的生物学功能尚未见文献报道。巴什拜羊是新疆优良的羔羊肉型地方绵羊品种,其优良的肉质性状在国内外绵羊品种中并不多见。在自然放牧情况下,4、5月龄羔羊平均日增质量300 g左右,平均体质量可达35 kg,屠宰率高达56%,胴体质量19.66 kg,净肉率45.7%,骨肉比1∶4.1,名列世界前茅,且羊肉品质高,素有“贵族羊”之称[9],但其优良肉质性状的分子调控机制尚未被阐明。鉴于此,本试验对oar-miR-133在巴什拜羊不同组织及不同发育阶段骨骼肌中的表达情况,及其对巴什拜羊骨骼肌卫星细胞增殖和分化的影响进行初步研究,以期为巴什拜羊的持续选育提高提供基础数据。
1 材料与方法
1.1 样品采集
采集巴什拜羊胎儿期40 d、60 d、80 d、100 d和120 d,以及初生当天、6月龄和周岁阶段后肢骨骼肌,同时采集胎儿期第100天时心、肝、脾、肺、肾、胃、肠、心肌和大脑组织。以上组织采集后立即投入液氮速冻,然后置于-80 ℃冰箱保存备用。
1.2 序列获取及引物设计
以β-actin基因的表达作为内参基因,对oar-miR-133的表达量进行定量分析。根据miRBase中收录的绵羊(Ovis aris) oar-miR-133序列(MI0014122)及GenBank中公布的牛(Bostaurus)β-actin序列(NM_173979.3)和MyHC序列(NM_174117.1)序列设计RT-PCR引物。oar-miR-133反转录引物采用特殊的颈环(stem-loop)结构引物[10],β-actin基因RT-PCR引物使用Oligo 6.0软件设计,所有引物均由上海生工生物工程有限公司合成。引物相关信息见表1。
1.3 RNA提取及反转录
按照TRIzol(Invitrogen,美国)说明提取各组织总RNA,使用分光光度计(ND2000,Thermo,美国)结合琼脂糖凝胶电泳检测总RNA质量及浓度。按照M-mLV Reverse Transcriptase 试剂盒(Invitrogen,美国)的操作要求反转录得到oar-miR-133和β-actin的cDNA,其中oar-miR-133的反转录引物见表1,β-actin的反转录引物为试剂盒自带的引物oligo(dT)[12-18]。

表1 oar-miR-133、MyHC和β-actin反转录引物及RT-PCR引物Table 1 RT-PCR and reverse transcription primers of oar-miR-133,MyHC and β-actin
注:引物oar-miR-133RTP带下划线的碱基为与oar-miR-133序列5′端互补的8个碱基,引物oar-miR-133qL带下划线的碱基为oar-miR-133序列3′端的14个碱基。
Note: Bases of primer oar-miR-133 with underlines were complementary with 8 bases of 5′ end sequence of oar-miR-133, and the ones of primer oar-miR-133qL and 5sqL were 14 bases of 3′ end sequence of oar-miR-133.
1.4 RT-PCR扩增及qRT-PCR定量检测
以胎儿期第100天各组织cDNA为模板,对巴什拜羊不同组织中oar-miR-133的表达情况进行半定量分析,扩增反应采用25 μL体系:10×PCR buffer 2.5 μL,上下游引物(10 μmol/L)各0.5 μL,dNTPs(10 mmol/L)2 μL,cDNA模板1 μL,TaqDNA聚合酶(2.5 U/μL)0.5 μL,加ddH2O至25 μL。PCR反应条件:94 ℃预变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环,72 ℃延伸10 min,4 ℃保存。PCR产物用2.5 g/mL的琼脂糖凝胶电泳检测。
不同发育阶段骨骼肌组织和不同发育状态骨骼肌卫星细胞中oar-miR-133表达量的变化采用qRT-PCR进行精确定量分析。反应体系共计20 μL:SYBR Green master mix 2×(Thermo,美国) 10 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA模板1 μL,ddH2O至20 μL。反应条件:激活50 ℃ 2 min,95 ℃ 2 min;循环95 ℃ 30 s,60 ℃ 30 s,共计40个循环。
1.5 巴什拜羊骨骼肌卫星细胞培养及诱导分化
从液氮罐中取出一管冻存的巴什拜羊骨骼肌卫星细胞(本实验室通过原代分离培养获得),迅速置于50 ℃水浴中,待完全融化后取出,吸水纸擦干,φ=75%酒精认真擦拭冻存管外壁进行彻底消毒,然后转入15 mL无菌离心管中,加入10 mL DMEM培养基,离心弃上清后用完全培养基(φ=84%DMEM+φ=15%胎牛血清+φ=1%双抗)重悬细胞,然后转入6 cm培养皿中,加入适量完全培养基,置于37 ℃、φ=5% CO2培养箱中培养,定期换液,待细胞生长至覆盖培养皿底80%,进行传代培养。
巴什拜羊骨骼肌卫星细胞的诱导分化采用低血清培养基完成,使用完全培养基培养细胞,待细胞生长至覆盖培养皿底80%左右时,更换诱导分化培养基(φ=97% DMEM/F-12+φ=2%马血清+φ=1%双抗),同时观察细胞的生长分化状态。
上述处于增殖、分化状态的骨骼肌卫星细胞,培养至第5天时收集细胞,提取总RNA,采用qRT-PCR检测不同状态时oar-miR-133表达量的变化。
1.6 巴什拜羊骨骼肌卫星细胞oar-miR-133表达干扰
巴什拜羊骨骼肌卫星细胞中oar-miR-133的过表达和抑制表达,通过转入外源的oar-miR-133 mimics和inhibitor实现。将骨骼肌卫星细胞接种至6孔板,共接种35孔,每孔约5 000个细胞,加入完全培养基培养至细胞完全贴壁生长。参照Lipofectamine 2000(Invitrogen,美国)操作说明将人工合成的oar-miR-133 mimics和inhibitor及其阴性对照(由吉玛基因合成,序列见表2)转入巴什拜羊骨骼肌卫星细胞,不转染任何试剂作为空白对照组,每个处理转染7孔细胞,共计35孔细胞。每个处理留1孔细胞观察细胞的生长状态,其余6孔每隔24 h消化1孔,计数细胞数量,以评估各处理对细胞增殖的影响。

表2 oar-miR-133 mimics、oar-miR-133 inhibitor及其阴性对照序列Table 2 Sequence of oar-miR-133 mimics, oar-miR-133 inhibitor and their negative controls
1.7 oar-miR-133靶基因预测及分析
采用TargetScan软件预测oar-miR-133靶基因,条件设置为总背景值(total context score)小于-0.5,总Pct值(aggregate Pct)大于0.4,得到的预测结果再与miRanda和Pictar 2个软件独立预测结果进行比较,取至少出现在2个软件预测结果中的靶基因进行分析[11]。使用Blast2GO对预测到的靶基因进行功能注释[12-13],并采用KOBA2.0(KEGG Orthology Based Annotation System)对其参与的KEGG通路进行分析[14-15]。
1.8 数据分析
oar-miR-133的表达量采用2-△△Ct计算,每个试验重复3次,结果用“平均数±标准差”表示,不同发育阶段骨骼肌组织以胎儿期第100 天的表达量作为对照,不同发育状态骨骼肌卫星细胞以诱导分化状态的表达量为对照进行相对定量。对结果采用SPSS 13.0进行单因素方差分析,P<0.05为差异显著。
2 结果与分析
2.1 oar-miR-133在巴什拜羊骨骼肌中的表达情况
从各个组织中提取的总RNA无明显降解(图1-A),OD260/OD280比值在1.8~2.2之间,表明提取的总RNA质量较高,可以用于后续试验。
oar-miR-133在巴什拜羊不同组织中的表达量存在明显的差异,在心肌和骨骼肌中高表达,在肺、肠和胃中表达量较低,未检测到oar-miR-133表达或者表达量极低(图1-B)。
在巴什拜羊骨骼肌不同发育阶段,oar-miR-133的表达量出现了较大的波动(图1-C)。胎儿期第40 天(E40)和第60 天(E60)表达量很低,第80 天(E80)前后表达量迅速上升,至第100天(E100)时达到峰值,其后迅速降低,至第120天(E120)时降至较低表达水平,其后又小幅上升,至初生时达到较高的表达量,后又逐渐下降至较低的表达水平,直至周岁。巴什拜羊不同发育阶段骨骼肌中oar-miR-133表达量的波动与其骨骼肌生长发育调控的关联性,尚需后续试验验证。

A.巴什拜羊部分组织提取总RNA琼脂糖凝胶电泳检测结果,1~4泳道分别为骨骼肌、肠、肾和肝组织 Agarose gel electrophoresis image of total RNA of Bashbay sheep, 1-4 lane is skeletal muscle, intestine, kidney and liver tissue respectively;B.巴什拜羊不同组织中oar-miR-133表达情况,1~10泳道分别是肺、肝、脾、肾、胃、肠、脑、脂肪、心肌和骨骼肌 Expression of oar-miR-133 in different tissues of Bashbay sheep, 1-10 lane is lung, liver, spleen, kidney, stomach, intestine, brain, fat, cardiac muscle and skeletal muscle;C.巴什拜羊骨骼肌不同发育阶段oar-miR-133表达量变化 Expression of oar-miR-133 at different development stages of Bashbay sheep skeletal muscle
图1巴什拜羊不同组织和不同发育阶段骨骼肌中oar-miR-133表达情况
Fig.1Expressionofoar-miR-133indifferenttissuesandatdifferentdevelopmentstagesofskeletalmuscleofBashbaysheep
2.2 巴什拜羊骨骼肌卫星细胞增殖和诱导分化状态下oar-miR-133的表达情况
巴什拜羊骨骼肌卫星细胞处于增殖状态时,细胞中oar-miR-133表达量较低。当采用诱导分化培养基诱导骨骼肌卫星细胞处于分化状态时,细胞内oar-miR-133表达量迅速上升,显著高于增殖状态时的表达量(P<0.05)(图2-A)。说明巴什拜羊骨骼肌卫星细胞增殖状态和分化状态的转换,可能与oar-miR-133表达量的上调存在关联性。
2.3 oar-miR-133过表达和抑制表达对巴什拜羊骨骼肌卫星细胞状态的影响
为了进一步研究oar-miR-133表达量的变化与巴什拜羊骨骼肌卫星细胞增殖分化状态的关联性。通过转染oar-miR-133 mimics和oar-miR-133 inhibitor进入骨骼肌卫星细胞,造成细胞内oar-miR-133的水平上调或下调,发现当细胞内oar-miR-133的水平上调时(转入oar-miR-133 mimics组),骨骼肌卫星细胞的增殖受到抑制(图2-B-e和图2-D),而其余处理组细胞生长状态与空白对照组未见明显差异(图2-B-a, b, c, d和图2-D)。另外,当细胞内oar-miR-133的水平上调时,即使培养基中的血清体积分数保持在15%,骨骼肌卫星细胞仍然停止增殖转入分化状态,细胞有相互融合形成肌管的趋势(图2-B-e和图2-D),同时骨骼肌卫星细胞中标志着细胞分化的MyHC基因高表达,而同期的其他处理组细胞中未检测到该基因的表达(图2-C)。
综合以上数据,可以确定oar-miR-133表达量的上调,与巴什拜羊骨骼肌卫星细胞分化过程的启动密切相关。
2.4 oar-miR-133靶基因预测及分析
使用TargetScan软件预测oar-miR-133靶基因,共得到128个预测的靶基因。经与miRanda和Pictar 2个软件独立预测结果进行比较,选择至少出现在2个软件预测结果中的靶基因,最终得到96个符合条件的预测靶基因。
使用Blast2GO分别对预测的96个靶基因进行功能注释,有74个靶基因得到注释信息,其中分别有23(31%)、18(24%)和33(45%)的候选靶基因分别参与分子功能(molecular function, MF)、细胞成分(cellular component, CC)和生物过程(biological process, BP)(图3)。
为了进一步了解oar-miR-133预测靶基因的功能,采用KOBA2.0(KEGG Orthology Based Annotation System)对其参与的KEGG通路进行分析,共有82个预测靶基因参与35条KEGG通路,例如MAPK信号通路(map04010)、WNT信号通路(map04310)和心肌收缩(map04260)等重要的通路。表3中列出了参与的部分KEGG通路。
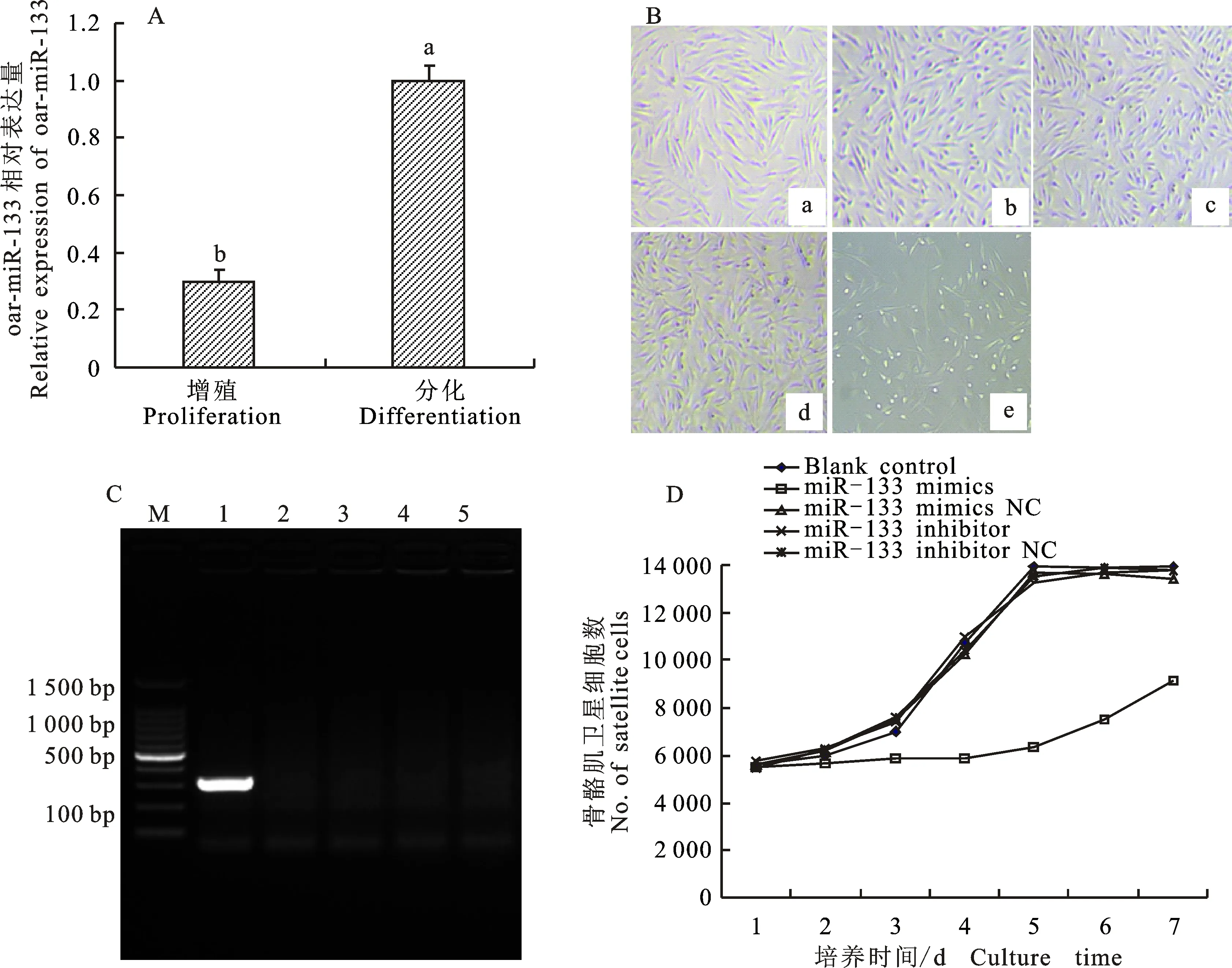
A.骨骼肌卫星细胞增殖和诱导分化状态oar-miR-133表达量变化,不同字母表示差异显著(P<0.05) Expression of oar-miR-133 in proliferative and differentiated skeletal muscle satellite cells, different letters mean significant difference(P<0.05);B.转染空白对照(a)、oar-miR-133 mimics阴性对照(b), oar-miR-133 inhibitor(c),oar-miR-133 inhibitor 阴性对照(d)和oar-miR-133 mimics(e)的骨骼肌卫星细胞生长状态(放大200×) States of skeletal muscle satellite cells transfected blank(a), oar-miR-133 mimics(b), oar-miR-133 inhibitor(c), oar-miR-133 inhibitor(d) and oar-miR-133 mimics(e) respectively;C.不同转染组骨骼肌卫星细胞中MyHC基因表达情况,M为100 bp Marker,1~5泳道分别为转染oar-miR-133 mimics、oar-miR-133 mimics阴性对照、oar-miR-133 inhibitor,oar-miR-133 inhibitor 和空白对照组骨骼肌卫星细胞组 Expression ofMyHCgene in transfected skeletal muscle satellite cells, M lane is 100 bp Marker, 1-5 lane is skeletal muscle satellite cells transfected oar-miR-133 mimics, oar-miR-133 mimics negative control, oar-miR-133 inhibitor , oar-miR-133 inhibitor negative control and blank control respectively;D.oar-miR-133表达量对骨骼肌卫星细胞生长的影响 Effect of oar-miR-133 expression on proliferation of skeletal muscle satellite cells

图2 Oar-miR-133表达量与巴什拜羊骨骼肌卫星细胞发育的关系Fig.2 Relationship between oar-miR-133 expression and development of skeletal muscle satellite cell of Bashbay sheep
3 讨 论
3.1 oar-miR-133的组织表达特征
目前,miRBase V22.0收录的miRNA已达38 589条(http://www.mirbase.org/),其中有一些miRNA的表达具有明显的组织特异性,例如miR-1、miR-133家族、miR-206和miR-208a/b等仅在骨骼肌和心肌中表达[16-18],又被称为肌肉miRNA。本研究采用RT-PCR对巴什拜羊胎儿期第100天时心肌、骨骼肌、肝、脾、肺、肾、胃、肠、脂肪、脑等10个组织中oar-miR-133的表达情况进行半定量检测,结果表明oar-miR-133除了在 巴什拜羊骨骼肌和心肌中高表达,还在胃、肠和肺组织中微量表达(图1-B)。由于胃和肠主要是由平滑肌组织构成,推测oar-miR-133可能也在巴什拜羊平滑肌组织的生长发育过程中发挥作用,相关调控机制未见文献报道,需要后续试验验证。

A.预测靶基因GO功能注释 GO functional annotation of predicted target genes of oar-miR-133;B.预测靶基因参与的细胞组分调控情况 Predicted target genes participating regulation of cellular component;C.预测靶基因参与分子功能调控情况 Predicted target genes participating regulation of molecular function;D.预测靶基因参与生物过程调控情况 Predicted target genes participating regulation of biological process
图3Oar-miR-133预测靶基因功能GO分析
Fig.3GOfunctionanalysisofpredictedtargetgenesofoar-miR-133
miR-133参与骨骼肌发育的调控已有相关文献报道,小鼠miR-133和miR-1成簇排列,位于第2和第18号染色体上,但二者独立完成转录,对小鼠骨骼肌发育的调控作用也存在很大的差异,miR-133可通过抑制肌源性基因的表达而抑制成肌细胞的分化,使其保持增殖状态,而miR-1的表达可诱导成肌细胞进入分化状态,相互融合为肌管[17]。绵羊oar-miR-133位于13号染色体上[8],巴什拜羊骨骼肌发育不同时期oar-miR-133的表达量有较大的波动,尤其是在胎儿期第100天前后oar-miR-133的表达量出现了明显的上调(图1-C)。由于胎儿期是骨骼肌组织发育的关键时期,推测oar-miR-133表达量的变化可能与其成肌细胞的增殖和分化调控有关。
进一步的研究结果表明,当巴什拜羊骨骼肌卫星细胞处于增殖状态时oar-miR-133处于低表达水平,而当骨骼肌卫星细胞处于诱导分化状态时oar-miR-133的表达量迅速上调(图2-A)。另外,当通过转入oar-miR-133 mimics使巴什拜羊骨骼肌卫星细胞中oar-miR-133的水平上升时,巴什拜羊骨骼肌卫星细胞即使处于增殖培养基中,也停止增殖转而进入分化状态(图2-B,2-C,2-D)。由此可以确定,在巴什拜羊生长发育过程中,oar-miR-133通过诱导成肌细胞分化而参与巴什拜羊骨骼肌生长发育的调控,进而影响其产肉性能和肉质。据文献报道,在小鼠骨骼肌中miR-133的上调可抑制成肌细胞分化,使其保持增殖状态[17]。另外,在瘦肉型猪和脂肪型猪品种骨骼肌的发育过程中,miR-133等骨骼肌中特异表达的miRNA的表达模式也存在显著差异[19],而经雌激素处理的虹鳟鱼,骨骼肌中miR-133的表达量显著上调,进而骨骼肌的生长发育受到抑制[20]。由此推断miR-133的表达及其作用可能存在物种甚至品种差异性,具体机制有待后续深入研究。
3.2 oar-miR-133调控的靶基因
miRNA通过调控靶基因而发挥其生物学功能,所以确定miRNA调控的靶基因是进一步研究其生物功能基础。但是,由于miRNA与其靶基因作用的复杂性,以及动物miRNA与其靶基因并非通过完全碱基互补进行结合,所以到目前为止已经实验验证的miR-133靶基因数量还非常有限。巴什拜羊oar-miR-133通过调控哪些靶基因而诱导骨骼肌卫星细胞分化的是一个值得深入研究的问题。已有研究结果表明,miR-133可以通过调控Prdm16基因而影响小鼠骨骼肌卫星细胞分化为肌组织还是褐色脂肪组织[21]。在C2C12细胞中,miR-133通过调控血清应答因子(Serum response factor,SRF)的表达而抑制肌细胞的分化,而miR-133的表达又受长链非编码RNA Malat1的调控[22]。另外,在大鼠心肌中miR-133可以通过抑制Caspase-9的表达而延缓心肌细胞的凋亡[23]。但在巴什拜羊骨骼肌发育过程中oar-miR-133调控的靶基因尚未见文献报道。本研究采用生物信息学分析的方法共预测到oar-miR-133的靶基因96个,GO分析结果表明共有74个预测靶基因分别参与分子功能(molecular function, MF)、细胞成分(cellular component, CC)和生物过程(biological process, BP)等重要的细胞生物学过程(图3)。靶基因参与KEGG信号通路分析结果表明,共有82个预测靶基因参与35条KEGG通路,其中涉及一些诸如肌动蛋白细胞骨架调控(map04810)、MAPK信号通路(map04010)等重要的信号通路。但是由于生物信息学分析结果存在较大比例的假阳性结果,所以后期需要通过实验室验证最终确定oar-miR-133调控的靶基因,以便更为准确地解析其调控巴什拜羊骨骼肌发育的分子机制。
4 结 论
本研究对巴什拜羊不同组织和不同发育阶段骨骼肌中oar-miR-133的表达情况进行研究,初步揭示oar-miR-133的表达与巴什拜羊骨骼肌卫星细胞增殖和分化状态转换的关系,为进一步阐明oar-miR-133对巴什拜羊骨骼肌发育的调控机制奠定了基础,相关研究成果将为巴什拜羊的持续选育提高提供理论依据。

