蜂巢珊瑚共生真菌的分离、鉴定及其抗氧化活性
王兰英,韩丹丹,邓 恒,骆焱平
(海南大学 热带农林学院,海口 570228)
自由基是引起生物细胞衰老的重要因素。过量的自由基可以给生物带来脂质过氧化、膜损伤、酶失活和DNA链的断裂等危害。抗氧化物质可以通过消除自由基使得生物机体免受损伤,因此抗氧化研究是当今生物研究领域的热点[1]。随着海洋微生物活性的不断挖掘,其抗氧化活性研究也逐渐引起科研人员的关注。如Sun等[2]从海洋中分离的丝状真菌Keissleriellasp.YS4108具有明显的清除超氧阴离子和羟基自由基的活性;阎雪芬等[3]采用化学发光法筛选获得7株对活性氧具有抑制作用的深海真菌,其中有3株对羟基自由基和过氧化氢有较好的清除能力;Sun等[4]从一株海洋真菌的发酵液中分离的次生代谢产物显示出良好的体外抗氧化活性,尤其是清除超氧阴离子自由基能力较为突出。可见,从海洋中分离具有抗氧化活性的微生物切实可行。海洋生物的共生微生物与寄主有密切的关系,共生微生物可分泌种类丰富、生物活性多样的次生代谢产物[5],如珊瑚共生的微生物菌株能够产生酚酸类、生物碱、聚酮、黄酮、萜类等化合物,这些化合物在医药领域发挥着重要的作用[6-7]。但是关于珊瑚共生抗氧化研究鲜有报道,因此开展珊瑚共生真菌抗氧化研究具有重要意义。
蜂巢珊瑚是指群体似蜂巢状的块状珊瑚,其个体一般为对角形,个体之间由1~4个相通的壁孔连接,体壁薄,不甚发育[8]。蜂巢珊瑚是中国雷州半岛徐闻西南海岸石珊瑚优势种之一[9]。该类珊瑚因孔率少,致密度高,适合作为人工骨的材料[10]。肖胜蓝等[11]对蜂巢珊瑚附生真菌种类进行调查,但关于该类珊瑚共生微生物抗氧化活性的研究未见报道。本研究从蜂巢珊瑚中分离共生真菌,筛选抗氧化活性较好的菌株,对其进行鉴定,为寻找新型抗氧化类药物的研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 供试珊瑚 蜂巢珊瑚样品采自海南省西沙群岛。
1.1.2 培养基 PDA培养基:去皮马铃薯200 g,葡萄糖20 g,海水1 L,琼脂16 g。海水取自海口市白沙门附近海域。
1.1.3 主要试剂 DPPH(1,1-二苯基-2-三硝基苯肼),ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐],均为分析纯。真菌基因组提取试剂盒购自索莱宝生物公司。引物ITS1和ITS4由上海生工生物工程技术服务有限公司合成。
1.2 样品处理及菌株分离
样品处理:用灭菌海水清洗珊瑚表面3次,称取2 g珊瑚样品置于灭菌研钵内研磨至泥浆状,放入50 mL锥形瓶中,加入20 mL灭菌海水, 120 r/min振荡30 min,静置20 min,取其上清液1 mL加入9 mL灭菌海水依次稀释至10-2、10-3、10-4、10-5g/mL。每个质量浓度梯度样品取100 μL置于PDA培养基中,用灭菌涂布棒涂布均匀,28 ℃恒温培养5~10 d,待菌落长出,挑取菌落边缘获得纯化菌株。纯化菌株接种到试管斜面培养基上,4 ℃保存,待用[12]。
1.3 真菌发酵液的制备
将纯化菌株接种到PDA培养基上,待菌株长到培养皿面积的2/3时,平板中加入3 mL灭菌海水,用灭菌涂布棒刮取真菌孢子,收集孢子悬浮液用无菌纱布过滤除去菌丝,在显微镜下利用血球计数板计数,然后用灭菌海水稀释孢子悬浮液至107CFU/mL。配制马铃薯葡萄糖培养液(PDB)分装于250 mL三角瓶中,每瓶装样量为100 mL,120 ℃灭菌20 min,待培养液冷却后接入上述孢子悬浮液1 mL,28 ℃、180 r/min恒温振荡培养5 d,获得菌株发酵液。将发酵液室温下5 000 r/min离心15 min,取上清液作为待测液,备用。
1.4 抗氧化活性测定
1.4.1 高价铁离子还原作用 将硫酸亚铁FeSO4配制成不同浓度梯度的溶液,以亚铁离子浓度(mol/L)为横坐标(x),以波长593 nm的吸光度作为纵坐标(y),绘制硫酸亚铁标准曲线。参考Du等[13]的方法配制Ferric reducing ability of plasma(FRAP)溶液,取0.1 mL待测液与3.0 mL FRAP溶液混合,37 ℃恒温水浴5 min,取出后迅速混匀,测量混合液在波长593 nm的吸光度,通过硫酸亚铁标准曲线计算出混合液中硫酸亚铁浓度,评价供试菌株对高价铁离子还原能力。
1.4.2 DPPH自由基清除作用 参考Bouaziz 等[14]的方法并且稍作修改:用φ=95%乙醇配制2×104mol/L DPPH溶液,在离心管中加入0.5 mL提取液及3.5 mL DPPH溶液,常温下孵育30 min,混匀后在波长517 nm测量吸光度,记为As;用φ=95%乙醇代替样品测定吸光度,记为Ab。DPPH清除率计算公式如下:
DPPH清除率=(Ab-As)/Ab×100%
1.4.3 ABTS自由基清除作用 参考Thoo等[15]方法测定ABTS自由基清除率: 配制ABTS自由基溶液(取10 mL 7 mmoL/L ABTS溶液,加入10 mL 2.45 mmol/L过硫酸钾溶液,混合后黑暗静置16 h,用φ=95%乙醇将其稀释至波长734 nm吸光度为0.7±0.02,黑暗密封,备用),取0.1 mL待测提取液加入3.9 mL ABTS自由基溶液,反应6 min混合均匀后在波长734 nm测量吸光度,记为As;用0.1 mLφ=95%乙醇代替样品测吸光度,记为Ab。ABTS自由基清除率计算公式如下:
ABTS清除率=(Ab-As)/Ab×100%
1.5 S-1-5菌株的鉴定
1.5.1 菌株的形态学观察 将供试菌株接种于PDA,28 ℃恒温培养5 d后观察菌落特征;采用插片法观察菌丝及孢子形态[16]。
1.5.2 菌株生长速率测定 将供试菌株接种至PDA培养基中央,28 ℃恒温培养,每24 h采用十字交叉法测量菌落直径,连续测量5 d,计算菌落平均生长速率。
1.5.3 真菌的分子生物学鉴定 将菌株S-1-5接种至PDA培养基上,28 ℃恒温培养5 d,无菌条件下刮取菌丝置于灭菌研钵,加液氮研磨至粉末状。按照真菌基因组DNA提取试剂盒(D2300,索莱宝科技有限公司,中国)中说明书进行菌丝基因组提取,以提取的基因组 DNA 为模板,采用真菌 ITS rDNA 基因通用引物 ITS1/ITS4 扩增,引物序列为:ITS1,5′-TCCGTAGGTGAACCTGCGG-3′;ITS4,5′-TCCTCCGCTTATTGATATGC-3′[17]。对核糖体转录间隔区 ITS 进行 PCR 扩增;PCR 反应体系为50 μL:双蒸水33 μL,PCR Buffer ( 含 Mg2+) 5 μL,dNTPs (2.5 mmol/L) 4 μL,10 μmol/L的引物 ITS1 与 ITS4 各 1 μL,DNA 模板 5 μL,DNATaqpolymerase (10 U) 1 μL。PCR 反应程序:94 ℃,3 min;进入循环: 94 ℃,45 s; 57 ℃,45 s; 72 ℃,75 s,35个循环;72 ℃,10 min。取 5 μL PCR 产物,用10 g/L琼脂糖凝胶电泳,利用goldview(10 000×,索莱宝科技有限公司,中国)染色,凝胶成像仪(GelDocXR,BIO-RAD,美国)检测。PCR 产物的序列测定由上海生工有限公司完成。
对菌株S-1-5的 ITS rDNA 基因序列,利用NCBI中BLAST进行同源性比对,选出与该序列相似性较高的核酸序列。使用Mega(ver.6.0)软件,采用邻接法(Neighbor joining method)构建系统发育树,并通过自举分析(Bootstrap) 进行置信度检测,自举数据集为1 000次[18]。
1.6 数据分析
采用统计软件 SPSS (ver.22.0)统计分析数据。
2 结果与分析
2.1 抗氧化活性测定
2.1.1 高价铁离子还原能力 测得FeSO4标准曲线为y=0.063x+0.020 3,R2为0.998 4,方程相关性好,可信度高。测定各菌株发酵液对高价铁还原能力,结果发现,所测试的9株真菌的总体高价铁还原能力较强(图1),经菌株发酵液处理后,混合液中Fe2+浓度均在70 mol/L以上,尤其菌株S-1-5对高价铁离子还原能力最强,经其发酵液处理后混合液中Fe2+浓度可达132.016 mol/L。
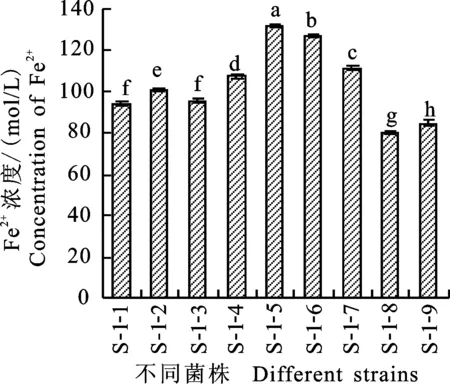
不同小写字母表示差异显著(P<0. 05),下同 Different lowercase lettters mean significant difference(P<0.05),the same below
图1菌株的高价铁离子还原作用
Fig.1Ferric-reducingantioxidantpowerofisolates
2.1.2 DPPH清除率测定 二苯基苦味肼基自由基DPPH是一种稳定的以氮为中心的自由基,在波长517 nm有最大吸收。不同菌株发酵液对DPPH清除能力的测定结果发现,供试菌株发酵液,均有一定的抗氧化作用(图 2),其中菌株S-1-5对DPPH的清除能力最强,清除率为70.60%,与其他菌株相比显著差异;其次菌株S-1-2 对DPPH也有较好的清除能力,清除率为52.32%,其余真菌发酵液对DPPH清除率均低于30%。
2.1.3 ABTS清除率 ABTS自由基清除率广泛应用于体外抗氧化活性测定,在反应体系中,ABTS经过氧化后可以生成相对稳定的蓝绿色的ABTS自由基,溶液发生褪色、特征吸光值降低。不同菌株发酵液对ABTS自由基清除能力的测定结果发现,供试菌株对ABTS自由基均有一定的清除能力(图3),其中菌株S-1-5对ABTS的清除能力最强,清除率为67.18%,与其他菌株相比显著差异;其次菌株S-1-6、S-1-8和S-1-3对ABTS也有较好的清除能力,清除率>50%;相比较之下菌株S-1-1、S-1-2、S-1-4、S-1-7和S-1-9清除能力稍差,清除率<50%。
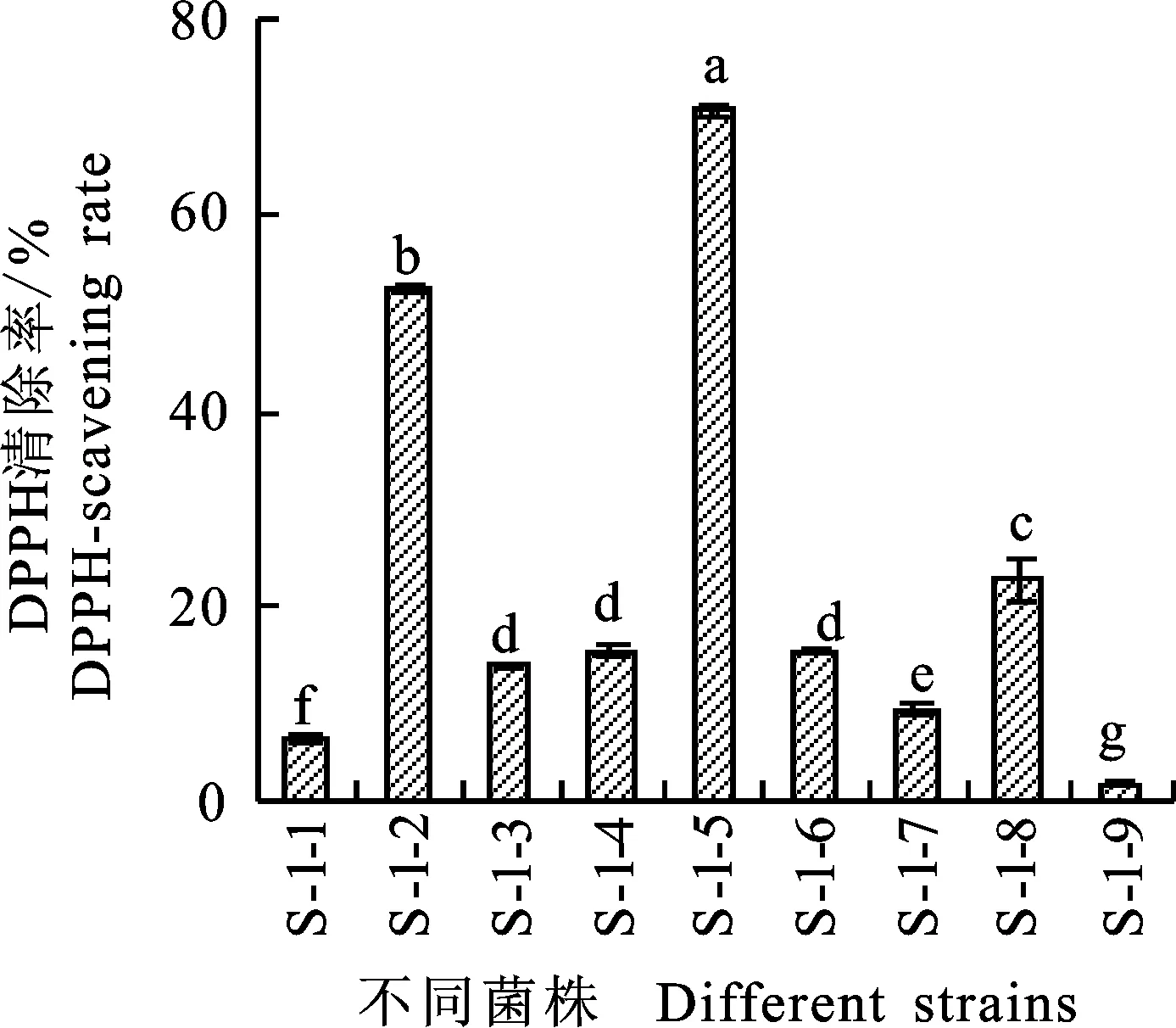
图2 菌株的DPPH自由基清除能力Fig.2 DPPH radical scavenging capacity of isolates
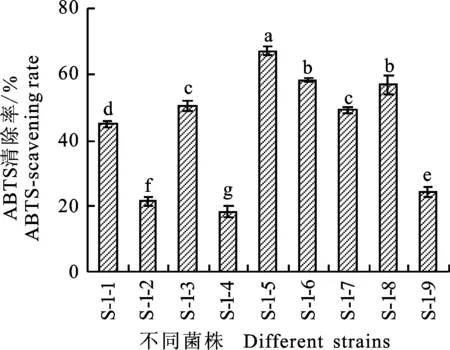
图3 菌株的ABTS自由基清除能力Fig.3 ABTS radical scavenging capacity of isolates
2.2 菌株形态学观察结果
对菌株S-1-5培养发现,该菌株菌落形态不规则;菌丝短小而致密,初期菌落黄绿色,菌落边缘淡黄色,后期菌落颜色加深为土黄色,菌落边缘墨绿色(图4-A),菌落背后有黑色皱褶(图4-B)。该菌株分生孢子呈椭圆形(图4-C),分生孢子梗具多隔膜,呈竹节状(图4-D),菌丝分支少(图4-F,4-G)。菌株S-1-5平均生长速率为0.56 cm/d。该菌落特征与分生孢子形态与Zalar等[19]报道的枝孢属球孢枝孢Cladosporiumsphaerospermum基本一致。
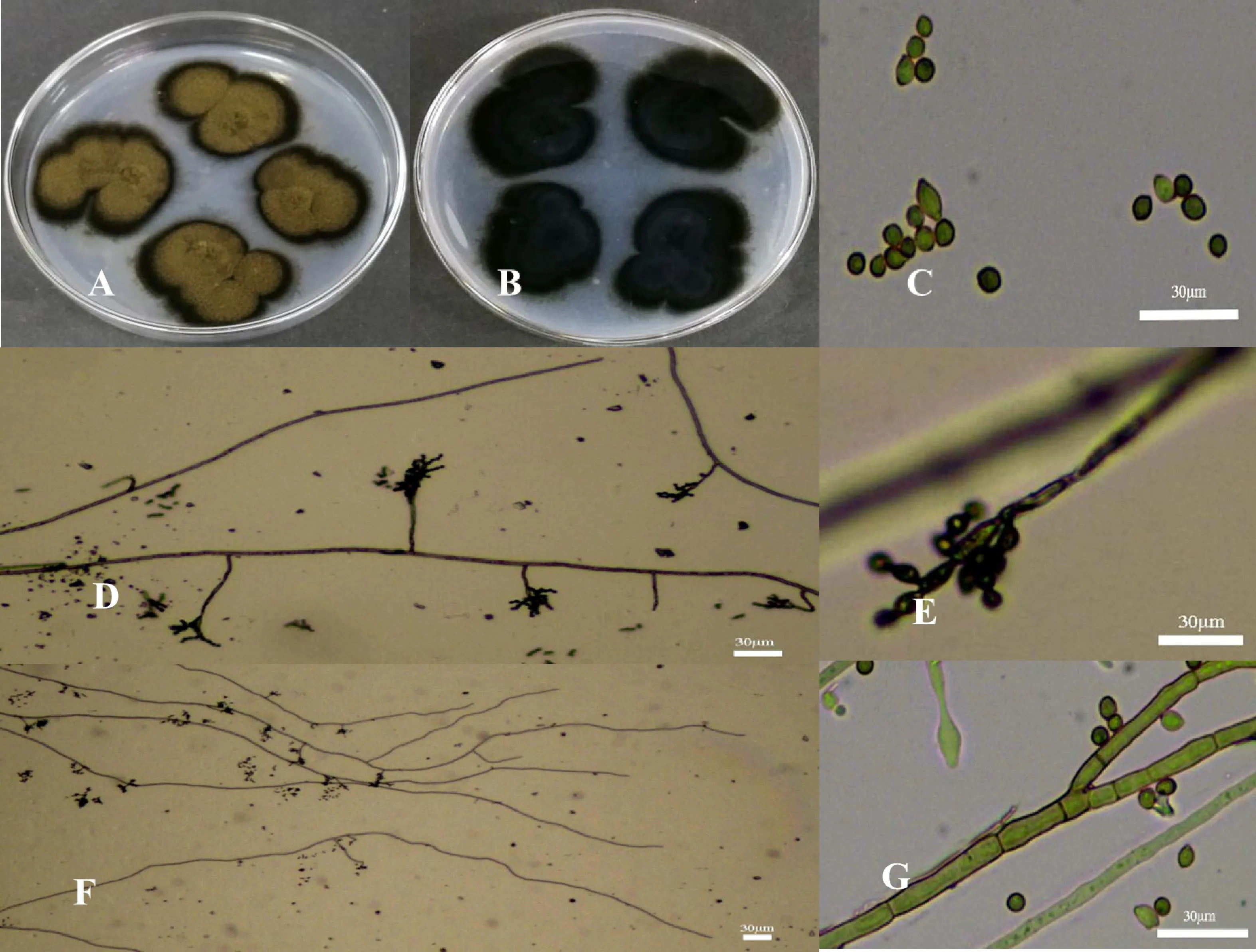
A.菌株S-1-5培养菌落正面 The surface of colonies of isolate S-1-5 on PDA medium;B.菌株S-1-5培养菌落背面 The backside of colonies of isolate S-1-5 on PDA medium;C.分生孢子 Conidia;D.分生孢子梗放大 Enlargement of conidiophores;E.菌丝及分生孢子梗 Mycelia and conidiophores;F.菌丝放大 Mycelial morphology;G.菌丝形态 Enlargement。标尺为30 μm Bar=30 μm
图4菌株S-1-5的菌落形态和分生孢子形态学观察
Fig.4MorphologicalobservationsofcoloniesandconidiaofisolateS-1-5
2.3 系统发育树
菌株S-1-5的ITS r DNA序列长度为525 bp,将此序列提交GenBank注册,获得登录号为MG787259。运用NCBI database中在线Blast比对发现,菌株S-1-5与枝孢属(Cladosporium)种类的序列同源性较高。利用 MEGA(Ver.6.05)软件构建基于rDNA-ITS 序列的系统发育树(图5),菌株S-1-5与球孢枝孢(C.sphaerospermum,GenBank accession No:MF061765)的进化距离最近。结合该菌株菌落特征及分生孢子形态特征,将菌株S-1-5 鉴定为枝孢属球孢枝孢(C.sphaerospermum)。
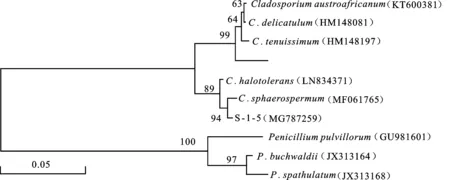
图5 基于ITS rDNA序列同源性构建的菌株S-1-5 18S rDNA序列系统发育树Fig.5 Phylogenetic tree of isolate S-1-5 based on 18S rDNA sequence homology
3 讨 论
共生微生物是指微生物附着在其他生物上,与被附生生物协同生存的一类微生物。许多研究指出,这类微生物对于被附生生物的生存起着极为重要的作用,如海绵共生微生物可为海绵形成一种化学防御屏障抵御有害附着物、病原微生物危害[20];珊瑚共生微生物可参与珊瑚生物合成,防御外来生物的入侵以及增强珊瑚的抗逆性[21-22]。本研究从蜂巢珊瑚中分离获得的一株共生真菌S-1-5具有较强地消除自由基的能力。过量的自由基可以给生物带来脂质过氧化、膜损伤、酶失活和DNA链的断裂等危害。因此,通过清除自由基以保护被附生生物机体免受损伤可能是附生微生物防御外来生物入侵的重要机制之一。肖胜蓝等[11]对徐闻珊瑚保护区的8种珊瑚进行共生真菌的调查指出,蜂巢珊瑚附生真菌的优势属为枝孢属。本研究对分离于蜂巢珊瑚的菌株S-1-5鉴定为枝孢霉属球孢枝孢。可见,菌株S-1-5可能是蜂巢珊瑚生存过程中重要的枝孢属种类。
海洋共生真菌的活性次生代谢产物的研究已有报道。人们普遍认为,海洋共生真菌产生的次生代谢产物具有种类丰富、结构新颖、活性高等特点[23-26]。因此,对海洋共生微生物的深入研究可为解决海洋产物含量低及药源不足等问题带来希望,是开发海洋新型药物和寻找海洋动植物替代资源的重要途径[27]。陈艳丽[28]从直针尖柳珊瑚共生真菌(Penicilliumcommune)发酵液中获得一种具有抗氧化活性的物质,经鉴定该物质为胞外多糖类,该结构的多糖首次从珊瑚中获得,具有开发为海洋糖类药物的潜在价值。本研究发现分离自蜂巢珊瑚的菌株S-1-5发酵液具有很强的抗氧化活性,但未对其活性物质进一步分离。鉴于珊瑚共生真菌潜在的生防价值,在后续研究中有必要对菌株S-1-5活性成分进行分离、鉴定,为开发海洋微生物活性物质奠定基础。

