阿奇霉素对阿霉素与白蛋白致小鼠肾损害的保护作用*
唐逸豪,殷成哲,李 凯,李伟鑫,范春芳△
(1. 中国人民武警特色医学中心药剂科, 天津 300162; 2. 武警天津市总队执勤第一支队勤务保障大队卫生队药师, 天津 300202;3. 江苏总队镇江支队勤务保障大队卫生队军医,镇江 212000;4. 武警后勤学院,天津 300300)
肾病综合征(nephrotic syndrome,NS)是一种常见的肾脏疾病,其特征是肾小球滤过器渗漏,导致白蛋白丢失,形成蛋白尿[1]。蛋白尿作为NS的病理特点,不仅是一种肾损伤的进展和预后的标志,同样也是一个重要的致病因素。患者持续的蛋白尿可导致随后的氧化应激、炎症,最终导致肾脏纤维化,使患者丧失肾功能。有文献报道[2]细胞因子IL-2、IL-6、IL-12等在病情发展过程中发挥了重要的作用。阿奇霉素(azithromycin,Azm )是一种口服大环内酯类耐酸抗菌药物,有研究[3, 4]表明其具有抗炎和免疫调节功能,尤其是对细胞因子IL-2、IL-6、IL-12等具有调控作用。近期有文献报道[5-8],阿霉素 (adriamycin, ADR)可通过氧自由基、炎症因子及膜脂过氧化等机制,诱导小鼠肾脏肾小球毛细血管通透性增加和肾小管萎缩,从而导致蛋白尿和高脂血症[9]。这种阿霉素诱导的肾病模型在组织学和临床上类似于人类肾病综合征,可用于肾脏药理学与病理学研究。因此,本实验采用阿霉素与白蛋白诱导的小鼠肾病模型,观察阿奇霉素对肾病小鼠的治疗效果,并对其可能的保护机制进行初步探究。
1 材料与方法
1.1 动物与试剂
SPF级雄性BALB/c小鼠40只,8~10周龄,体重(20±2)g,由山东鲁抗药品公司提供,许可证号为SCXK(鲁)2016-0013。
阿奇霉素(每片0.25 mg,H91417)购自辉瑞制药有限公司;注射用盐酸多柔比星(阿霉素,每支10 mg,130710)购自浙江海正药业股份有限公司;醋酸泼尼松(prednisone,Pdn)片(每片5 mg,130820)购自天津力生制药股份有限公司;牛血清白蛋白(bovine serum albumin,BSA)(A7906)购自美国Sigama公司;IL-2、IL-12、IL-6 ELISA试剂盒,均购自南京生物建成有限公司。
1.2 阿霉素与白蛋白肾损害小鼠模型的建立
参考文献方法[10]建立小鼠模型,小鼠随机分为空白对照组(Ctrl组)、肾损害模型组(ADR+BSA组)、阿奇霉素治疗组(Azm组)及醋酸泼尼松阳性对照组(Pdn组),每组10只小鼠;ADR+BSA、AZM及Pdn三组每天尾静脉注射9.8 mg·kg-1阿霉素,腹腔注射10 mg·kg-1血清白蛋白,一周5次,对照组注射生理盐水,持续4周。
1.3 治疗方案
模型制备后,AZM组每天灌胃给予62.5 mg·kg-1阿奇霉素,Pdn组每天灌胃给予12.5 mg·kg-1醋酸泼尼松,其余两组灌胃给予等量生理盐水,持续6周。
1.4 24 h尿蛋白检测
实验结束前一日,将小鼠置于代谢笼内饲养,禁食不禁水,收集并记录24 h尿量,并取少部分3 500 r·min-1离心10 min,使用全自动生化分析仪检测每只大鼠24 h尿蛋白浓度、尿肌酐(Ucr)。24 h尿蛋白量=24 h尿蛋白浓度(mg·ml-1)×24 h尿量(ml)
1.5 血清生化指标检测
实验结束前,对每组小鼠进行眼眶取血,离心取血清,采用全自动生化分析仪直接法检测并记录血清总胆固醇(TC)、白蛋白(ALB)、血肌酐(Scr)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)的含量。
1.6 内生肌酐清除率计算
记录每只小鼠体重,利用Ucr、Scr、尿量、体重计算内生肌酐清除率(Ccr)。肌酐清除率(ml·min-1·g-1)=(Ucr×每分钟尿量)/(Scr×体重)。
1.7 血清免疫因子检测
对“1.5”的血清采用ELISA法检测血清中IL-2, IL-12, IL-6含量,酶标仪检测吸光度值(OD值),确定其浓度。
1.8 统计学处理
2 结果
2.1 24 h尿蛋白和肌酐定量检测
24 h尿蛋白定量检测结果与内生肌酐清除率计算结果如表1所示。ADR+BSA组小鼠24 h尿蛋白定量显著升高,Ccr显著降低;经过阿奇霉素治疗后的小鼠,24 h蛋白定量相比于ADR+BSA组显著降低,Ccr显著升高。
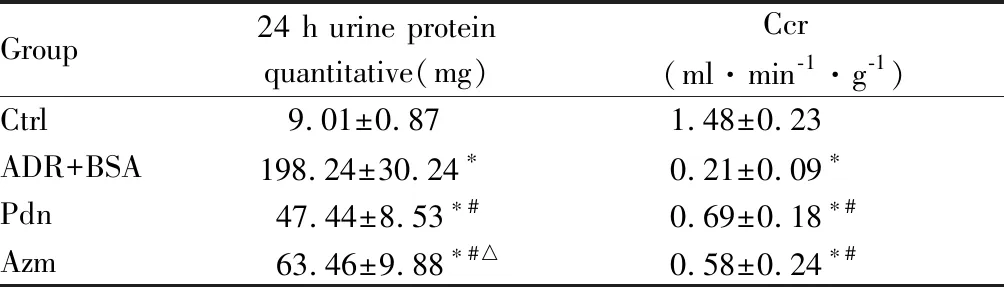
Group24 h urine protein quantitative(mg)Ccr(ml·min-1·g-1)Ctrl9.01±0.871.48±0.23ADR+BSA198.24±30.24∗0.21±0.09∗Pdn47.44±8.53∗#0.69±0.18∗#Azm63.46±9.88∗#△0.58±0.24∗#
Ctrl: Blank control group; ADR+BSA: Renal damage model group; Azm: Azithromycin treatment group; Pdn: Prednisone acetate positive control group
*P<0.05vsCtrl;#P<0.05vsADR+BSA;△P<0.05vsPdn
2.2 血清生化指标检测
血清生化指标结果如表2所示。与Ctrl组相比,ADR+BSA组小鼠血清中TC、Cr、LDL-C水平显著升高(P<0.05),HDL-C水平升高,ALB水平下降,提示小鼠肾脏损伤模型建立成功。Azm组与ADR+BSA组相比,TC、Cr、HDL-C、LDL-C水平显著降低(P<0.05),ALB显著回升(P<0.05);与Pdn组相比,阿奇霉素对ALB、Scr和HDL-C的影响与醋酸泼尼松相似,而对TC和LDL-C的降低效果较醋酸泼尼松更明显(P<0.05),该结果提示阿奇霉素对小鼠肾损伤具有治疗效果。

Tab. 2 Results of serum biochemical n=10)
Ctrl: Blank control group; ADR+BSA: Renal damage model group; Azm: Azithromycin treatment group; Pdn: Prednisone acetate positive control group
*P<0.05vsCtrl;#P<0.05vsADR+BSA;△P<0.05vsPdn
2.3 血清免疫因子表达水平检测
血清免疫因子水平如表3所示。相比于Ctrl组,ADR+BSA组小鼠IL-2、IL-12水平降低,IL-6水平增高(P<0.05)。Pdn和Azm组相较于ADR+BSA组,对免疫因子表达的影响均为IL-2、IL-12水平回升,IL-6的水平下降,且与Ctrl组水平仍有差距。结果提示,阿奇霉素对血清免疫因子表达的影响与醋酸泼尼松相似。


Group IL-2 IL-12 IL-6Ctrl970.6±49.332.13±2.5115.26±2.32ADR+BSA526.3±41.6∗17.26±1.38∗46.87±3.61∗Pdn836.7±48.6∗#25.33±4.11∗#25.23±5.14∗#Azm821.1±31.7∗#28.22±9.21∗#△24.97±3.11∗#
*P<0.05vsCtrl;#P<0.05vsADR+BSA;△P<0.05vsPdn
3 讨论
阿霉素与白蛋白诱导的肾脏损害是获得性肾小球肾病的小鼠模型[11],虽然对其机制尚不完全了解,但阿霉素可诱发类似于人类局灶性肾小球硬化的病理肾小球改变[12],并在其持续作用下发展为终末期的肾衰竭。本文利用该模型探讨了阿奇霉素在肾小球疾病治疗中作用。24 h尿蛋白量、内生肌酐清除率和血清生化指标结果显示,阿霉素给药后,ADR+BSA、Pdn、Azm组小鼠均出现肾病综合征,其表现为严重的蛋白尿、低蛋白血症、低肌酐清除率和高脂血症。其原因为阿霉素可直接损伤足细胞[13-15],导致蛋白尿和肾小球硬化,蛋白尿增多,进一步引发血浆白蛋白浓度降低,血浆渗透压降低,肾小球滤过率降低。血清生化指标表明高脂血症也是阿霉素肾病的主要特征之一。越来越多的证据表明,高脂血症和肾脂毒性是肾脏损害的重要致病因素[16],可能有助于阿霉素肾病的发展和进展。
文献报道[17]蛋白尿的产生由多种炎症因子介导,在肾病综合征进展过程中随Th1 /Th2平衡偏倚发生变化,故炎症介质可能是造成肾脏损害的重要危险因素和启动因素。血清免疫因子检测结果显示ADR+BSA组与Ctrl组相比,阿霉素诱导的肾病小鼠血清内IL-2和IL-6的水平显著升高,IL-12水平显著降低,证实了Th1 /Th2在肾病发展中的变化;Azm组小鼠经过阿奇霉素治疗后,IL-2和IL-6的水平相对于ADR+BSA组降低、IL-12水平升高,表明阿奇霉素对肾病小鼠的Th1 /Th2平衡有调整作用,且与阳性对照药物醋酸泼尼松相似。
综上所述,本研究结果表明:尾静脉注射阿霉素 9.8 mg·kg-1,同时再予以10 mg·kg-1的牛血清白蛋白,可以对BALB/c小鼠造成以蛋白尿、低蛋白血症、低肌酐清除率和高脂血症为特征的肾损伤。给予阿奇霉素,对肾损伤小鼠表现出一定的治疗效果,在对24 h尿蛋白、内生肌酐清除率、血清生化指标和免疫因子表达的影响上与醋酸泼尼松相似。虽然其确切的机制需要更多的研究,但为今后阿奇霉素在对免疫因子表达影响作用上的研究提供了一定的理论依据。

