pcDNA3.1(+)-CTGF真核表达质粒构建及其在人成骨样细胞SaOS-2细胞中的表达*
马科锋,杨树广,刘少君
(军事科学院军事医学研究院军事认知与脑科学研究所,北京 100850)
骨折治疗常用的策略是在骨内植入骨钉进行内固定,但是仅凭这种方法治愈缓慢[1-3]。骨折愈合过程是骨生成和骨吸收相互作用的过程,骨愈合时软骨细胞首先纤维化形成软愈伤组织、软骨细胞外基质矿化,随后在成骨细胞调节下形成编织骨,破骨细胞清除未成熟的编织骨和软骨基质直至形成具有力学稳定性的成熟骨[4]。因此加速骨生成可能是治疗骨丢失疾病的关键。结缔组织生长因子(connective tissue growth factor, CTGF)是由349个氨基酸组成的富含半胱氨酸的分泌蛋白,属于CCN蛋白家族成员之一[5]。CTGF参与多种细胞事件,包括血管生成、伤口愈合和骨生成[6],相继发现其在牙齿、软骨和骨骼中广泛表达[7-9]。本实验室前期采用小RNA(miRNA)干预成骨细胞,并通过转录组测序进行分析,发现CTGF基因表达显著降低,说明CTGF可能是miRNA调控的下游基因。因此深入研究CTGF对骨组织的调控作用对以骨吸收为主要特征的疾病的治疗具有重要价值。
1 材料与方法
1.1 材料
SaOS-2、人肾上皮细胞系(293T)购于美国模式培养物研究所(ATCC)细胞库,由本实验室冻存传代;大肠杆菌DH5α感受态细胞(E.coli)、1Kb Plus DNA Marker购于北京全式金生物技术有限公司;限制性内切酶BamHI和XhoI购于美国New England Biolabs公司;聚合酶链式反应(PCR)反转录试剂盒、小量质粒抽提试剂盒、脱氧核糖核酸(DNA)胶回收试剂盒购于美国promega公司;TreliefTMSoSoo Cloning Kit购于北京擎科生物技术有限公司;引物由北京擎科生物技术有限公司合成;Lipofectamine 3000、酵母提取物、胰蛋白胨、琼脂粉等试剂购于Invitrogen公司。
1.2 CTGF目的基因全长扩增
根据美国国立生物技术信息中心(NCBI)中人CTGF基因编码区序列(CDS号为5151.1)及pcDNA3.1(+)载体多克隆位点信息,将目的基因插入pcDNA3.1(+)载体BamHI和XhoI酶切位点间,并扩增全长1 050 bp。分别设计上游引物序列为:5’-TACCGAGCTCGGATCCATGACCGCCGCCAGTATGG GC-3’、下游引物序列为:5’-AACGGGCCCTCTAGACTCGAGTCATGCCATGTCTCCGTACAT-3’。以293T细胞cDNA为模版,选取最佳PCR扩增条件:98°C 4 min;98℃ 10 s、60℃ 30 s、72℃ 60 s,40个循环;72℃延伸10 min。取5 μl 目的基因和阳性对照(凋亡信号调节激酶(ASK1),该基因可以正确扩增出来以确保扩增体系无误)PCR扩增产物经1%琼脂糖凝胶电泳鉴定分析,无误后进行目的基因产物回收和胶纯化。
1.3 重组质粒连接、提取及鉴定
将pcDNA3.1(+)-vector用限制性内切酶BamHI和XhoI进行双酶切,跑胶纯化回收后制备成线性化载体。分别将目的基因、阳性对照(TreliefTMSoSoo Cloning Kit试剂盒中自带阳性基因)、阴性对照(双蒸水)与载体按照摩尔比为5∶1的比例,采用TreliefTMSoSoo Cloning Kit进行片段与载体间的无缝连接。将连接产物转化到感受态E.coli(DH5α)中,在不含氨苄青霉素的LB液体培养基中于 37°C 震荡培养1 h后涂板。经氨苄青霉素固体培养皿筛选出含有pcDNA3.1-CTGF重组质粒的E.coli,挑取5个阳性克隆,加入含有氨苄青霉素的液体培养基中,37°C振荡培养17 h,观察到菌体大量扩增后,按照Promega小量质粒抽提试剂盒说明书提取质粒,并将目的质粒送公司测序,完成后将测序结果与目的基因序列进行比对。
1.4 细胞培养
SaOS-2细胞、293T细胞由含10%胎牛血清的DMEM高糖完全培养基,于37°C、5% CO2、饱和湿度的恒温培养箱中进行培养,0.25%胰酶消化传代,取对数生长期的细胞进行实验。
1.5 质粒转染及实时荧光定量核酸扩增(qPCR)检测
将SaOS-2细胞培养于6孔板中,当细胞密度达70%~80%时,使用lipofectamine 3000 按照操作说明书步骤将成功构建的1 μg pcDNA3.1-CTGF重组质粒转染至SaOS-2细胞中,空白对照组仅以pcDNA3.1(+)-vector转染至SaOS-2细胞,在细胞培养箱中转染6 h后弃去转染混合液,添加完全培养基继续培养。转染48 h后,弃去培养基,磷酸盐缓冲液(PBS)洗涤2遍后收集细胞,提取细胞内总核糖核酸(RNA),紫外分光光度计测定RNA样本纯度(A260/A280)在1.8-2.0之间,表示总RNA片段完整未降解可用。按照试剂盒说明进行逆转录反应合成互补脱氧核糖核酸(cDNA)。ABI StepOne PlusTMReal Time PCR测定细胞中CTGF基因表达水平,采用2-(△△Ct)方法进行分析。特异性上游引物序列为:GCCCAGACCCAACTATGATTAG,下游引物序列为:TCTCCGTACATCTTCCTGTAGT。
1.6 统计学处理
2 结果
2.1 CTGF基因扩增凝胶电泳检测
从NCBI上获取CTGF基因全长,设计引物进行PCR扩增,扩增片段大小为1 050 bp。293T细胞作为转染常用细胞,其所含目的基因丰度较高故用作提取CTGF cDNA进行扩增。结果如图1所示,PCR产物凝胶电泳显示目的条带大小约为1 000 bp,与CTGF基因大小相符,表明成功扩增出了CTGF目的基因。对其进行切胶,回收产物。

Fig. 1 Electrophoresis of CTGF PCR products
M: DNA Marker; 1、2: CTGF gene; 3: Positive control
2.2 质粒构建及扩增
为了得到大量pcDNA3.1(+)-CTGF重组质粒,将pcDNA3.1(+)-vector用限制性内切酶BamHI和XhoI酶切制备线性化载体,并与目的基因片段连接。将连接产物转化到感受态E.coli(DH5α)中,涂板,经氨苄青霉素筛选出含有目的基因CTGF重组质粒的E.coli,培养结果如图2所示,其中阴性对照组仅采用等比例线性载体与双蒸水混合进行同源重组,其菌落产生可能是由于线性载体纯化不充分或者存在载体自连情况。对CTGF菌落随机挑取5个单克隆菌株,37°C振荡培养17 h后提取质粒。

Fig. 2 Transfection and filtration ofE.coli
A: CTGF colony; B: Positive control colony; C: Negative control colony
2.3 测序
对随机挑取的5个单克隆质粒进行双向测序,拼接后与CTGF碱基进行比对,其中4个质粒构建成功。图3展示了测序结果的部分峰图。与CTGF基因序列相比,扩增得到的序列基本正确,但是有3处碱基发生了突变(蓝色碱基)(图4 A),可能是由于模版自身发生突变所致。为了确定该突变是否影响蛋白序列,经过进一步比对发现,扩增得到的CTGF基因的蛋白序列与原基因的蛋白序列一致(图4 B),说明该处突变不影响CTGF蛋白功能,即成功构建了pcDNA3.1(+)-CTGF重组质粒(图3,图4,见彩图页Ⅳ)。
2.4 CTGF基因信使RNA(mRNA)的转录情况
将构建成功的重组质粒pcDNA3.1(+)-CTGF转染到SaOS-2细胞中,48 h后检测CTGF mRNA的表达情况。RT-PCR结果表明,转染后细胞内CTGF mRNA表达与对照组相比约上调4.8105倍(图5),具有显著性统计差异(P<0.01),进一步表明pcDNA3.1(+)-CTGF重组质粒构建成功。
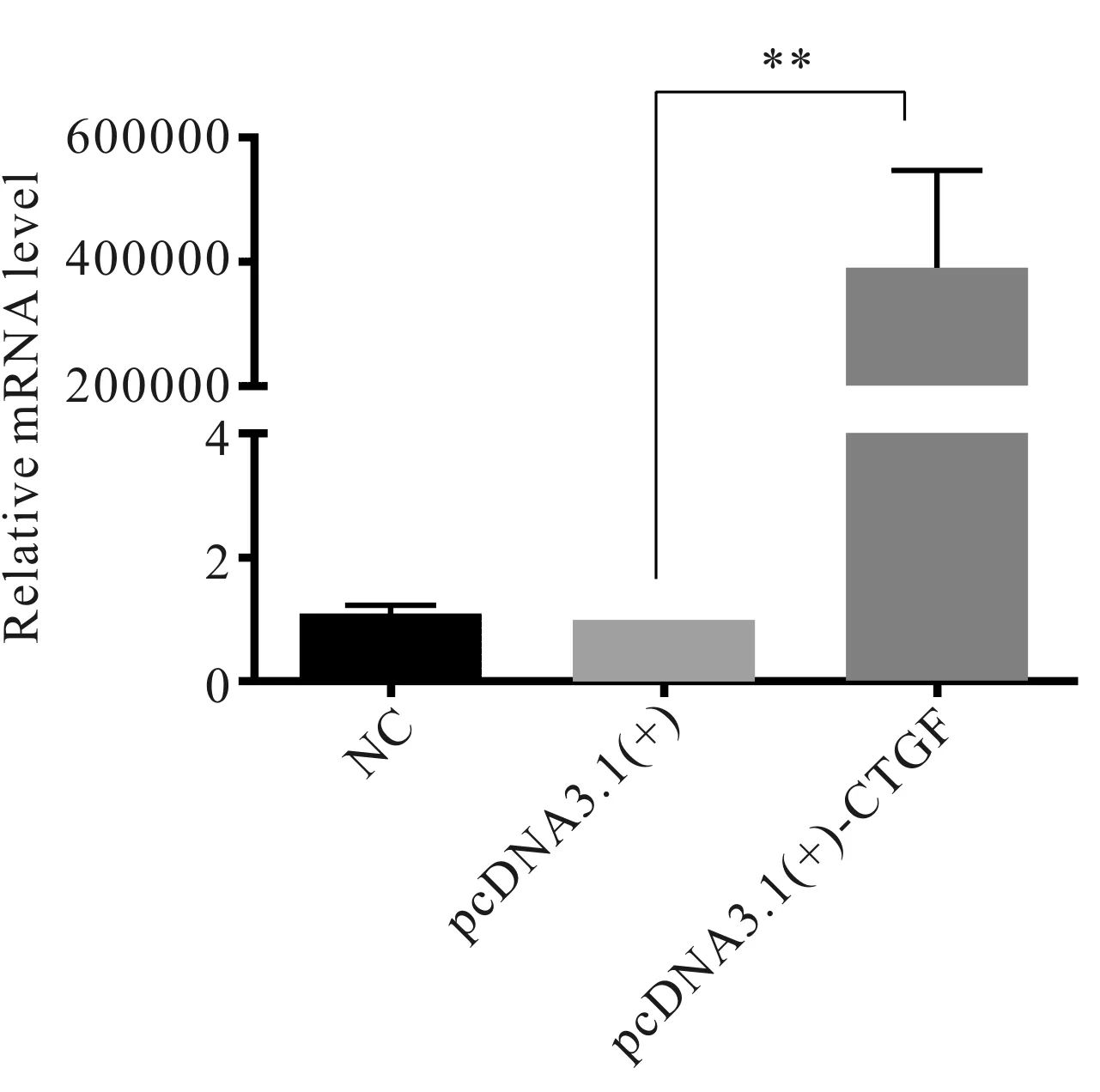
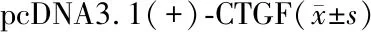
**P
3 讨论
软骨细胞纤维化是骨重建的第一步,CTGF基因可能在该阶段起重要作用。比如肋骨骨折模型小鼠结果显示,骨折后第8日在骨折区域的肥大软骨细胞和增殖软骨细胞中检测到CTGF基因表达增多,而第20日后同一区域的CTGF表达量下降,此时软骨细胞形成的愈伤组织正向编织骨转换[10]。Ivkovic S等[8]认为CTGF介导细胞基质中胶原沉积,CTGF基因突变会导致软骨内成骨受损,从而导致骨重构缺陷。韩晓静和崔茂香的研究指出,大鼠肺纤维化进程中伴随CTGF的显著表达,间接说明CTGF可能是通过促进软骨细胞纤维化而促进骨愈合[11,12]。鉴于CTGF对骨组织的正向调控,我们设计了pcDNA3.1(+)-CTGF表达重组质粒。
本实验为了提取丰富的目的基因,我们从CTGF基因表达丰度较高的293T细胞-人肾上皮细胞中提取目的基因,实验结果也表明我们成功扩增出了大量的CTGF基因的cDNA,位于~1 000 bp处,与DNA序列数据库(GeneBank)上的参考序列长度相比基本符合。该步骤中用ASK1基因作为阳性对照组,我们之前的研究已经证明ASK1基因在该扩增体系中可以成功扩增,以确保扩增体系比例适中。本实验将CTGF基因在大肠杆菌中大量扩增,然后转染入成骨样细胞中观察其表达,所以需要在原核生物和真核细胞中都能发挥作用的载体。pcDNA3.1(+)载体既携带有大肠杆菌的复制起点,也携带有真核启动子,因此选择其作为CTGF基因的载体工具[13]。对构建成功的重组质粒测序后发现,两处腺嘌呤突变为胞嘧啶,一处胞嘧啶突变为鸟嘌呤。进一步比对CTGF基因扩增产物的蛋白序列和参考蛋白序列后发现,氨基酸并未发生变化,该突变为同义突变。氨基酸由三联体密码子翻译而来,一个氨基酸可以对应多个密码子,称为密码子的简并性,该特性对生物体减少有害突变具有重要的生物学意义[14]。最后经过细胞转染,检验了构建的pcDNA 3.1(+)-CTGF重组质粒的可靠性。
重组质粒是体外研究基因功能的常用手段之一[13,15,16]。基于前期实验以及文献调研,我们设计和构建了pcDNA3.1(+)-CTGF表达重组质粒,并且在成骨样细胞中可以稳定表达,为下一步利用该重组质粒研究CTGF基因功能和其在骨折愈合的生物学机制奠定了基础。

