大菱鲆肠道中广谱拮抗活性乳酸菌的筛选及其细菌素鉴定
马国涵,马欢欢,吕欣然,刘佳伊,孙 悦,白凤翎,*,励建荣
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083)
水产类富含丰富的脂肪酸、蛋白质,引起其腐败变质的微生物主要为细菌[1-3]。Sharma等[4]从腐烂鱼鳍和尾巴分离获得导致鱼体外寄生溃疡综合征的6 种病原菌,分别为Enterococcus faecalis、Aeromonas hydrophilla、Cellobiosococcus sciuri和Micrococcus luteus。
目前生物保鲜技术已成为控制生鲜食品腐败变质的主要方法之一[5-6]。而乳酸菌nisin及一些植物提取物抑菌谱较窄,因此,从自然生态环境中寻找具有广谱拮抗活性的乳酸菌对控制水产品腐败菌具有重要的研究价值。Rauta等[7]从攀鲈鱼肠道分离获有较强抑菌作用的乳酸菌Lactobacillus casei,研究发现对Proteus vulgaris和Klebsiella pneumoniae均具有较强的抑制作用,抑菌直径可达15~18 mm。Ghomrassi等[8]从地中海海岸地区捕捉的乌颊鱼鲤科鱼、叉牙鲷和海鲷等8 种海鱼皮肤表面和肠道获得18 株乳酸菌,经16S rRNA鉴定有15 株E. faecalis和3 株L. lactis,其中E. faecium HTE5抑菌谱较广,可有效抑制Listeria monocytogenes等鱼类病原菌,经实验分析,细菌素类为其抑菌的有效成分。Gerez等[9]应用96 孔板法从不同源的91 株乳酸菌中获得1 株产抗菌肽的菌株Lactobacillus fermentum CRL251,其无细胞上清液(cell-free supernatant,CFS)对Aspergillus niger CH101和Fusarium graminearum CH103的抑菌率均大于80%,抗菌肽分子质量小于10 ku。Ullah等[10]从传统发酵酸菜中分离1 株对革兰氏阳性菌和阴性菌均具有良好抑菌作用的L. casei,经Sephadex G-25凝胶层析、HiPrep QXL 16/10柱的AKTA蛋白纯化系统和反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)纯化,后经基质辅助激光解吸电离串联飞行时间(matrix-assisted laser desorption ionisation/time-offl ight/time-of- fl ight,MALDI-TOF/TOF)质谱分析测定其细菌素分子质量为4.89 ku。乳酸菌在自然界分布广泛,海洋鱼类肠道是乳酸菌的重要栖息地。本研究从养殖大菱鲆肠道中分离筛选广谱抑菌活性物质的乳酸菌,并对其抑菌物质进行分离、提纯及鉴定,为一种控制水产品腐败的新型高效食品级生物防腐剂的研发和应用奠定良好的理论基础。
1 材料与方法
1.1 材料与试剂
大菱鲆购自辽宁省锦州市金凌商场。
金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003、蜡样芽孢杆菌(Bacillus cereus)CMCC 63301 中国医学微生物菌种保藏管理中心;地衣芽孢杆菌(Bacillus subtilis)ACCC 11091 中国农业微生物菌种保藏中心;单核细胞增生李斯特氏菌(L. monocytogenes)ATCC 19115、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 9027、哈维氏弧菌(Vibrio harveyi)ATCC BB-170 美国典型菌种保藏中心;荧光假单胞菌(Pseudomonas fl uorescens)P001、温和气单胞菌(Aeromonas sobria)L002分离自大菱鲆体表。
LB肉汤、MRS培养基、LB营养琼脂 北京奥博星生物技术有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司;木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶 华蓝化学有限公司;α-氰基-4-羟肉桂酸(α-cyano-4-hydoxycinnamic acid,HCCA) 上海恒远生物科技有限公司;DNA Marker-D、细菌基因组DNA快速抽提试剂盒、Taq聚合酶链式反应(polymerase chain reaction,PCR)Master mix生工生物工程(上海)股份有限公司;乙酸乙酯、石油醚 天津市富宇精细化工有限公司;Sephadex G-25美国Amresco公司。
1.2 仪器与设备
GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;DL-CJ-2N型超级洁净工作台 东联哈尔(北京)仪器制造有限公司;赛福智能生化培养箱宁波海曙赛福实验仪器厂;5804R冷冻高速离心机德国Eppendorf公司;PCR仪 德国艾本德股份有限公司;DYY-8C电泳仪 北京市六一仪器厂;Cheimdox XRS凝胶成像仪 美国Bio-Rad公司;LabconcoFreeZone 2.5台式真空冷冻干燥机 美国Labconco公司;Labscale TFF System小型切向流超滤系统 上海密理博贸易有限公司;1260 HPLC仪 美国Agilent公司;MALDI-TOF/TOF质谱仪 美国AB SCIEX公司。
1.3 方法
1.3.1 大菱鲆肠道中乳酸菌的分离
称取大菱鲆的肠道10.0 g,切成约2.0 cm长的片段,转移至装有90 mL无菌水的锥形瓶中,经充分振荡后静置10 min。吸取100 μL液体涂布于加入1% CaCO3的MRS琼脂平板,放入37 ℃培养箱中培养48 h,取白色且有明显溶钙圈的菌落进行纯化。纯化培养后,选取单菌落进行革兰氏染色和过氧化氢酶实验进行初筛。
1.3.2 广谱性抑菌作用乳酸菌的筛选
1.3.2.1 乳酸菌CFS的制备
取10 mL初筛菌株培养24 h的发酵液,经4 ℃、8 000 r/min离心10 min,取上清液经0.45 μm滤器过滤获得CFS,4 ℃冰箱保存备用。
1.3.2.2 指示菌的制备
将保藏于-80 ℃的铜绿假单胞菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌、地衣芽孢杆菌、温和气单胞菌、蜡样芽孢杆菌、荧光假单胞菌和哈维氏弧菌分别接种LB液体培养基,30 ℃培养12 h,经2 代活化后,用灭菌生理盐水制备成106CFU/mL的指示菌菌悬液。
1.3.2.3 广谱性菌株的筛选
以菌株LP1-作为目标菌,铜绿假单胞菌、荧光假单胞菌、温和气单胞菌和哈维氏弧菌4 株革兰氏阴性菌,单核细胞增生李斯特氏菌、金黄色葡萄球菌、地衣芽孢杆菌和蜡样芽孢杆菌4 株革兰氏阳性菌为指示菌,参照文献[11]应用牛津杯琼脂扩散法对菌株LP1-4 CFS进行抑菌实验。
1.3.3 乳酸菌菌株鉴定
1.3.3.1 生理生化鉴定
参照《乳酸细菌分类鉴定及实验方法》和《伯杰氏细菌鉴定手册》(8版)中乳酸菌的鉴定方法进行生理生化实验[12-14]。
1.3.3.2 16S rRNA鉴定
在1.5 m L E P管中加入1.0 m L乳酸菌培养12 h发酵液,12 000 r/min离心5 min收集菌体,使用16S rRNA通用引物对DNA快速抽提试剂盒提取的菌株DNA进行PCR扩增。正向引物为27f(5′-AGAGTTTGATCCTGGCTCAG-3′),反向引物为1492r(5′-TACGGYTACCTTTGTTACGACTT-3′),引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系为上游引物1.0 μL、下游引物1.0 μL、DNA模板1.0 μL、ddH2O 9.5 μL、Taq PCR Master mix 12.5 μL,总体积25 μL。PCR扩增步骤:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,72 ℃保持10 min,循环30 次,4 ℃保温。
PCR产物经1%琼脂糖凝胶电泳,观察凝胶成像系统的扩增效果并照相。将扩增成功的PCR产物送至生工生物工程(上海)股份有限公司进行测序。测序结果经校对后与NCBI上GenBank数据库中的已有序列进行BLAST比对分析,运用MEGA 5.0软件构建菌株系统发育进化树。
1.3.4 乳酸菌生长与拮抗活性曲线
在10 mL MRS液体培养基中接种200 μL乳酸菌发酵液,37 ℃静置培养。利用来源和应用的相似相容原则,以分离自大菱鲆的荧光假单胞菌和温和气单胞菌为指示菌进行实验,参照文献[11]每隔4 h测定菌株CFS的抑菌活性,并测定菌悬液pH值和OD600nm值。
1.3.5 影响乳酸菌CFS拮抗活性因素分析
酶敏感性实验:将乳酸菌CFS分别用1.0 mol/L NaOH溶液和1.0 mol/L HCl溶液调至酶的最佳pH值(中性蛋白酶pH 7.0、木瓜蛋白酶pH 7.0、胰蛋白酶pH 7.5、胃蛋白酶pH 2.0和碱性蛋白酶pH 10.0),在乳酸菌CFS中添加终质量浓度为1.0 mg/mL的蛋白酶,37 ℃水浴中孵育2 h后,将pH值调至初始值,同时以乳酸菌CFS作对照,参照文献[11]进行抑菌实验。
pH值实验:用1.0 mol/L HCl溶液和1.0 mol/L NaOH溶液将乳酸菌CFS pH值分别调至2.5、3.5、4.5、5.0、5.5、6.0、6.5,参照文献[11]方法进行抑菌实验,以所对应的相同pH值MRS作空白对照。
热稳定性实验:分别经50、100、121 ℃对乳酸菌CFS处理30 min,参照文献[11]方法进行抑菌实验,同时以乳酸菌CFS作对照。
1.3.6 细菌素初级纯化
1.3.6.1 有机溶剂萃取
利用乙酸乙酯和石油醚分别对菌株LP1-4 CFS进行萃取。取菌株LP1-4 CFS 100 mL置于500 mL分液漏斗中,然后取有机溶剂100 mL,分5 次加入分液漏斗中,并沿同一方向缓慢振荡,静置5 min左右至液体出现明显的分层现象,收集下层溶液于灭菌锥形瓶,上层乳化液置于旋转蒸发瓶。将萃取5 次获得乳化液统一收集,真空条件下100 r/min、45 ℃旋转蒸发至液体颜色澄清收集萃取液,水相作为阴性对照,乳酸菌CFS为阳性对照,按
1.3.2.3 节方法进行抑菌活性测定。
1.3.6.2 乳酸菌抗菌活性物质的分离纯化
参照邢德明等[15]方法并稍作修改。取上述乙酸乙酯萃取后获得乳酸菌粗提物经LabscaleTMTFF System分级纯化,按分子质量(m)大小分成的4 个组分样品:组I(10 ku<m<30 ku)、组II(5 ku<m<10 ku)、组III(1 ku<m<5 ku)、组IV(m<1 ku),菌株LP1-4粗提物为对照组,参照1.3.2.3节方法进行抑菌活性测定,后置于4 ℃保存备用。
1.3.7 细菌素的层析
参照Muhialdin等[16]方法并稍作修改,利用Sephadex G-25凝胶层析对超滤液体进一步纯化。称取5.0 g干燥Sephadex G-25 medium粉末于50 mL蒸馏水中浸泡过夜,沸水煮沸30 min,抽真空排气2 h。用0.02 mol/L pH 6.0磷酸缓冲盐溶液装柱平衡过夜,控制流速为0.5 mL/min。上样量2.0 mL,收集洗脱液按1.3.2.3节方法进行抑菌实验。并将具有抑菌活性的洗脱液于250 mL灭菌烧杯中-40 ℃真空冷冻干燥4 d,取出后于-80 ℃冰箱保存备用。
1.3.8 HPLC纯化
参照An Junying等[17]方法并稍作修改。取上述冻干物加入1 mL灭菌超纯水,经0.45 μm滤膜过滤。HPLC检测条件:流动相:A为0.1%三氟乙酸水溶液,B为0.1%三氟乙酸甲醇溶液;洗脱条件:流动相B,0%~0%平衡4 min,0%~100%梯度洗脱21 min,100%~100%平衡6 min,100%~0%梯度洗脱3 min,0%~0%平衡6 min;色谱柱:Agilent TC-C18柱(4.6 mm×250 mm,5 μm);荧光检测器波长280 nm;柱温30 ℃;流速0.8 mL/min;进样100 μL。收集单峰洗脱液,参照1.3.2.3节方法进行抑菌实验,并收集具有抑菌活性洗脱液于10 mL灭菌离心管,4 ℃保存备用。
1.3.9 质谱分析
经HPLC纯化后的液体取1.0 µL点在样品靶上,待干燥后,同样点1.0 µL的HCCA基质溶液,全部干燥后上机分析。样品靶放入MALDI-TOF/TOF质谱仪,启动控制软件,进行数据采集。质谱采集参数:正离子反射模式,一级质谱分子质量范围为0.7~3.5 ku,二级质谱分子质量范围为0.04~1.05 ku。搜库鉴定:1)合并一级质谱和二级质谱数据,产生 peaklist文件;2)利用 MASCOT搜索引擎进行蛋白质检索。检索数据库为NCBI nr数据库,搜库参数:酶:Rrypsin;最大允许错切位点1;固定修饰:脲甲基;可变修饰:氧化;一级质谱容差:1.5×10-4;二级质谱容差:0.6 Da;P≤0.05。
1.4 数据处理
均重复3 次实验进行测定,数据采用 ±s形式,应用Origin 8.0软件进行绘图,并采用SPSS 18.0软件进行统计学分析。
2 结果与分析
2.1 产广谱性抑菌活性物质乳酸菌的筛选
从大菱鲆肠道中筛选出15 株革兰氏染色阳性、过氧化氢酶阴性且具有明显溶钙圈的乳酸菌,按分离顺序和中文首字母进行命名。进一步应用牛津杯琼脂扩散法筛选出5 株对指示菌具有较强抑制作用的乳酸菌,分别为LP1-6、LP1-4、LP4-3、LP2-3和LP3-2。从表1可以看出,5 株乳酸菌CFS对8 株指示菌均存在不同程度的抑制作用。菌株LP1-4对8 株指示菌的抑菌效果最强,抑菌谱较广,菌株LP1-6和LP2-3次之,菌株LP4-3和LP3-2仅对特定指示菌具有良好的抑制作用。结果表明,菌株LP1-4生长过程中产生了具有广谱性抑菌活性物质。因此,选取菌株LP1-4作为下一步的实验菌株。
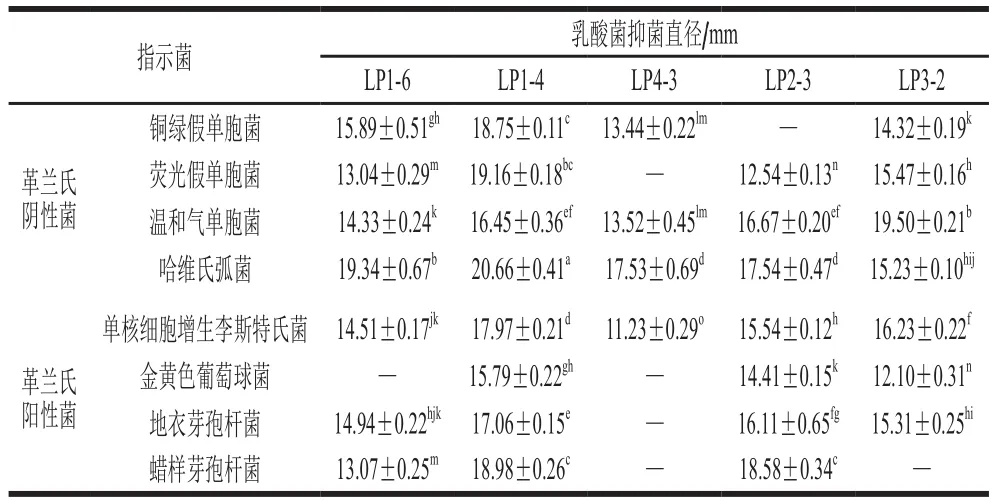
表1 乳酸菌对8 株指示菌的抑菌结果Table 1 Antibacterial results of lactic acid bacteria against eight indicator bacteria
2.2 乳酸菌菌株鉴定
2.2.1 生理生化反应
依照文献[14]对菌株LP1-4的生理生化鉴定结果(表2)进行分析,可初步判定菌株LP1-4为植物乳杆菌(Lactobacillus plantarum)。

表2 菌株LP1-4的生理生化鉴定结果Table 2 Physiological and biochemical identi fi cation results of strain LP1-4
2.2.2 16S rRNA鉴定
应用1%琼脂糖凝胶电泳对菌株LP1-4 PCR产物的分离结果见图1,Marker内含子分子质量为100、250、500、750、1 000 bp和2 000 bp,菌株LP1-4在1 500 bp左右出现荧光条带。对菌株LP1-4 PCR产物进行测序分析后发现其16S rRNA基因序列长度为1 448 bp。
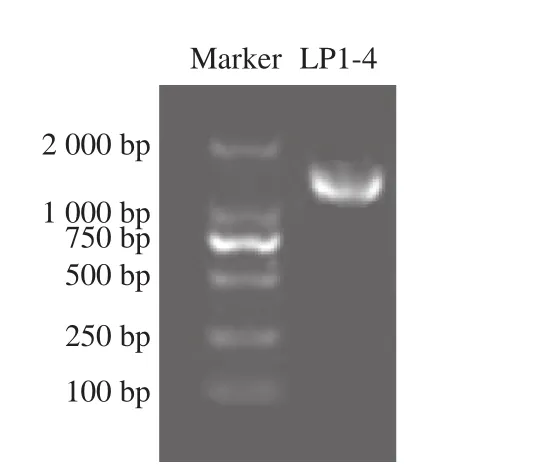
图1 菌株LP1-4的16S rRNA基因扩增电泳图Fig. 1 Electropherogram of PCR-amplified 16S rRNA gene of LP1-4
图2是将菌株LP1-4的测序结果使用MEGA 5.0软件与GenBank数据库中标准菌株基因序列进行比对的结果,菌株LP1-4与1株标准菌株L. plantarumSMN1-5的同源性达到99%,可确定菌株LP1-4为L. plantarum。
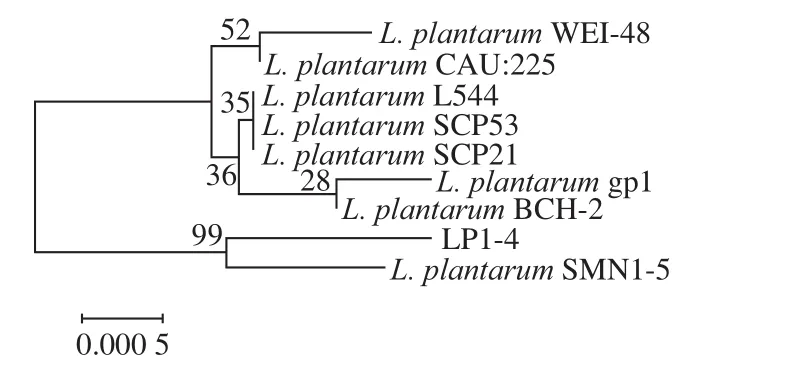
图2 菌株LP1-4的16S rDNA系统发育树Fig. 2 Phylogenetic tree based on 16S rDNA sequences of LP1-4
2.3 乳酸菌生长与拮抗活性曲线
乳酸菌代谢过程中可产生细菌素、罗伊菌素、乳酸等拮抗性产物,可有效抑制细菌、霉菌等生长繁殖[15]。以温和气单胞菌和荧光假单胞菌为例,由图3可看出,菌株LP1-4的细胞生长量和抑菌活性之间呈同步增长。乳酸菌生长16 h进入稳定期,此时抑菌活性仍处于上升的趋势;培养24 h时菌株LP1-4抑菌直径达到峰值,对温和气单胞菌和荧光假单胞菌抑菌直径分别为20.87 mm和19.96 mm;后随着培养时间持续延长,抑菌活性与24 h相比差异不显著(P>0.05)。因此,选择培养24 h的CFS作为抑菌活性物质产生的最佳时间。

图3 菌株LP1-4的生长及拮抗活性曲线Fig. 3 Growth and antagonistic activity curves of LP1-4
2.4 影响乳酸菌CFS拮抗性的因素
2.4.1 酶敏感性实验
蛋白酶敏感性测定可确定抑菌活性物质是否具有蛋白特性[18]。从图4可看出,经不同蛋白酶处理后菌株LP1-4 CFS抑菌活性呈不同程度的丧失,与对照组相比差异性显著(P<0.05)。而经碱性蛋白酶处理后菌株LP1-4 CFS对温和气单胞菌和荧光假单胞菌的抑菌活性分别降低了40.33%和32.04%,呈极显著性差异(P<0.01),表明抑菌活性物质对碱性蛋白酶极敏感。初步判断株菌LP1-4 CFS抑菌活性物质可能还具有蛋白特性的细菌素类。任士菊等[19]发现冷水鱼肠道源乳酸菌抑菌物质对胰蛋白酶比较敏感,并证实类细菌素或细菌素存在于抑菌组分中。

图4 酶处理对菌株CFS抑菌活性的影响Fig. 4 Effects of enzyme treatment on the antibacterial activity of CFS
2.4.2 pH值实验
从表3可看出,菌株LP1-4 CFS抑菌直径随着pH值升高呈下降的趋势。当pH 4.5时,菌株LP1-4 CFS对温和气单胞菌和荧光假单胞菌的抑菌直径均呈显著性降低(P<0.05),分别为16.23 mm和15.43 mm,而MRS组抑菌活性完全丧失。pH 5.0时,CFS仍具有较弱的抑菌活性;当pH值升到5.5后CFS抗菌活性完全丧失(pH 5.5~6.5,表中均未给出)。结果表明,菌株LP1-4 CFS的抑菌活物质在酸性条件下比较稳定,且抑菌活性物质pH值适应范围2.5~5.0。
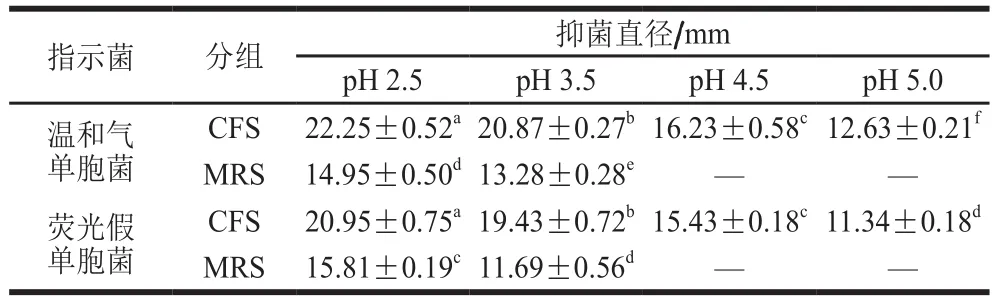
表3 pH值对菌株LP1-4 CFS抑菌活性的影响Table 3 Effects of pH on the antibacterial activity of LP1-4 CFS
2.4.3 热处理实验
从图5可看出,不同温度处理后菌株LP1-4 CFS的抑菌直径变化差异性不显著(P>0.05),且121 ℃处理后的CFS仍均有较强的抗菌作用。结果表明,菌株LP1-4 CFS中抑菌物质具有较好的热稳定性。相似研究已有报道,刘国荣等[20]从母乳婴儿粪便中获得产广谱细菌素的乳酸菌Lactobacillus rhamnosus,121 ℃处理后细菌素活性仍然保持稳定。
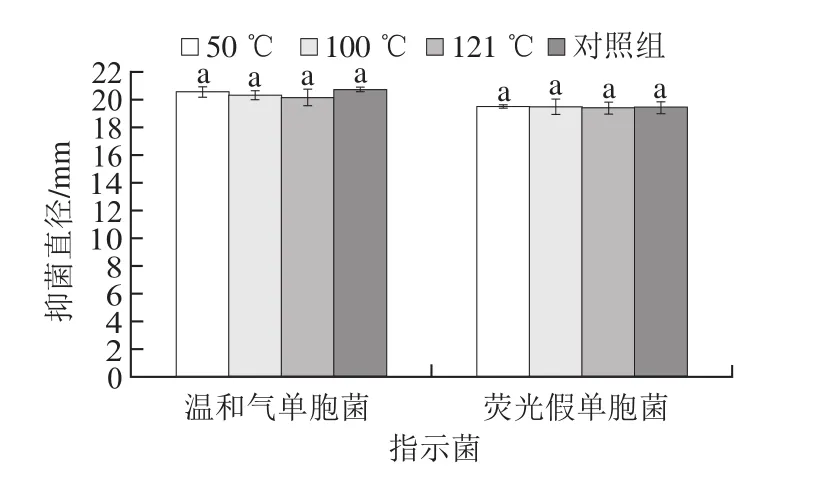
图5 热处理对菌株LP1-4 CFS抑菌活性的影响Fig. 5 Effects of thermal treatment on the antibacterial activity of LP1-4 CFS
2.5 细菌素初级纯化
小分子多肽或蛋白类的细菌素通常采用有机溶剂萃取法[21]。从表4可看出,菌株LP1-4 CFS经乙酸乙酯萃取后,萃取液的有机相抑菌直径与CFS相比差异显著(P<0.05),抑菌直径为25.42 mm,水相抑菌效果较小。经石油醚萃取后,萃取液的有机相和水相与CFS相比对温和气单胞菌抑菌直径不具有显著性差异(P>0.05)。分析表明,与石油醚相比应用乙酸乙酯作为萃取剂可较大程度上提取菌株LP1-4 CFS中的细菌素。因此,选择乙酸乙酯作为萃取剂进行下一步实验。

表4 菌株LP1-4 CFS的粗提取结果Table 4 Diameters of inhibition zone of A. sobria when exposed to different solvent extracts of LP1-4 CFS mm
菌株LP1-4萃取液采用Labscale TFF System小型切向流超滤系统分级纯化后,发现组I、II、III和IV的收集液对温和气单胞菌抑菌直径与对照组相比不具有显著性(P>0.05,数据均未给出)。表明菌株LP1-4 CFS中细菌素分子质量可能小于1.0 ku。
2.6 细菌素中度纯化
根据分子大小凝胶层析能对蛋白质混合物进行有效分离[22-23]。图6是菌株LP1-4细菌素经G-25凝胶层析,不同时间点洗脱液对温和气单胞菌的抑菌结果,120 min的洗脱液对温和气单胞菌具有抑制作用,抑菌直径为15.88 mm,低于对照组,原因是由于抑菌物质回收后被稀释。结果表明,菌株LP1-4 CFS中抑菌活性物质存在于120 min收集管洗脱液,收集并进行下一步实验。
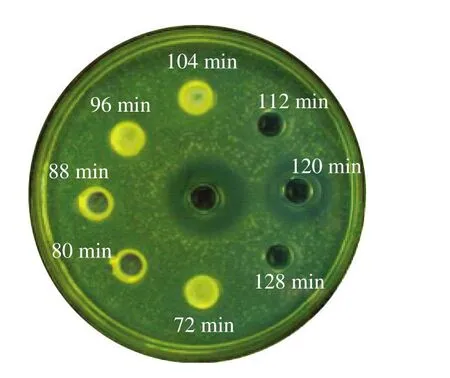
图6 菌株LP1-4 CFS经G-25交联葡聚糖柱层析后拮抗作用效果(中间孔中为洗脱液)Fig. 6 Antagonistic effects of substances separated by SephadexG-25 column chromatography from LP1-4 CFS
2.7 HPLC纯化
HPLC是纯化细菌素有效方法之一[24-25],从图7可看出,经Agilent TC-C18色谱柱检测分别得到3、5、11 min三个峰。对其洗脱液进行抑菌作用研究,发现保留时间5 min峰洗脱液对温和气单胞菌的抑菌直径为15.86 mm,其余2 峰洗脱液均无抑菌作用。结果表明,抑菌物质在液相分离条件下的目标峰保留时间为5 min。
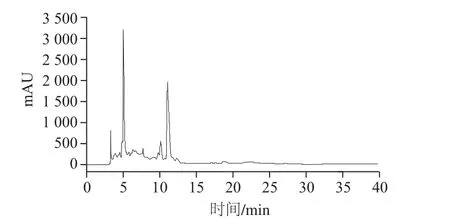
图7 菌株LP1-4细菌素的HPLC图Fig. 7 HPLC profile of bacteriocin produced by LP1-4
2.8 质谱分析
应用质谱法分析菌株LP1-4细菌素分子质量及氨基酸排列顺序[26-28],从图8可看出,该细菌素分子质量为0.854 ku,与分级纯化结果相辅相成。Casaburi等[29]分离自传统意大利发酵香肠中Lactobacillus curvatus54M16对L. monocytogenes、Bacillus cereus和Brochotrix thermosphacta当具有较强的抑制作用,抑菌活性物质经反相HPLC纯化后经MALDI-TOF/TOF质谱鉴定发现其分子为2.5 ku。经搜库鉴定分析得出,菌株LP1-4细菌素由5 种氨基酸组成的8 个氨基酸序列,肽链中氨基酸的排列顺序为“谷氨酸-天冬酰胺-赖氨酸-脯氨酸-丙氨酸-丙氨酸-脯氨酸-赖氨酸(ENKPAAPK)”。经NCBI nr数据库对比分析,发现菌株LP1-4细菌素氨基酸序列与数据库中肽链相似最高分值仅为27.8,表明菌株LP1-4细菌素肽链属于新型肽段[30]。
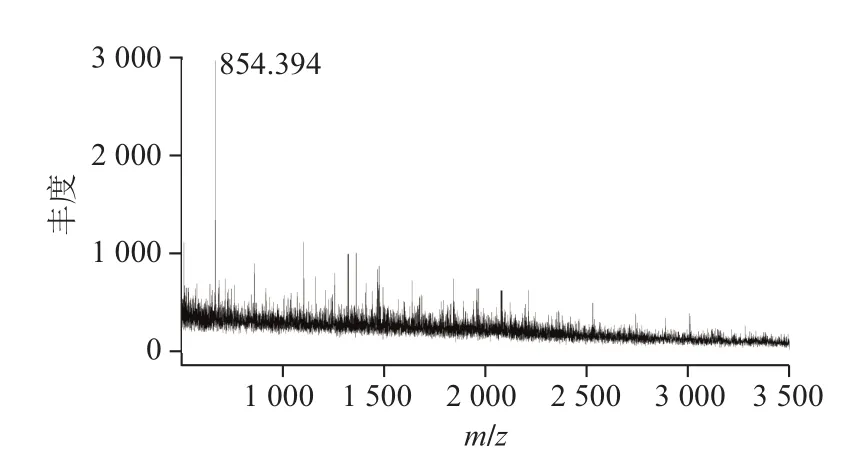
图8 菌株LP1-4细菌素质谱图Fig. 8 Mass spectrum of bacteriocin produced by strain LP1-4
3 结 论
本研究广谱拮抗活性乳酸菌菌株分离、筛选自大菱鲆肠道中,经生理生化反应和16S rRNA鉴定菌株LP1-4为植物乳杆菌(L. plantarum)。菌株LP1-4抑菌活性物对蛋白类敏感,对酸性环境具有一定耐受性,且具有良好的热稳定性。经分离纯化和质谱分析表明其细菌素分子质量为0.854 ku,由5 种氨基酸组成的8 个氨基酸序列,肽链中氨基酸的排列顺序为“谷氨酸-天冬酰胺-赖氨酸-脯氨酸-丙氨酸-丙氨酸-脯氨酸-赖氨酸(ENKPAAPK)”。本研究从海水养殖大菱鲆肠道中筛选具有广谱抑菌活性的乳酸菌菌株,利用该菌株资源研发一种生物防腐剂控制水产食品腐败变质具有一定的应用价值。

