基于Illumina HiSeq 技术分析浆水中细菌多样性及理化性质
魏本良,刘长根,肖阳生,彭 珍,黄 涛,关倩倩,熊 涛,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330031)
浆水是我国四川北部、甘肃、陕西等西北地区极具地方特色的一种传统发酵蔬菜食品。一般将芹菜、圆白菜、萝卜等蔬菜加入面汤或米汤经多种微生物发酵而成[1]。发酵制成的浆水呈淡白色、微酸,可直接饮用,清香酸醇、消暑解渴,亦可作为酸味调味品,与原料烹制成菜食用,风味独特、营养丰富。此外,浆水还具有提神醒脑、健胃消食、维持肠道菌群平衡等作用[2-3]。发酵后的浆水富含多种益生菌、VC、有机酸、硫氨基酸以及其他容易被人体消化吸收的营养物质[4]。这些营养物质可以提高钙和铁的吸收,降低肠道pH值从而使有害微生物的生长受到抑制,同时还有调节人体酸碱平衡等功能[5]。
目前,浆水的主要研究集中在微生物的分离与鉴定[3,6-7]、发酵过程中亚硝酸盐的控制[8-9]、发酵工艺的优化[10-11]以及浆水中有机物动态变化[12-13]等方面,而对我国各个地区浆水中微生物多样性少有报道。虽然李雪萍等[14]通过传统的生理生化方法结合16S rRNA以及18S rRNA测序技术对所分离菌种进行鉴定并分析其多样性,但这种方法不仅耗时耗力,还有大量不可培养的微生物无法分离且不能对分离物进行精确鉴定,无法全面评价浆水微生物群落多样性。近年来,高通量测序以其速率快、准确定量、实时检测等特点[15-16],已广泛应用到各领域中[17]。周书楠等[18]以湖北地区的琚湾酸浆面浆水作为研究对象,使用MiSeq高通量测序技术对细菌菌群构成进行研究。张晓辉等[19]通过高通量测序分析西安、天水两地浆水中细菌多样性,但样本量少,不能全面反映浆水的微生物群落结构,且没有分析其理化性质及其短链脂肪酸。因此,传统浆水发源地陕西和甘肃两省的浆水细菌多样性缺乏全面分析,浆水理化性质及其与样品群落分布之间的相关性鲜有报道。
为此,本实验采用Illumina HiSeq技术对陕西、甘肃各地区的浆水中细菌多样性进行测序分析,研究各地浆水菌群结构的异同,同时对各地浆水理化性质进行测定,建立环境因子与样品群落分布之间的相关性,为今后浆水研究提供一定理论基础。
1 材料与方法
1.1 材料与试剂
实验材料分别为取自陕西省西安市、安康市、汉中市和甘肃省兰州市、平凉市、陇南市的6 份浆水,编号分别为XA、AK、HZ、LZ、PL、LN。在浆水风味最佳阶段时取样,装于低温无菌容器中,迅速运回实验室进行后续处理。
蔗糖、葡萄糖、果糖、草酸、柠檬酸、苹果酸、乳酸、甲酸、乙酸、丙酸、丁酸(均为色谱纯)北京索莱宝公司;亚铁氰化钾(K4Fe(CN)6·3H2O)、乙酸锌(Zn(CH3COO)2·2H2O)、冰乙酸、硼砂(Na2B4O7·10H2O)、对氨基苯磺酸、盐酸萘乙二胺(C12H14N2·2HCl)、亚硝酸钠、氯化钠 西陇化工股份有限公司。
1.2 仪器与设备
PHS-25C精密pH计、752s紫外-可见分光光度计上海精密仪器有限公司;LDZX-40 II立式压力蒸汽灭菌锅上海博讯实业有限公司医疗设厂;2720 Thermal Cycle聚合酶链式反应(polymerase chain reaction,PCR)仪美国应用生物系统公司;CJ-1680超净工作台 江苏太仓市实验设备厂;1260型高效液相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 糖类和有机酸测定
浆水液处理:取1 mL发酵液置于离心管中,12 000 r/min离心10 min,取上清液并用0.22 μm微孔滤膜过滤后备用。
色谱条件:以0.006 mol/L硫酸为流动相,流速0.5 mL/min,进样量20 μL,柱温50 ℃,紫外检测器检测波长205 nm。以保留时间定性,采用外标法定量,以峰面积绘制标准曲线。
1.3.2 亚硝酸盐含量测定
参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》[20]中的盐酸萘乙二胺法测定。
研究方法主要是采用灰色关联分析法和结构变动度分析法。其中,灰色关联分析法是衡量因素间关联程度的重要方法之一,在一定程度上可以反映各影响因素与住院次均费用之间关系的紧密程度;结构变动度分析法能够综合表达住院费用内部结构的构成变化,反映医疗费用结构变化的总体特征[2, 3]。
1.3.3 细菌总DNA提取及多样性分析
采用生工生物工程(上海)股份有限公司试剂盒提取,委托北京诺禾致源科技股份有限公司进行Illumina HiSeq测序平台进行测序,并使用其售后工具平台进行多样性分析。
1.4 数据处理
理化性质、糖类、有机酸数据均重复测定3 次,使用SPSS 22.0软件对数据进行统计学处理,所有数据以表示,并使用Origin 8.0作图。
2 结果与分析
2.1 浆水基本理化性质
如表1所示,浆水盐度(以氯化钠质量分数计,下同)介于0.09%~0.34%之间,均值为0.23%;pH值介于3.32~4.00之间,均值为3.67;酸度介于0.194~0.872 g/L之间,均值为0.4 9 4 g/L;亚硝酸盐含量介于5.123~10.246 mg/kg之间,均值为8.109 mg/kg,均低于我国酱腌菜卫生标准规定的亚硝酸盐最高含量(20 mg/kg)[21]。
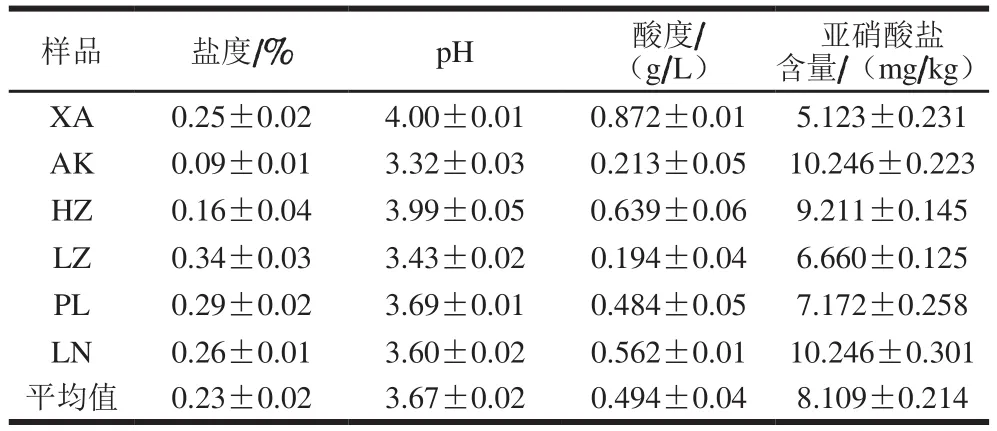
表1 浆水样品理化性质Table 1 Physicochemical parameters of Jiangshui samples
2.2 浆水糖类和酸类含量
如表2、3所示,不同浆水中糖类和有机酸含量差异较大,但整体而言,乳酸在各浆水液中含量最高,其次是乙酸,说明浆水液中主要有机酸为乳酸和乙酸。

表2 浆水样品液中糖类含量Table 2 The contents of carbohydrates in samples mg/mL
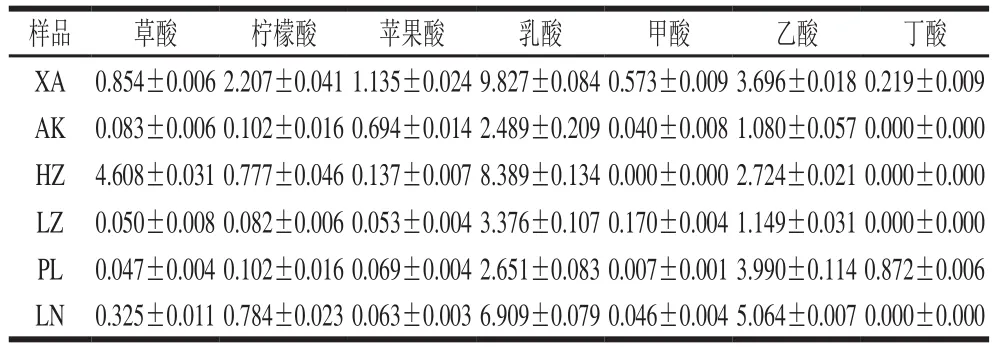
表3 浆水样品液中酸类含量Table 3 Contents of organic acids in Jiangshui samples mg/mL
2.3 细菌多样性分析
如图1所示,曲线在序列数为48 166 条后趋向平坦,说明测序已包含绝大多数样本信息。此外,覆盖率越高,数值越高。由表4可知,6 个浆水样品的覆盖率均大于0.998,说明样本中序列没有被测出的概率极低。综上,此次测序数据量合理,测序深度已基本覆盖样品中所有细菌。

图1 稀释曲线Fig. 1 Rarefaction curve
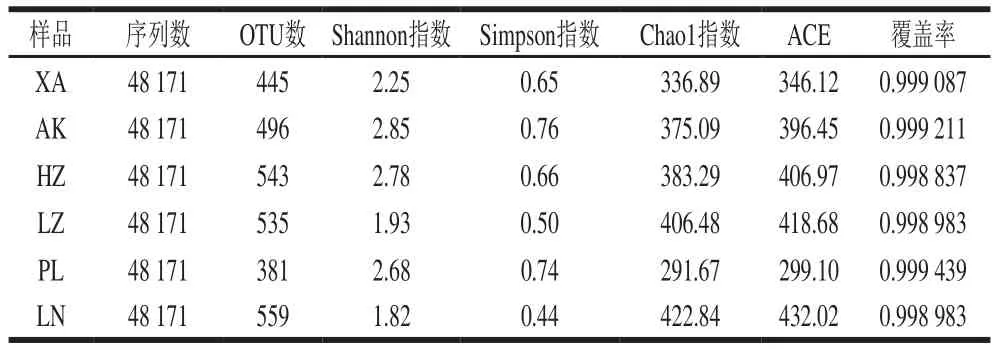
表4 浆水样品中细菌Alpha多样性Table 4 Alpha diversity of bacteria in Jiangshui samples
2.3.1 Alpha多样性分析
经Illumina HiSeq测序平台得到的下机数据(raw data),然后进行拼接和质控,得到clean tags,再进行嵌合体过滤,6 个样品共得到289 026 条可用于后续分析的有效数据(effective tags)。对所有样品的effective tags进行聚类,以97%的一致性将序列聚类成为OTU(operational taxonomic units)。如表4所示,6 个浆水样品共产生936 条不同OTU,其中LN样品中OTU最多,为559 条,PL样品中OTU最少,为381 条。OTU数量越多,代表样品中细菌物种越多,反之,则越少。本研究共获得细菌群落3 界、23 门、59 纲、82 目、157 科、207 属。

图2 Rank abundance曲线Fig. 2 Rank abundance plot
2.3.2 Venn图分析

图3 OTU韦恩图Fig. 3 Venn chart of OTU comparison among six samples collected from Shanxi and Gansu province
Venn图可以展示多样品共有和各自特有OTU数目,直观展示样品间OTU的重叠情况[27]。由前述可知,6 个样品共产生了936 条OTU,由图3A可直观看出,6 个样品共同拥有的OTU数达128 条,约占各样品OTU数量的22.9%~33.6%,说明各样品间有较多的相似微生物。而各样品又含有不同于其他样品的独有OTU,HZ独有OTU数量最多,达60 条,PL最少,只有28 条,其余样品,AK有34 条,XA有44 条,LZ有40 条,LN有49 条。如图3B所示,从不同省份来看,以XA、AK、HZ为代表的陕西省组与以LZ、PL、LN为代表的甘肃组OTU相比,两者共有OUT数量达到507 条,占总数的54.2%,而陕西独有183 条,甘肃为154 条。因此,从整体来看,陕西、甘肃两地浆水样品中微生物群落结构组成相似,相似度达54.2%,但因地区、环境、制作方法等差异,不同浆水样品中均含有独特的微生物群落。
2.4 细菌群落分析
2.4.1 门水平的优势菌群分析

图4 样品中门水平微生物群落结构及分布Fig. 4 Bacterial community structure and distribution of the samples at the phylum level
如图4所示,浆水样品中微生物群落在门分类水平上具有较高的多样性,在15~19 个门之间,其中相对丰度占比排名前10的为厚壁菌门(Firmicutes,94.68%)、变形菌门(Proteobacteria,2.96%)、放线细菌门(Actinobacteria,0.87%)、蓝藻门(Cyanobacteria,0.71%)、酸杆菌门(Acidobacteria,0.38%)、绿弯菌门(Chlorof l exi,0.11%)、硝化螺旋菌门(Nitrospirae,0.06%)、芽单胞菌门(Gemmatimonadetes,0.05%)、拟杆菌门(Bacteroidetes,0.03%)、疣微菌门(Verrucomicrobia,0.02%)。本实验自定义相对丰度不小于10%的为优势菌群。据此,厚壁菌门占绝对主导地位,相对丰度占各样品比例为87.74%~96.99%,相对丰度高低依次为LZ、AK、XA、LN、HZ、PL。总体而言,厚壁菌门占总相对丰度的94.68%,说明6 个浆水样品在属分类水平上群落结构多样性相近,优势菌群均为厚壁菌门。值得注意的是,变形菌门在PL样品中相对丰度比例高于其他样品,为10.23%,说明变形菌门在PL样品中属于主要菌群,而其余样品中变形菌门相对丰度比例均小于2%。
2.4.2 属水平的优势菌群分析
如图5所示,浆水样品中微生物群落在属分类水平上有110~133 个属,具有较高的多样性。其中相对丰度占比排名前10的为乳杆菌属(Lactobacillus,82.59%)、片球菌属(Pediococcus,10.46%)、醋酸杆菌属(Acetobacter,1.63%)、明串珠菌属(Leuconostoc,0.82%)、未知属(unidentified,0.71%)、链球菌属(Streptococcus,0.25%)、芽孢杆菌属(Bacillus,0.21%)、魏氏菌属(Weissella,0.19%)、涅斯捷连科氏菌属(Nesterenkonia,0.11%)、沙雷氏菌属(Serratia,0.1%)。在XA、AK、LZ、PL、LN样品中,乳酸杆菌属占主导地位,相对丰度为86.71%~95.32%,为优势菌属,乳酸杆菌相对丰度所占比例高低依次为LZ、LN、XA、AK、PL、HZ;在HZ样品中,片球菌属相对丰度为57.34%,乳酸杆菌属为30.89%,说明在HZ浆水样品中,优势菌群为片球菌属和乳酸杆菌属,明串珠菌属相对丰度也相对较高,为4.58%。应注意的是,醋酸杆菌属在PL样品中相对丰度相对较高,为9.23%,说明醋酸杆菌属在PL浆水发酵过程中起相对重要的作用。

图5 样品中属水平微生物群落结构及分布Fig. 5 Bacterial community structure and distribution of the samples at the genus level
2.4.3 种水平的优势菌群分析
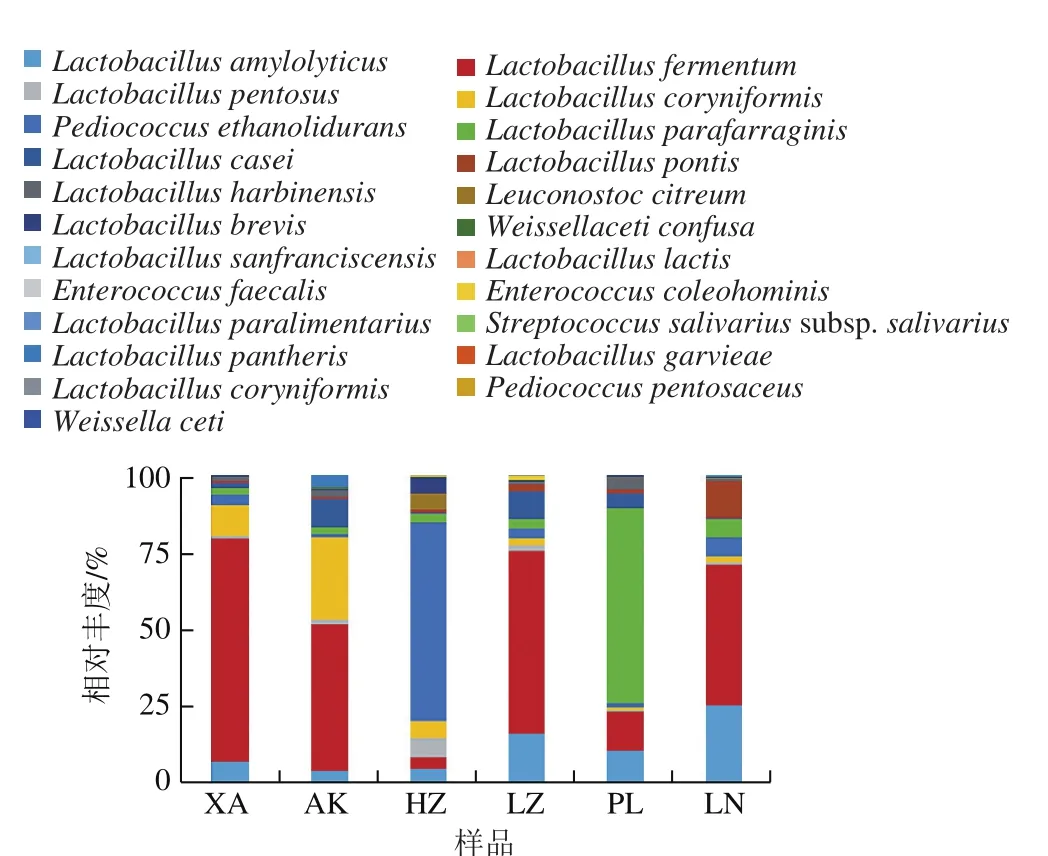
图6 样品中种水平微生物群落结构及分布Fig. 6 Bacterial community structure and distribution of the samples at the species level
如图6所示,6 个浆水样品共鉴定出23 种乳酸菌种,相对丰度大于1%的为发酵乳杆菌(Lactobacillus fermentum,33.39%)、乙醇片球菌(Pediococcus ethanolidurans,21.13%)、Lactobacillus parafarraginis(13.28%)、棒状乳杆菌(Lactobacillus coryniformis,9.18%)、分解淀粉乳杆菌(Lactobacillus amylolyticus,8.39%)、干酪乳杆菌(Lactobacillus casei,3.91%)、戊糖乳杆菌(Lactobacillus pentosus,2.45%)、Lactobacillus pontis(1.84%)、柠檬明串球菌(Leuconostoc citreum,1.67%)、短乳杆菌(Lactobacillus brevis,1.64%)、哈尔滨乳杆菌(Lactobacillus harbinensis,1.5%)。XA样品中优势菌株为发酵乳杆菌(72.48%)和棒状乳杆菌(10.00%),AK样品中优势菌株为发酵乳杆菌(47.53%)和棒状乳杆菌(27.00%),HZ样品中优势菌株为乙醇片球菌(64.32%),LZ样品优势菌株为发酵乳杆菌(59.30%)和分解淀粉乳杆菌(15.83%),PL样品中优势菌株为Lactobacillus parafarraginis(63.17%)、发酵乳杆菌(13.01%)和分解淀粉乳杆菌(10.29%),LN样品中优势菌株为发酵乳杆菌(45.71%)、分解淀粉乳杆菌(25.22%)和Lactobacillus pontis(12.08%)。根据上述结果显示,就总体而言,浆水中主要的优势菌株为发酵乳杆菌、乙醇片球菌和Lactobacillus parafarraginis。
2.4.4 浆水细菌多样性种类异同分析
根据所有样品在属水平的物种注释及丰度信息,选取丰度排名前35的属,根据其在每个样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成热图,各样品横向比较便于发现哪些物种在哪些样品中聚集较多或含量较低。由图7可知,每份样品均含有相对于其他样品含量更高的菌属:XA样品中的Asaia、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)、Pseudarthrobacter、柠檬酸杆菌属(Citrobacter)、热酸菌属(Acidothermus)、棒状杆菌属(Corynebacterium),AK样品中的副球菌属(Paracoccus)、链球菌属(Streptococcus)、魏氏菌属(Weissella)、不动菌属(Acinetobacter),HZ样品中的明串菌属(Leuconostoc)、片球菌属(Pediococcus),LZ样品中的芽孢杆菌属(Bacillus)、芽孢八叠球菌属(Sporosarcina)、Candidatus_Solibacter,PL样品中的葡糖醋杆菌属(Gluconacetobacter)、涅斯捷连科氏菌属(Nesterenkonia)、醋酸杆菌属(Acetobacter)、沙雷氏菌属(Serratia),LN样品中的Candidatus_Alysiosphaera、根瘤菌属(Bradyrhizobium)和土微菌属(Pedomicrobium)。值得注意的是,沙雷氏菌属是条件致病菌,在PL样品中的含量高于其他样品,其食用安全性较其他样品更低。由此可见,不同地区浆水样品的主要微生物菌群各不相同,差异较大,推测可能与地域、发酵蔬菜和制作方法有关。
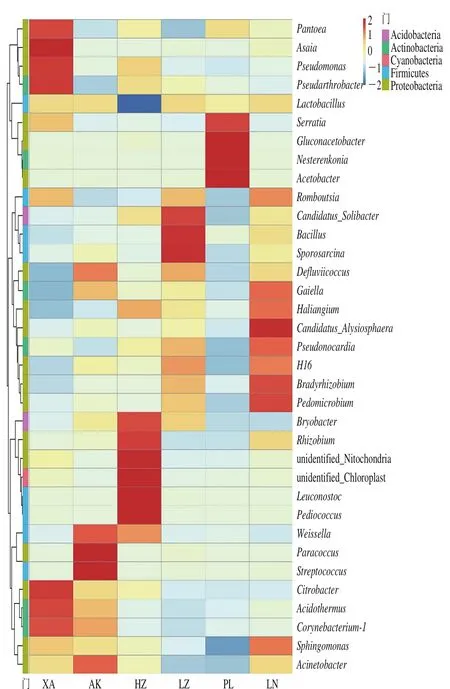
图7 属水平物种丰度聚类热图Fig. 7 Heatmap at the genus level
2.4.5 样品与环境因子相关性分析
典型相关分析(canonical correlation analysis,CCA)主要反映菌群与环境因子之间的关系,可以检测环境因子、样品、菌群三者之间的关系或者两两之间的关系,可得到影响样品群落分布的重要环境驱动因子。在种水平下分析样品与环境因子的相关性,如图8所示。排序轴CCA1贡献率为47.99%,排序轴CCA2贡献率为41.56%。环境因子箭头连线的长度代表环境因子与群落分布和种类分布之间相关程度的大小,箭头越长,说明相关性越大,反之越小。由矢量箭头长度可知,环境因子与群落分布的相关性大小依次为亚硝酸盐含量、pH值、盐度、酸度,且HZ样品群落分布受pH值和酸度的影响较大,PL样品群落分布受亚硝酸盐含量和盐度影响较大,其余样品群落分布受此4 种环境因子影响较小。环境因子之间的夹角代表2 个环境因子之间相关关系,酸度与pH值、盐度与亚硝酸盐含量之间夹角小于90°,呈正相关关系,酸度与pH值之间夹角小于盐度与亚硝酸盐含量之间夹角,说明前者的相关性要强于后者;盐度与酸度、盐度与pH值、亚硝酸盐含量与pH值、亚硝酸盐含量与酸度之间的夹角大于90°,呈负相关关系。

图8 样品与环境因子的CCAFig. 8 CCA between environmental factors and samples
3 讨 论
本研究对采自陕西、甘肃两省6 个不同地区的浆水样品中的细菌采用16S rRNA的V3~V4区扩增后测序,并从门、属、种3 个不同水平进行菌群分析。分析结果显示,6 个样品均呈现较丰富的物种多样性,菌群结构组成相似。在门分类水平上,厚壁菌门占绝对主导地位,相对丰度达94.68%,是浆水样品中的优势菌群。在属分类水平上,乳酸杆菌属相对丰度占总体的82.59%,占主导地位。据此前研究报道[18-19],西北浆水和湖北琚湾酸浆面浆水主要菌群均为乳杆菌属,本研究结果与此研究结果相符,尤其是在XA、AK、LZ、PL、LN样品中,相对丰度达86.71%~95.32%,占绝对优势。值得注意的是,在HZ浆水样品中,优势菌群为片球菌属和乳酸杆菌属,相对丰度分别为57.34%和30.89%。在现有报道中,盛海圆[28]从市售泡菜中分离得到过片球菌属,赵楠[29]研究表明老泡菜卤中的优势菌群为乳杆菌属和片球菌属,但未见过从浆水中分离得到片球菌属的报道。本研究中5 份浆水的细菌多样性分析表明,西北地区浆水主要优势菌群是乳酸杆菌,仅HZ样品中优势菌为片球菌属和乳杆菌属,片球菌属作为浆水中的主要菌群也属首次发现。此结果的可能原因与气候、发酵蔬菜、不同家庭制作方法的差异有关。在种水平上,6 份浆水以发酵乳杆菌、乙醇片球菌和Lactobacillus parafarraginis为优势菌种,相对丰度分别为33.39%、21.13%、13.28%。由此可见,浆水样品中细菌在不同分类水平上均表现出较高的多样性,不同地区的浆水中优势菌群和相对丰度也各不相同,细菌多样性异同分析结果也验证这一结论,推测可能与地域、发酵蔬菜和制作方法的不同有关。
赵楠[29]研究结果表明,作为我国典型传统发酵蔬菜的四川泡菜,其pH平均值为3.73,盐度平均值为7.02%,在本研究中,6 份浆水样品的pH平均值为3.67,平均盐度为0.23%。两者在pH值上非常相近,但盐度却相差非常大,老卤制作的四川泡菜盐度约为浆水盐度的30 倍。造成此结果的原因是四川泡菜在制作过程中一般会添加6%~8%食盐[30],而在制作浆水过程中少有添加。四川泡菜和西北浆水盐度的不同影响着两者的菌群结构,四川泡菜菌群结构主要由乳杆菌属(62.67%)、片球菌属(14.45%)、肠膜菌属(7.77%)、乳球菌属(4.65%)组成[29],而浆水菌群结构主要由乳杆菌属(82.59%)、片球菌属(10.46%)、醋酸杆菌属(1.63%)、明串珠菌属(0.82%)组成,两者的主要菌属相似,但相对丰度相差明显。由此推测,盐度与菌群结构可能存在着一定的联系,后续可对此进一步研究。
对于浆水中糖类和有机酸含量的测定结果推断,浆水中发酵乳杆菌占主导地位,利用蔗糖、葡萄糖、果糖等可发酵糖进行异型发酵,代谢产生大量乳酸和较大量乙酸,导致浆水液中乳酸和乙酸含量高于其他有机酸。值得注意的是,在HZ样品中草酸含量较高,可能原因是其浆水菜中含有较多草酸,在发酵过程中细胞破裂,草酸释放出来,导致出现草酸含量较高的情况。本研究共测定7 种有机酸和3 种可发酵糖,可评价浆水的营养价值,但所测数据较少,在后续的研究中应增加测定种类。
4 结 论
以陕西、甘肃6 个不同地区浆水样品为研究对象,通过Illumina HiSeq测序分析浆水样品中细菌多样性,结果表明浆水样品均具有较高的细菌多样性,且各地样品菌群结构组成相似,乳酸杆菌属占主导地位,其中优势菌株为发酵乳杆菌、乙醇片球菌和Lactobacillus parafarraginis;浆水液平均盐度为0.23%,平均pH值为3.67,平均酸度为0.494 g/L,平均亚硝酸盐含量为8.109 mg/kg,各样品亚硝酸盐含量均低于我国酱腌菜卫生标准;环境因子对样品分布影响大小依次为亚硝酸盐含量>pH值>盐度>酸度;浆水液中蔗糖、葡萄糖、果糖含量较少,乳酸含量最多,且含有甲酸、乙酸、丙酸、丁酸等短链脂肪酸。本研究系统解析陕西、甘肃不同地区浆水中细菌结构分布,并测定其理化指标,探究环境因子与样品群落分布之间的相关性,加强传统发酵食品基础理论研究,为后续研究提供一定指导意义。

