高产纤维素酶突变株的筛选及其产酶条件优化
邹宗胜,王婧雅,赵运英,毛 银,邓 禹*
(江南大学 粮食发酵工艺与技术国家工程实验室,生物工程学院,江苏 无锡 214122)
纤维素酶是能够分解纤维素生成葡萄糖的复合酶的总称,可以用于动物饲料、食品、纺织品、洗涤剂和纸张的制造中[1-2]。在食品工业中,纤维素酶可广泛用于果汁和蔬菜汁的澄清、果汁和果泥的生产以及橄榄油的提取等[3]。而在饲料加工过程中,纤维素酶则可降低粗纤维的含量从而提高牧草的品质[4]。
目前,研究较多的产纤维素酶菌种主要为曲霉(Aspergillus sp.)、青霉(Penicillium sp.)、木霉(Trichoderma sp.)和腐质霉(Humicola sp.)等真菌[5]。由于真菌酶系发达,产酶效率高,且所产的纤维素酶组成丰富、结构合理,最终使得纤维素酶活力较高;同时由于真菌产纤维素酶易于分离提取[6],因此也易于生产放大。在这其中,里氏木霉研究最多,应用最广,里氏木霉是获得美国食品药品监督管理局认证的安全无害菌株,它分泌的纤维素酶稳定性好、结构合理、且易于分离纯化[7]。陆晨等[8]用里氏木霉RUT-C30进行上罐发酵,96 h时纤维素酶活最高,达到3.46 IU/mL。
常压室温等离子体诱变(atmospheric room temperature plasma mutation system,ARTP)是一种新型的诱变技术。等离子体可较易产生,并在室温和大气压下破坏DNA链,导致染色体断裂、重排、缺失并具有DNA损伤修复抑制。因其具有安全、成本低、操作灵活、突变谱高和突变率高等优异特性而在微生物诱变育种领域得到广泛应用[9-10]。
本实验以里氏木霉RUT-C30为出发菌株,利用ARTP筛选高产纤维素酶突变菌株,并通过全基因测序分析其突变类型。最后,通过优化发酵条件来提高纤维素酶产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
里氏木霉RUT-C30购自广东微生物菌种保藏中心,菌种保藏编号:GIM 3.536。
刚果红染料 生工生物工程(上海)股份有限公司;玉米浆 上海源叶生物科技有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na) 上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯国药集团化学试剂有限公司。
1.1.2 培养基
PDA培养基:土豆200 g/L,葡萄糖20 g/L,琼脂20 g/L。
初筛培养基:CMC-Na 10 g/L,乳糖3 g/L,(NH4)2SO42 g/L,MgSO4·7H2O 0.5 g/L,K2HPO41.0 g/L,刚果红0.2 g/L,琼脂粉20 g/L。
种子培养基:葡萄糖15 g/L,酵母浸膏20 g/L,(NH4)2SO42.5 g/L,KH2PO46 g/L,MgSO40.8 g/L,CaCl21.0 g/L,Mandels微量元素营养盐1 mL/L[10],吐温80 2 mL/L,pH 4.8。
发酵培养基:乳糖18 g/L,微晶纤维素10 g/L,玉米桨粉12 g/L,(NH4)2SO40.5 g/L,MgSO41 g/L,CaCl20.5 g/L,Mandels微量元素营养盐1 mL/L[11],吐温80 2 mL/L,pH 4.8。
1.2 仪器与设备
Artp-iis ARTP诱变系统 无锡源清天木生物科技有限公司;SW-CJ-1D无菌操作台 苏州净化设备有限公司;MJX-100B-Z霉菌培养箱 上海博讯实业有限公司;BIOTECH-5BG-7000A 5 L发酵罐 上海保兴生物设备工程有限公司;EPOCH2T酶标仪 美国BioTek公司;LEGEND MICRO 17离心机 赛默飞世尔科技公司;Chromaster高效液相色谱仪 日本Hitachi公司。
1.3 方法
1.3.1 菌株的培养
将PDA斜面保存的里氏木霉RUT-C30孢子用无菌水洗下,无菌条件下接种于种子培养基,200 r/min、30 ℃培养3 d。
5 L发酵罐放大培养:装液量3 L,接种量10%,通气量1 L/(L·min),搅拌转速200 r/min,pH 5.0,发酵周期为6 d,自接种起每12 h取一次样测定干质量、滤纸酶活以及发酵液中的乳糖含量。
1.3.2 诱变致死率曲线及正突变率曲线
将斜面上洗下的新鲜孢子用无菌水稀释至107~108个/mL,取0.01 mL菌液均匀地涂在金属载片上。把装有样品的金属载片平板放到ARTP诱变系统操作室里,照射距离2 mm,逐渐延长诱变时间(0、40、60、80、100、120、140、160、180、200、220、240、260 s)进行实验[12]。诱变结束后,用无菌镊子把金属载片移至装有1 mL无菌水的EP管里,迅速振荡均匀制成新的孢子悬液。将诱变后的孢子悬液适当稀释后均匀涂布于营养丰富的种子培养基中,30 ℃恒温恒湿培养4 d后记录下各平板的菌落数,并根据稀释倍数计算诱变致死率,如式(1)所示:

正突变率:相同的稀释梯度下,将适当稀释的里氏木霉RUT-C30孢子和经不同诱变剂量处理后的孢子均匀涂布于初筛平板中。30 ℃培养4 d后计数并分别测量每个菌落的水解圈与菌落直径。以对照组菌落(未经诱变)的水解圈与菌落直径的比值(H/C)为标准,当突变株H/C大于对照组H/C的最大值时记为正突变,小于对照组H/C的最小值时记为负突变。正突变率计算如式(2)所示:

1.3.3 里氏木霉RUT-C30的ARTP诱变及高产菌株的筛选
在一定的诱变处理时间条件下对里氏木霉RUT-C30进行诱变操作。将诱变得到的孢子适当稀释涂布于CMC-Na刚果红平板上,30 ℃培养4 d后根据水解圈(H/C值)的大小,选择合适的单菌落,挑取孢子接种于发酵培养基摇瓶培养5 d,并以总酶活作为高产菌株的选择依据。
1.3.4 菌体干质量的测定
取洁净的定量滤纸置于烘箱中45 ℃烘干至质量恒定后于分析天平内记为M1。每次取10 mL发酵样品用布氏漏斗抽滤,菌丝用去离子水冲洗两遍,将该滤纸置于45 ℃烘箱中烘干48 h后于分析天平内称质量记为M2[13]。另取10 mL的发酵液,6 000 r/min离心5 min去上清液,加入3 mL硝酸和醋酸的混合溶液重悬(15 mL纯硝酸与150 mL 80%的醋酸的混合溶液)。沸水浴30 min后4 000 r/min离心2 min去上清液,沉淀用去离子水清洗3 遍后45 ℃烘干至质量恒定并称质量记为M3[14]。根据式(3)计算10 mL发酵液中的菌丝干质量M:

1.3.5 高产纤维素酶突变株的全基因组测序
高产纤维素酶突变株JNDY-13的测序工作由生工生物工程(上海)股份有限公司完成,采用Illumina Genome Analyzer(HiSeq 2500)系统,测序步骤如Ivanova等[15]所述。研究分析了两个独立样本,基因组序列已上传至SRA,编号为:SRP124905。
1.3.6 纤维素酶活力活测定
以滤纸(Whatman Filter Paper No. 1)作为底物测定纤维素酶总活力:将1 cm×6 cm(50 mg)大小的滤纸条置于装有1 mL柠檬酸缓冲液(50 mmol/L,pH 4.8)的试管中作为反应底物,然后加入500 μL经过适当稀释的发酵上清液,空白对照对应加入500 μL柠檬酸缓冲液(50 mmol/L,pH 4.8)。将试管置于恒温振荡水浴锅中,50 ℃反应1 h,立即加入3 mL 3,5-二硝基水杨酸溶液沸水浴5 min,迅速冷却至室温,加入20 mL去离子水,混合均匀后测定540 nm波长处的吸光度[16]。发酵培养基中的残留乳糖通过高效液相色谱测定:Bio-Rad HPX-87P 色谱柱,柱温30 ℃,流动相为5 mmol/L的稀硫酸,检测器为视差检测器[17]。纤维素酶活力单位(IU)定义:1 个酶活力单位是指在50 ℃与pH 4.8 的条件下,每分钟分解产生1 μmol葡萄糖所对应的酶量。
1.3.7 正交试验设计
根据已有的报道[18],设计6因素5水平的正交试验对培养基的组分含量进行优化[19]。按照试验设计分别配制发酵培养基,以10%的接种量转接种子液,30 ℃、200 r/min 摇床培养6 d,每12 h取样测滤纸酶活。采用统计学方法分析实验结果,并以滤纸酶活为标准确定最优培养基配方。
发酵过程,主要对发酵温度、转速以及通气量3 个重要的发酵条件进行优化。首先进行单因素试验,然后设计3因素2水平正交试验,按照试验设计的条件分别进行发酵实验。实验结果采用统计学方法进行分析,并以滤纸酶活为标准确定最优发酵条件。
1.3.8 流加发酵
根据正交试验优化的最佳发酵条件和最优培养基配方进行流加发酵,发酵过程中补加乳糖和(NH4)2SO4的混合溶液(乳糖125 g/L,(NH4)2SO427.5 g/L),补加乳糖的总量不超过50 g/L。
2 结果与分析
2.1 里氏木霉RUT-C30的ARTP诱变
2.1.1 最佳照射时间的确定
将里氏木霉RUT-C30的新鲜孢子经ARTP 诱变照射不同时间后涂布于营养丰富的培养基进行再生培养,根据再生单菌落数计算致死率,结果如图1所示。菌体致死率随照射时间的延长迅速增加,当照射时间为200 s时,菌体致死率达到98%以上,当达到280 s时,无菌体生长。由正突变率曲线可知,当照射时间为240 s时正突变率最高为20.1%,故选择240 s的照射时间进行实验。

图1 ARTP诱变致死率曲线及正突变率曲线Fig. 1 Lethality curve and positive mutation rate curve of ARTP mutagenesis system
2.1.2 高产菌株的初筛及复筛
刚果红是一种染料,它可以与培养基中的纤维素多糖物质结合形成红色复合物,但并不会与纤维二糖、葡萄糖、纤维素酶和纤维素分解菌发生反应[20-21]。根据水解圈的大小从87 株突变株中获得20 株产纤维素酶活力较高的菌株进行摇瓶复筛,由图2可知,菌株JNDY-13的总酶活力(滤纸酶活)可达2.21 IU/mL,为出发菌株里氏木霉RUT-C30的2.21 倍,且该菌产酶经10 次传代仍保持稳定,因此选择JNDY-13进行后续实验。
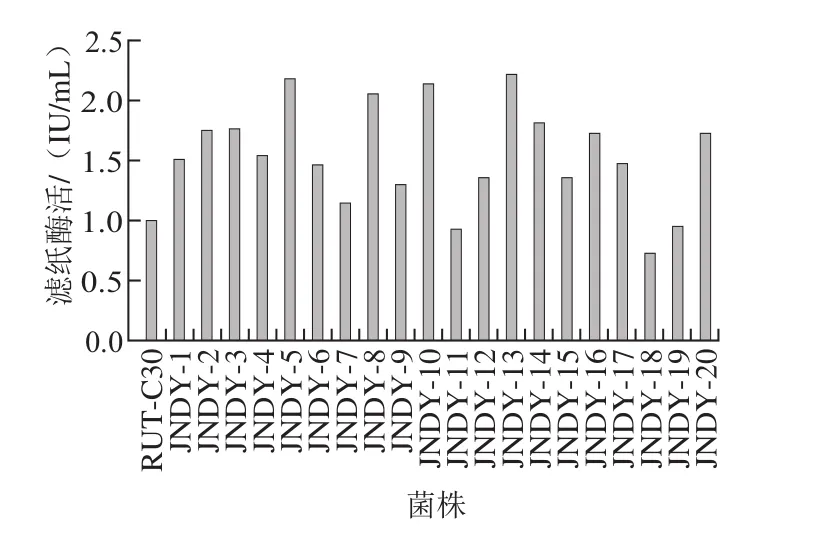
图2 摇瓶复筛结果Fig. 2 Screening results through shake-f l ask fermentation
2.2 高产纤维素酶突变株JNDY-13的突变分析
为研究高产突变株JNDY-13的遗传变化,利用Illumina Genome Analyzer(HiSeq 2500)对其进行高通量基因组测序,并借助MOM算法[22]将Illumina系统产生的序列读数与里氏木霉RUT-C30的参考基因组进行比对。对于JNDY-13,27 934 787 个(占总数的94.69%)单端读数被绘制,且Illumina测序的平均深度为123.747。点突变和其他突变事件结果分析如图3、4所示,在JNDY-13基因序列中鉴定出752 个突变,其中18 个为水解酶类,34 个为合成酶类,20 个为激酶,52 个与能量代谢相关,73 个与物质运输相关,38 个与转录和翻译相关,8 个与生长相关,399 个为假定蛋白,其中110 个与其他功能相关。其中,752 个单核苷酸多态性中的105 个被确认为点突变,336个突变为碱基缺失,165 个为碱基插入,99 个为混合突变。
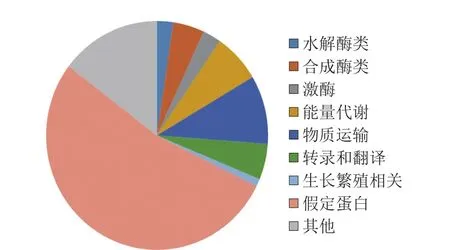
图3 JNDY-13高产菌株中的突变组成Fig. 3 Mutation composition of JNDY-13

图4 JNDY-13高产突变株中突变的类型Fig. 4 Mutation types of JNDY-13
经比对发现,已知相关的纤维素酶类基因(cel2A、cel3A、cel2B、cel3C、cel5A、cel6A、cel7A、cel7B、cel61A)未发生突变,关键的调控因子相关基因(ace1、ace2、cre1、xyr1)亦未发生突变。与跨膜转运和细胞渗透性相关的基因突变可能对纤维素酶的分泌产生复杂的影响,而与转录翻译水平、能量代谢、细胞生长和繁殖密切相关的突变也可能影响纤维素酶的分泌[23],Seiboth等[24]研究发现编码半乳糖激酶基因的缺失虽不会影响半乳糖的代谢和里氏木霉在含乳糖培养基上的生长情况,但其基因缺失将对里氏木霉纤维素酶的产量产生极大影响,这表明半乳糖激酶基因的转录和纤维素酶产量密切相关。在JNDY-13中,半乳糖激酶基因的突变发生在非编码区,其中18 个碱基(GGGTTAAAAAGCGACTCAC)代替半乳糖激酶基因454 bp处的“G”被插入,这可能是其纤维素酶活力发生改变的原因。
2.3 纤维素酶高产菌株的产酶优化
2.3.1 产酶培养基优化
培养基的组分、配比和缓冲能力等都对微生物的生长和产酶具有重要的影响[13]。本研究中,在他人研究的基础上[18],根据筛选获得的高产菌株特性,设计6因素5水平的正交试验(表1)对培养基的组分(乳糖、微晶纤维素、玉米浆、CaCl2、(NH4)2SO4、MgSO4)用量在摇瓶中进行优化,并进行极差分析。
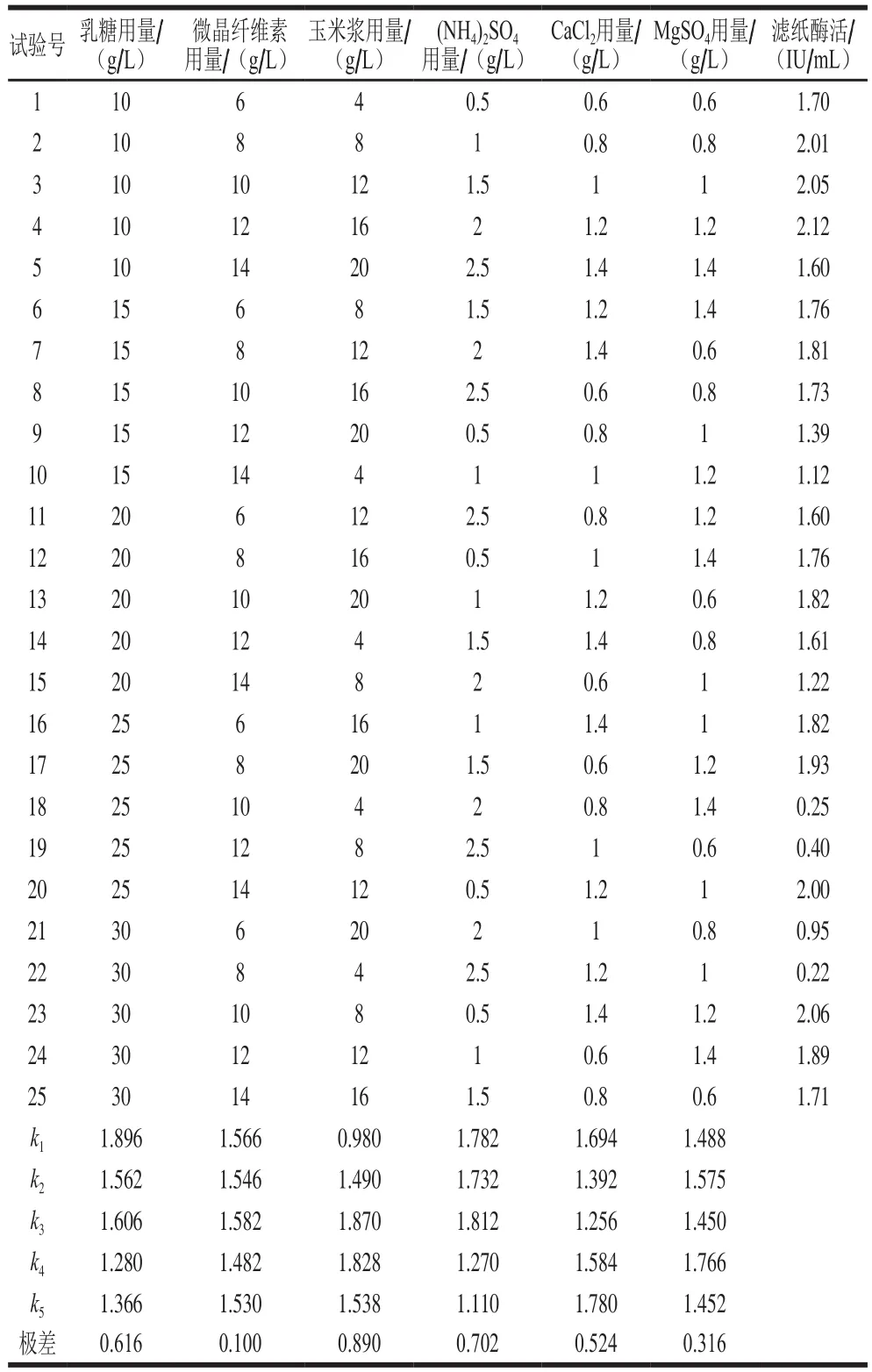
表1 发酵培养基成分正交试验设计与结果Table 1 Orthogonal array design with experimental results for optimization of fermentation medium
正交试验结果表明,6 种培养基组分中玉米浆对产酶的影响最大,(NH4)2SO4次之,再次依次为乳糖、CaCl2、MgSO4和微晶纤维素。优化过的产酶培养基配方为:乳糖10 g/L、微晶纤维素10 g/L、玉米浆粉12 g/L、(NH4)2SO41.5 g/L、MgSO41.2 g/L、CaCl21.4 g/L、Mandels微量元素营养盐1 mL/L、吐温80 2 mL/L,pH 4.8。利用此培养基发酵产酶活力最高可达 2.64 IU/mL,高于原始培养基的产酶活力(2.21 IU/mL)。
2.3.2 5 L罐发酵条件优化
采用上述优化过的培养基,按照以下条件(装液量为3 L,接种量10%,通气量1 L/(L·min),搅拌转速200 r/min,发酵温度28 ℃,pH 5.0)进行实验。首先通过单因素方法研究了对产酶影响较大的因素(通气量、搅拌转速、发酵温度),而后通过正交试验进一步优化发酵参数,并最终利用获得的最优发酵条件对高产菌株JNDY-13进行分批发酵。由于纤维素酶的不同组分分别有不同的最佳产酶pH值,且主要集中在4.0~6.0之间,为保持实验的一致性,本实验中均采用pH 5.0进行研究[25-27]。
2.3.2.1 发酵温度对产酶的影响
温度对微生物的生长具有重要的影响,当发酵温度较低时,菌体生长缓慢;而发酵温度过高时虽菌体生长迅速但产酶量却会偏低[28]。张晓煊等[29]研究发现里氏木霉在28~30 ℃培养可获得较高的滤纸酶活,低于25 ℃或高于33 ℃时酶活力下降比较显著。由于里氏木霉产酶的最佳温度为28 ℃,而该菌株生长的最佳温度为30 ℃[30],因此本实验以滤纸酶活为唯一标准,对发酵温度28 ℃和30 ℃分别进行实验,结果如图5所示。当发酵温度为28 ℃时产酶活力最高,可达4.33 IU/mL,这与文献报道一致[27]。
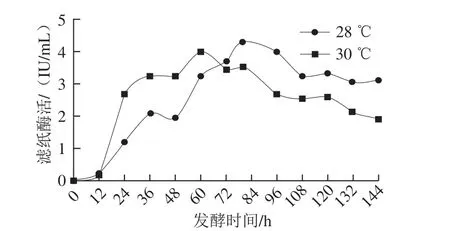
图5 发酵温度对产酶的影响Fig. 5 Cellulase production curves at different fermentation temperatures
2.3.2.2 搅拌转速对产酶的影响
保持其他参数不变,设定不同的搅拌转速,以滤纸酶活为唯一指标对搅拌转速进行优化。实验发现,当初始搅拌转速为600 r/min时,发酵液中的溶氧水平明显增加,发酵前期菌体量迅速增加,至发酵中期时发酵液逐渐变清,表明菌丝大量死亡,且由图6可知,当搅拌转速为600 r/min时最高滤纸酶活仅为1.22 IU/mL,表明搅拌转速太高时,虽然溶氧水平得以提高但是相应的剪切力也大大增加。发酵前期菌丝体强壮,而到了发酵中期时菌丝体老化对剪切力敏感,因此导致菌体大量死亡并使总酶活迅速降低[31]。当搅拌转速为200 r/min时,溶氧自对数期起均处于较低水平,由于菌丝生长缓慢使得到达平台期的时间明显延长而不利于产酶。姜伯玲[32]发现当转速较低时,发酵体系中的溶氧不足,从而影响菌丝体的生长代谢,这与本实验结果相似。而当搅拌转速为400 r/min时,既能基本保证菌体生长所需溶氧,又不会对菌丝造成太大的损伤,使得其最高酶活可达4.51 IU/mL。张素敏[33]对里氏木霉T306进行发酵条件优化时发现当搅拌转速为400 r/min时,既能保证菌株的溶氧需求,又不会显著损伤菌体,本研究中得到的结果与其报道一致。
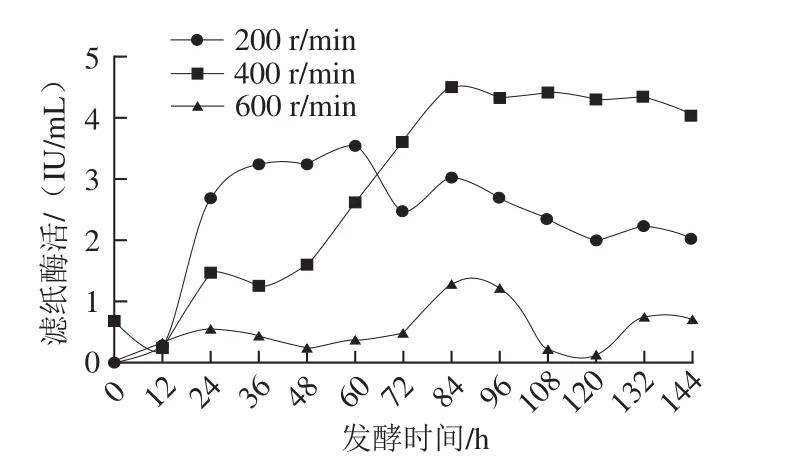
图6 搅拌转速对产酶的影响Fig. 6 Cellulase production curves at different stirring speeds
2.3.2.3 通气量对产酶的影响
溶氧水平对菌体生长和产酶都至关重要,且溶氧水平又与通气量和搅拌转速密切相关[34-35]。在搅拌转速优化的基础上,对通气量进行进一步实验。由图7可知,当通气量为2 L/(L·min)时,最高滤纸酶活可达4.44 IU/mL;而当通气量为1 L/(L·min)时,最高滤纸酶活为3.72 IU/mL。

图7 不同通气量下的发酵产酶曲线Fig. 7 Cellulase production curves at different ventilation fl ow rates
2.3.2.4 正交试验优化发酵条件

表2 发酵条件正交试验设计与结果Table 2 Orthogonal array design with experimental results for optimization of fermentation conditions
根据优化过的产酶培养基以及上述单因素试验结果,设计正交试验(表2)对发酵条件进行优化。结果表明最佳发酵条件为发酵温度28 ℃、搅拌转速400 r/min、通气量2 L/(L·min)、pH值恒定为5.0。发酵温度对产酶影响最大,其次是搅拌转速,再次是通气量。根据发酵培养基成分以及发酵条件优化结果,对里氏木霉JNDY-13进行分批发酵,结果如图8所示,在最优条件下进行分批发酵最高滤纸酶活可达4.74 IU/mL,最高菌体量可达8.91 g/L,且培养基中的乳糖在前36 h即消耗殆尽。
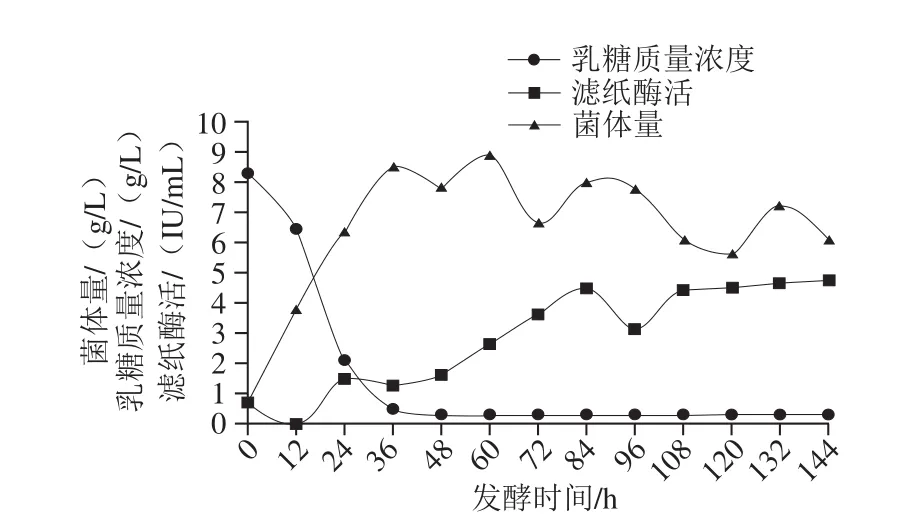
图8 分批发酵结果Fig. 8 Time courses of fed-batch fermentation
2.3.3 流加发酵
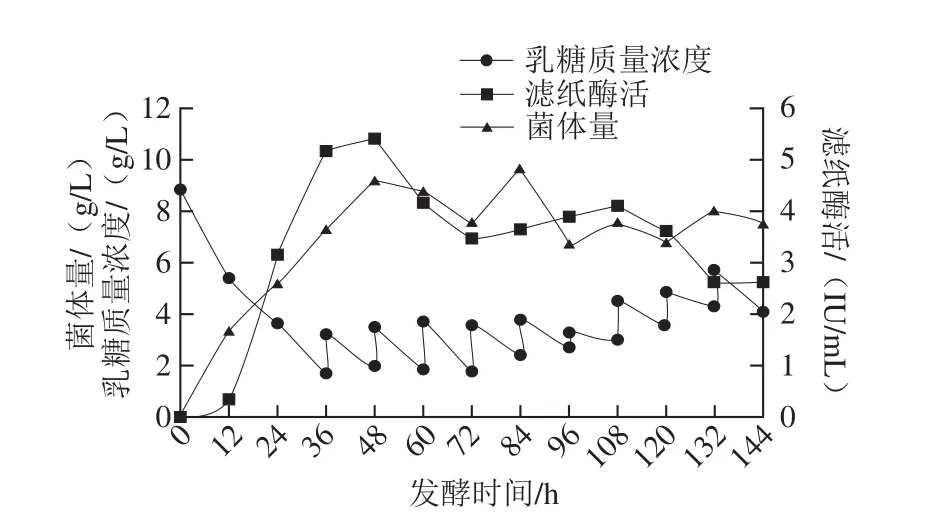
图9 流加发酵产纤维素酶Fig. 9 Production of cellulase through fed-batch fermentation
采用最优条件进行流加发酵,即自36 h起,每12 h流加一次乳糖和(NH4)2SO4的混合溶液(碳氮比10∶1),发酵过程中补充乳糖的总量不超过50 g/L。由图9可知,流加发酵时最高滤纸酶活可达5.40 IU/mL,菌体量最高可达9.19 g/L。将流加发酵结果与分批发酵结果对比发现,二者纤维素酶产量的最高点都集中在发酵前期以及中期,而到发酵中后期产酶量均逐渐下降。这一现象表明本实验获得的最佳发酵条件相对较适合菌体生长与产酶,但仍未达到最佳要求,这可能与发酵中期发酵罐中菌体生长情况和蛋白酶的大量分泌有关。下一步工作中,可筛选蛋白酶分泌水平较低的高产菌株,并对发酵中期发酵罐中的各种因素如溶氧水平、菌体密度、活菌比例、残糖和培养基中蛋白酶活力等进行具体分析,指导进一步的发酵优化。
3 结 论
本实验通过常温室压等离子体技术诱变里氏木霉RUT-C30,成功获得1 株纤维素酶高产菌株JNDY-13,摇瓶初筛其最高滤纸酶活可达2.21 IU/mL,为出发菌株里氏木霉RUT-C30的2.21 倍。
为研究高产突变株JNDY-13的遗传变化,进行全基因组测序。测序结果显示共有752 个突变,其中18 个为水解酶类,34 个为合成酶类,20 个为激酶,52 个与能量代谢相关,73 个与物质运输相关,38 个与转录和翻译相关,8 个与生长相关,399 个为假定蛋白,其中110 个与其他功能相关。发现752 个突变中含有105 个点突变,336 个为碱基缺失,165 个为碱基插入,以及99 个为混合突变。
突变菌株经培养基优化及发酵条件优化,最高酶活可达5.40 IU/mL,菌体量最高可达9.19 g/L,且经10 次传代该菌株依然有较高纤维素酶活力。

