不同架式‘爱神玫瑰’葡萄果实成熟期间单萜积累及相关基因的表达
王慧玲,王晓玥,闫爱玲,孙磊,张国军,任建成,徐海英
不同架式‘爱神玫瑰’葡萄果实成熟期间单萜积累及相关基因的表达
王慧玲1,王晓玥2,闫爱玲3,孙磊1,张国军1,任建成1,徐海英1
(1北京市林业果树科学研究院,北京 100093;2北京市落叶果树工程技术研究中心,北京 100097;3农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100097)
【目的】探讨不同架式对葡萄果实成熟期间单萜类化合物合成的影响,进一步从基因表达水平揭示基因转录与单萜积累的关系,以期为生产中架式选择及葡萄果实香味品质的提高提供一定的理论依据。【方法】以T型和V型架式栽培的‘爱神玫瑰’葡萄果实为试材,于果实成熟初期(花后30 d)开始取样,直至果实完全成熟。连续两年常规方法测定果实样品可溶性固形物及可滴定酸含量,利用顶空固相微萃取结合气相色谱与质谱联用技术(SPEME-GC-MS)测定果实中单萜类组分和含量的变化,采用实时荧光定量PCR技术分析单萜合成途径中关键基因脱氧木酮糖磷酸合酶基因(和)、脱氧木酮糖磷酸还原异构酶基因()、异戊烯基焦磷酸还原酶基因()、里那醇合成酶基因()和萜品醇合成酶基因()的表达变化。【结果】随着果实成熟,可溶性固形物含量逐渐升高,而可滴定酸含量逐渐降低。成熟期的T型架葡萄果实可溶性固形物含量显著高于V型架,可滴定酸含量没有显著差异。2016年和2017年两种架式果实样品中分别检测到27和28种单萜类化合物。检测结果表明不同架式主要萜烯类化合物组分不尽相同,随着果实成熟,主要萜烯类成分也发生变化。成熟时,T型架果实中主要单萜类化合物有里那醇、柠檬烯、α-萜品醇、β-cis-罗勒烯和香叶醇;V型架主要有里那醇、α-萜品醇、柠檬烯、橙花醚和β-cis-罗勒烯等,其中以里那醇含量最高。2016年成熟期T型架果实单萜总量达到108.18 µg∙L-1,是V型架最高含量的1.9倍。而2017年成熟期T型架果实单萜总量达到403.24 µg∙L-1,是V型架最高含量的1.5倍;大多数单萜类化合物含量在成熟时表现为T型架显著高于V型架。在整个果实成熟期间,两种架式葡萄果实单萜类化合物积累表现为两种变化模式,包括里那醇、香叶醇、橙花醇及萜品醇等在内的大部分化合物遵循第一种模式,即在果实成熟时含量达到最高。但是不同架式表现又略微不同,(E,Z)-别罗勒烯、β-cis-罗勒烯、柠檬烯和α-萜品醇等化合物在T型架果实中表现为先下降,花后57 d急剧升高,成熟后期(花后76 d)又下降的趋势。而在V型架果实中这些化合物含量随着果实成熟逐渐上升,花后48 d达到积累高峰,之后又逐渐下降至最低含量。另外,果实成熟期间单萜合成途径基因(、、、、和)表达量随着果实成熟呈上升趋势。不同架式葡萄果实成熟期间单萜总量积累规律与、、和表达规律相似。成熟期T型架果实中各个基因表达量明显高于V型架,与单萜类化合物积累模式相一致。【结论】T型架式栽培更有利于果实单萜类物质的积累,T型架式单萜类化合物的高效积累与其代谢途径多个关键酶基因高效表达密切相关。
葡萄;栽培架式;玫瑰香味;单萜
0 引言
【研究意义】香气是衡量葡萄及葡萄酒品质的重要指标,直接影响消费者的认可程度。特别是玫瑰香型的鲜食葡萄备受消费者喜爱,玫瑰香味育种也一直是葡萄品质研究和育种的重点。萜烯类化合物因具浓郁香味,感官阈值低,是玫瑰香味葡萄的典型香气成分[1]。不同栽培架式结构影响果际微生态条件和叶片的光合作用最终影响葡萄香气积累[2]。‘爱神玫瑰’是极早熟无核鲜食葡萄新品种,具有典型的玫瑰香味[3]。探究不同栽培架式‘爱神玫瑰’葡萄果实发育中单萜化合物的积累模式,结合关键基因表达分析,可为阐明萜类物质的生物合成及调控机制,进而为葡萄香味品质改善和栽培架式的选择提供理论支撑。【前人研究进展】单萜的合成途径已经较为清晰,主要是通过位于质体中的脱氧-木酮糖-5-磷酸/甲基磷酸赤藓糖途径(DXP/MEP)合成[4]。影响果实萜类香气合成积累的因素很多,除了品种基因组成等内因外,还受生长环境及栽培技术措施等外因的影响[5-7]。在各种栽培措施中,栽培架式结构对叶幕类型可以产生最重要的和直接的影响,叶幕结构通过影响光能截留量影响叶际、果际微生态条件和叶片的光合作用,最终影响葡萄的产量和品质[8]。关于架式对葡萄果实品质的影响已有较多的报道,但大多关注可溶性固形物、花色苷、总酚等不可挥发性物质[9-12],对于香气成分研究较少。国内仅有的2篇报道主要研究了‘玫瑰香’葡萄在不同架式下芳香物质含量的变化。赵新节等[13]以7年生棚架和篱架栽培模式下的‘玫瑰香’葡萄为试材,研究发现篱架葡萄成熟后期酯类物质相对含量高于棚架, 而酮醛类物质和萜类物质相对含量低于棚架;商佳胤等[14]研究发现Y型架栽培的‘玫瑰香’葡萄果实中芳香化合物种类和含量都较高,葡萄果实风味优于篱架。而国外研究者主要关注架式对酿酒葡萄及其酿造葡萄酒中香气的影响。Ji和DamI[15]研究发现直立架式栽培的酿酒葡萄‘塔名内’(Traminette)中积累的单萜类化合物特别是香叶醇含量更高。Fragasso等[16]研究了不同整形方式下‘普里米蒂沃’(Primitivo)葡萄及其酿造葡萄酒中挥发性成分的变化。【本研究切入点】目前的研究主要是针对篱架和棚架,且主要在香气物质成分分析层面,其合成调控机制还不清晰。关于不同架式(V型和T型)对鲜食葡萄果实成熟过程中玫瑰香味化合物合成的影响及可能调控机制的研究鲜有报道。【拟解决的关键问题】本研究以T型和V型架式栽培下的‘爱神玫瑰’葡萄果实为试材,探讨两种架式下葡萄成熟期间单萜类化合物积累及其合成途径关键酶基因(、、、、、)的表达模式,以期为适宜架式选择,为进一步提高果实中萜类物质的含量,改善果实玫瑰香味及阐明萜类物质的生物合成和调控机制提供一定的理论依据。
1 材料与方法
试验于2016—2017年在北京市林业果树科学研究院进行。
1.1 试验材料及地点
试验材料为7年生早熟玫瑰香型葡萄‘爱神玫瑰’(cv. Aishen Meigui),定植于北京市平谷区马昌营镇(北纬40°13′,东经117°12′),试验地土壤肥力中等,pH 6.9,有机质含量12.50 g∙kg-1,全氮0.86 g∙kg-1,全磷0.87 g∙kg-1,全钾22.2 g∙kg-1,可溶性盐1.03 g∙kg-1。试验进行年份秋季沟施有机肥(1 t/667 m2),果实膨大期滴灌施肥(5 kg/667 m2)。栽培架式分为T型(顺行平棚架)和V型,两种架式的树形均为顺行水平龙干形,株行距1.5 m×3 m。两种架式均种植两行,各45株,2芽短枝修剪,每20 cm留一结果母枝,每个结果枝留2个果穗,豆果期疏去副穗和穗尖,保持单株产量一致。采用简易避雨、地表园艺地布覆盖、滴灌供水和常规病虫害等管理模式,生长期内修剪及肥水管理一致。
1.2 试验方法
1.2.1 取样 2016、2017年每年6—8月取样。每种架式类型分为3个小区(30株/小区),葡萄果实从转色初期(花后30 d)开始取样,直至果实完全成熟。2016年分别于6月26日(花后30 d)、7月5日(花后39 d)、7月14日(花后48 d)、7月21日(花后57 d)、8月2日(花后67 d)和8月11日(花后76 d)取样6次。基于2016年试验数据,2017年于6月29日开始取样(花后30 d),每隔9 d取样一次,至8月4日(花后67 d)结束,共取样5次。取样时每个小区采集20穗(栽培行阴、阳面各取10穗),兼顾叶幕层内、外和上、中、下果穗,采样后立即运回实验室,液氮速冻后置于-80℃超低温冰箱保存备用。
1.2.2 可溶性固形物和可滴定酸测定 从采集的新鲜果实样品中随机取出50粒,挤出葡萄汁,分别测定可溶性固形物和可滴定酸。可溶性固形物采用手持式折光仪PAL-1(Atago Co,Tokyo,Japan)测定;可滴定酸采用0.1 mol∙L-1NaOH进行测定,含量以酒石酸表示,3次重复。
1.2.3 香气化合物的提取和测定 香气物质的提取和测定参考Wen等[17]的方法略有改动。取50 g葡萄果实,液氮保护下打碎去籽,分别加入0.5 g D-葡萄糖酸内酯和2 g聚乙烯基聚吡咯烷酮,利用研磨机(IKA A11)打磨成粉末,室温静置浸提,然后于4℃下8 500 r/min离心10 min,得到澄清葡萄汁。每个处理进行3 次独立的提取。取5 mL葡萄汁加入1.0 g NaCl和10 µL 4-甲基-2-戊醇,40℃加热搅拌30 min后,用已活化或热解析过的聚二甲基硅氧烷/碳筛/二乙烯苯(PDMS/CAR/DVB)萃取头相同温度下吸附30 min,然后将萃取头插入气相色谱的进样口,250℃下热解析8 min。
试验所用气相色谱为安捷伦7890B,质谱为5977A(Agilent,USA),色谱柱为HP-INNOWAX(长60 m,内径0.25 mm,液膜厚度0.25 μm)。载气为高纯氦气,流速为1 mL∙min-1。固相微萃取采用自动进样,不分流模式。柱温箱的升温程序为:50℃保持1 min,然后以3℃∙min-1的速度升温至220℃,保持5 min。质谱接口温度为280℃,离子源温度为230℃,电离方式EI,离子能量70 ev,质量扫描范围为20—350 u。
根据已有化合物标样的色谱保留时间和质谱信息,参照NIST 05标准谱库及相关文献对样品进行定性分析;利用已有的化合物制备标准曲线进行定量分析,没有标准品的物质利用化学结构、官能团相似、碳原子数相近的标准品的标准曲线进行定量。
1.2.4 RNA提取和qPCR分析 采用植物RNA快速提取试剂盒(北京华越洋生物科技有限公司)提取葡萄果实的总RNA。然后使用反转录试剂盒(Promega,A3500),参照说明书反转录成cDNA,置于-80℃保存备用。荧光实时定量qPCR反应体系参照WEN等[17]的方法。在萜类生物合成途径中的6个关键基因的引物序列参照孙磊等[18]的合成,使用、和3个内参基因做为对照。
1.3 数据处理与统计分析
数据统计分析利用分析软件SPSS 13.0,采用Duncan多重比较进行显著性方差分析,最低显著水平<0.05;主成分分析和聚类分析采用MetaboAnalyst 4.0;绘图采用Excel和Sigma Plot 10.0。
2 结果
2.1 不同架式葡萄果实成熟期间可滴定酸及可溶性固形物的变化
葡萄果实可溶性固形物含量在两种栽培架式下均随着果实成熟逐渐升高,可滴定酸含量逐渐降低(表1)。V型架栽培‘爱神玫瑰’葡萄在花后48 d可溶性固形物含量分别升至15.72%(2016年)和15.81%(2017年),可滴定酸含量分别降至4.06 g∙L-1(2016年)和4.16 g∙L-1(2017年),花后57 d可溶性固形物及可滴定酸含量均趋于稳定,确定此时葡萄进入成熟期。而T型架式栽培葡萄可溶性固形物含量在花后57 d分别上升至15.38%(2016年)和16.01%(2017年),在花后67 d含量升至最高,而可滴定酸降至较低水平。果实成熟后,T型架式栽培的葡萄果实可溶性固形物含量高于V型架,含酸量无显著差异。
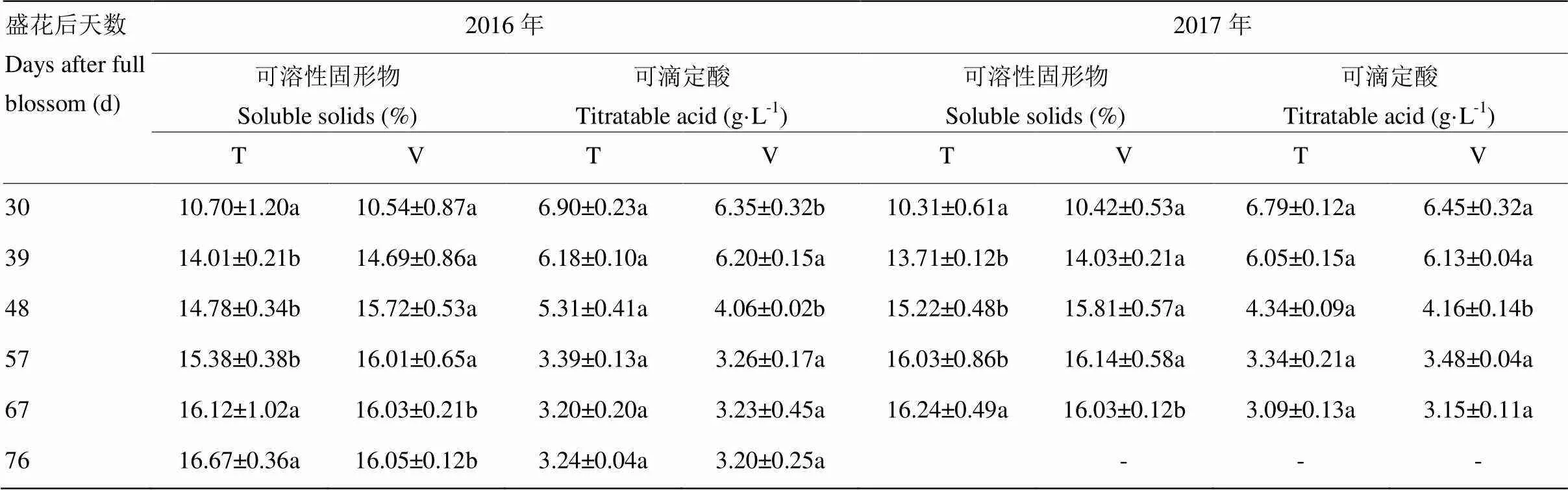
表1 不同架式果实成熟期间可滴定酸及可溶性固形物分析
不同小写字母表示差异显著(<0.05)。下同
Different letters stand for the significant difference (<0.05). The same as below
2.2 不同架式对葡萄果实中单萜类化合物组成的影响
利用SPEME-GC-MS方法,本研究2016年对28种游离态单萜类化合物进行了定性定量分析(表2)。在两种架式栽培‘爱神玫瑰’葡萄果实成熟过程中,异香叶醇在V型架葡萄果实成熟后期未检测到,其余化合物均检测到。在2017年对27种游离态单萜类化合物进行了定性定量分析,所有化合物均检测到(表2)。通过两个年份化合物数据分析发现,在葡萄果实成熟过程中,不同架式主要单萜组分差异显著。成熟初期(花后30 d),T型架葡萄果实中含量最高的5个化合物依次为橙花醚(2016—2017年)、里那醇(2017年)、异松油烯(2017年)、β-cis-罗勒烯(2017年)、cis-呋喃型氧化里那醇(2016年)、柠檬烯(2016年)、α-萜品醇(2016年)和γ-松油烯(2016—2017年)等,5个化合物含量占单萜总含量的60%以上。而V型架葡萄果实中主要单萜类化合物包括橙花醚(2016—2017年)、里那醇(2016—2017年)、异松油烯(2017年)、α-萜品醇(2016年)、柠檬烯(2016—2017年)和β-香茅醇(2016年)。花后39 d,T型架栽培果实中里那醇含量迅速升高成为第二主要成分,V型架果实中香叶醇成为主要成分,橙花醚在两种架式果实中含量仍然较高。花后48 d,两年数据均显示橙花醚、香叶醇、里那醇、α-萜品醇成为T型架果实中主含量萜类物质;而V型架葡萄中里那醇含量最高,此外含量较高的还有香叶醇(2016—2017年)、柠檬烯(2016年)、α-萜品醇(2016—2017年)和β-cis-罗勒烯(2016年)。T型架果实在花后57 d主要单萜组成包括里那醇(2016—2017年)、橙花醇(2017年)、香叶醇(2017年)、柠檬烯(2016年)、橙花醚(2016年)、α-萜品醇(2016—2017年)和β-cis-罗勒烯(2016年),其中里那醇含量分别达到41.67 µg∙L-1(2016年)和96.64 µg∙L-1(2017年);V型架果实主要单萜成分有橙花醚(2016—2017年)、里那醇(2016—2017年)、橙花醇(2017年)、香叶醇(2017年)、α-萜品醇(2016年)、柠檬烯(2016—2017年)和β-cis-罗勒烯。花后67 d,两种架式果实中主要单萜类化合物组分变化较小,其中T型果实中主要是里那醇、柠檬烯、α-萜品醇、β-cis-罗勒烯和香叶醇,V型架栽培果实中主要有里那醇、香叶醇、柠檬烯、橙花醚等,2016年里那醇在两种架式果实中含量最高,而在2017年香叶醇含量最高。
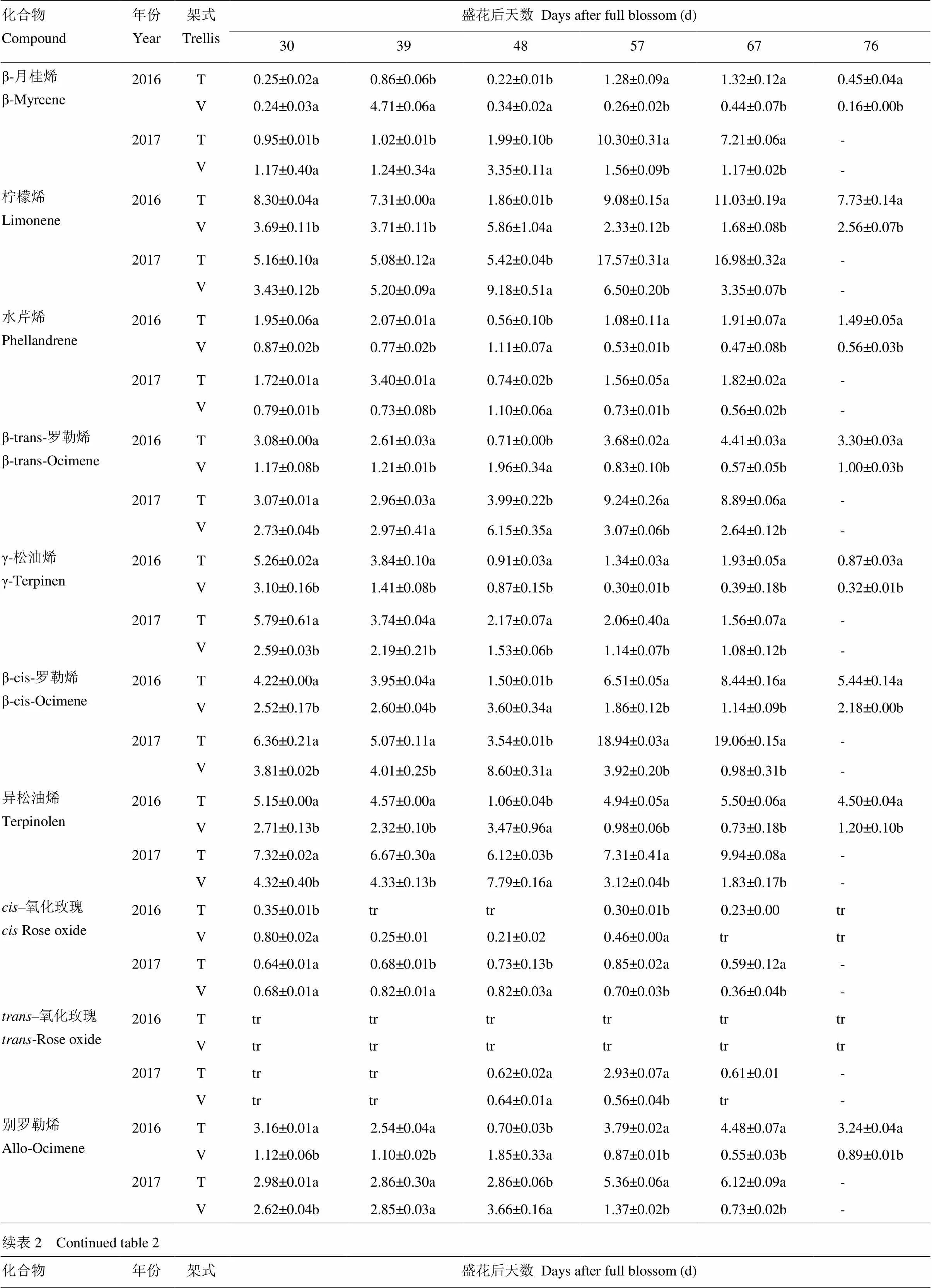
表2 不同架式葡萄果实成熟期间单萜含量分析
“tr”表示痕量;“nd”表示没有检测到
“tr” represents trace mount; “nd” represents not detected
2.3 不同架式对葡萄果实成熟期间单萜化合物含量的影响
2年化合物数据显示不同架式单萜化合物总量差异显著(表2)。转色初期(花后30 d)到花后39 d,T型架栽培葡萄果实中单萜总量显著高于V型架。花后48 d,V型架葡萄果实单萜总量分别升高达到58.4 µg·L-1(2016年)及260.9 µg·L-1(2017年),显著高于T型葡萄果实单萜总量。花后57 d,T型架葡萄果实单萜含量迅速上升,远高于V型架。显著性差异分析显示,成熟期大多数单萜类化合物在T型架果实含量显著高于V型架(表2)。
根据两年化合物含量进行聚类分析(图1),不同架式‘爱神玫瑰’果实成熟期间游离态单萜含量变化主要表现两种模式(红色数字表示)。第一种模式包含(E,Z)-别罗勒烯(M11)、β-cis-罗勒烯(M6)、柠檬烯(M2)、β-trans-罗勒烯(M4)、别罗勒烯(M10)、异松油烯(M7)、α-萜品醇(M20)、香叶醇(M27)、里那醇(M16)、橙花醇(M24)、香叶醛(M21)、香叶酸(M28)和β-月桂烯(M1)等化合物,这一大类化合物大多数在果实成熟时含量达到最高。但是在不同架式表现又略微不同。(E,Z)-别罗勒烯(M11)、β-cis-罗勒烯(M6)、柠檬烯(M2)、β-trans-罗勒烯(M4)、别罗勒烯(M10)、异松油烯(M7)和α-萜品醇(M20)这7种化合物在T型架果实中表现为先下降,花后57 d急剧升高,成熟后期(花后76 d)又下降的趋势。而在V型架果实中这7种化合物含量随着果实成熟逐渐上升,花后48 d达到积累高峰,之后又逐渐下降至最低含量。香叶醇(M27)、里那醇(M16)、橙花醇(M24)、香叶醛(M21)、香叶酸(M28)和β-月桂烯(M1)等化合物则随着果实成熟含量逐渐升高,到果实成熟期达到最高,到果实成熟后期(花后76 d)又有所下降。在第二种模式中,大多数化合物在成熟初期(花后30 d)含量最高,随着果实成熟含量降低。在T型架果实中,这类化合物在花后48 d含量降至最低,随着果实成熟又有所升高。而在V型架果实中化合物含量随着成熟过程持续降低。这类化合物包括γ-松油烯(M5)、cis-呋喃型氧化里那醇(M12)、trans-呋喃型氧化里那醇(M13)、4-松油烯醇(M17)、水芹烯(M3)、β-香茅醇(M22)和香茅醛(M15)等。
此外,对两年单萜化合物含量数据进行了主成分和最小二乘判别分析,由结果可见(图2,图3),2016年前两个主成分的累计方差贡献率为76.8%,而2017年前两个主成分的累计方差贡献率为84.1%,均反映了所有化合物的绝大部分信息。根据两个主成分可以把不同架式处理进行很好的区分。最小二乘判别分析结果显示VIP值大于1.0被认为是主要贡献差异化合物,由图3可知,2016年VIP值较大的5个化合物依次为β-香茅醇(M22)、香叶醇(M27)、香叶酸(M28)、γ-松油烯(M5)、橙花醇(M24)和里那醇(M16)。2017年VIP值较大的5个化合物依次为4-松油烯醇(M17)、trans-氧化玫瑰(M9)、香叶醇(M27)、 γ-香叶醇(M23)和β-香茅醇(M22)。
2.4 不同架式栽培葡萄果实成熟期间单萜合成途径基因转录水平变化
表达量在两种架式葡萄果实中均从成熟初期(花后30 d)开始上升,T型架果实中在花后48 d表达量升至最高,随后逐渐降低;而V型架在花后39 d达到表达高峰,随后降低。T型架最高表达量显著高于V型架,是V型架表达量的1.40倍。在两种架式不同成熟时期葡萄果实中表达量呈现不同的变化趋势,在T型架葡萄果实中,随着果实成熟略有下降之后逐渐上升,至花后57 d达到表达高峰,之后又迅速下降。而对于V型架,随着果实成熟,表达量逐渐上升,到花后48 d又有所下降,之后又逐渐上升。成熟期在T型架栽培果实中表达量高于V型架。在两种架式葡萄果实成熟期间表达模式相似,都是先上升再下降,随着果实成熟再次上升,至成熟后期又下降。在成熟期T型架葡萄果实表达量高于V型架。在两种架式葡萄果实成熟期间表达模式不同,在T型架果实成熟过程中,表达量逐渐上升,至花后48 d表达量最高,之后逐渐降低;在V型架葡萄果实成熟过程中并没有明显的表达高峰。在T型架葡萄果实中表达量明显高于V型架,转色后表达量下降,随后在花后57 d急剧上升至最高表达量。V型架葡萄果实中转色后表达量同样略有上升,之后有所下降,整体变化趋势平缓。在两种架式葡萄果实成熟过程中表达模式差异明显,在T型架葡萄果实中,成熟初期(花后30 d)表达量最高,之后下降,至48 d后又略有上升;而对于V型架栽培葡萄果实,在花后48 d表达上升之后下降。
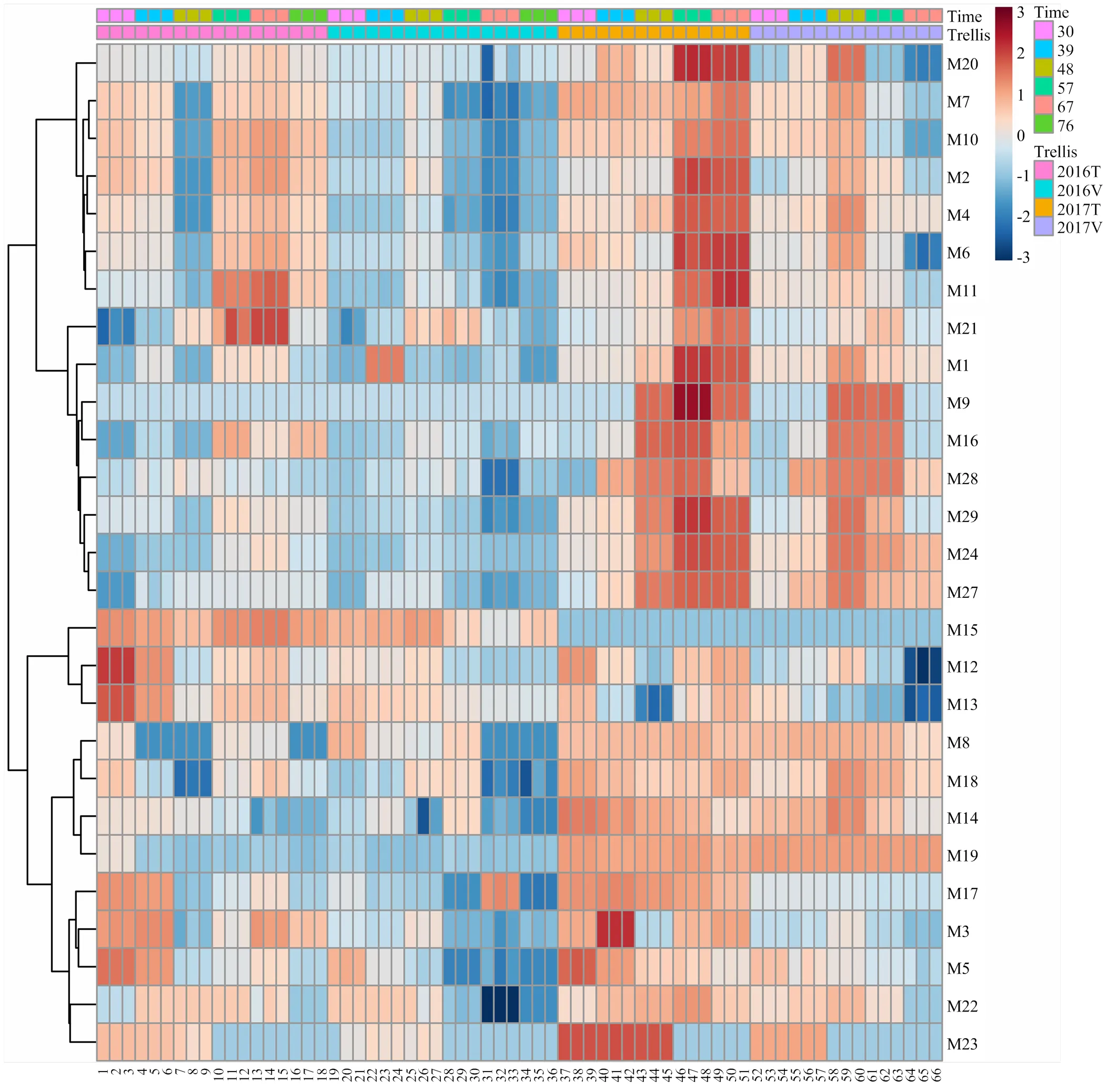
图1 不同架式葡萄果实成熟期间单萜含量聚类分析
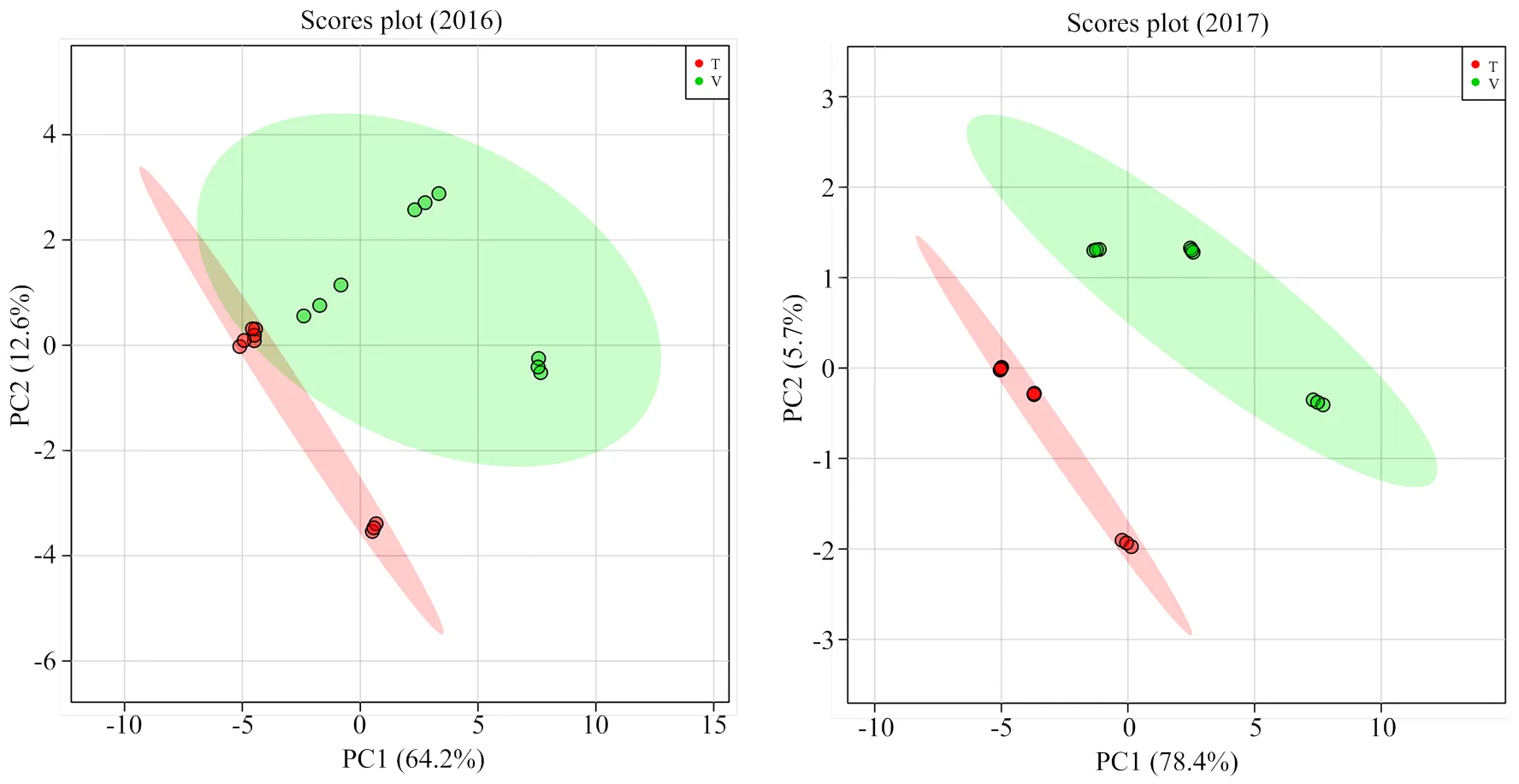
图2 不同架式葡萄果实成熟期间单萜含量主成分分析
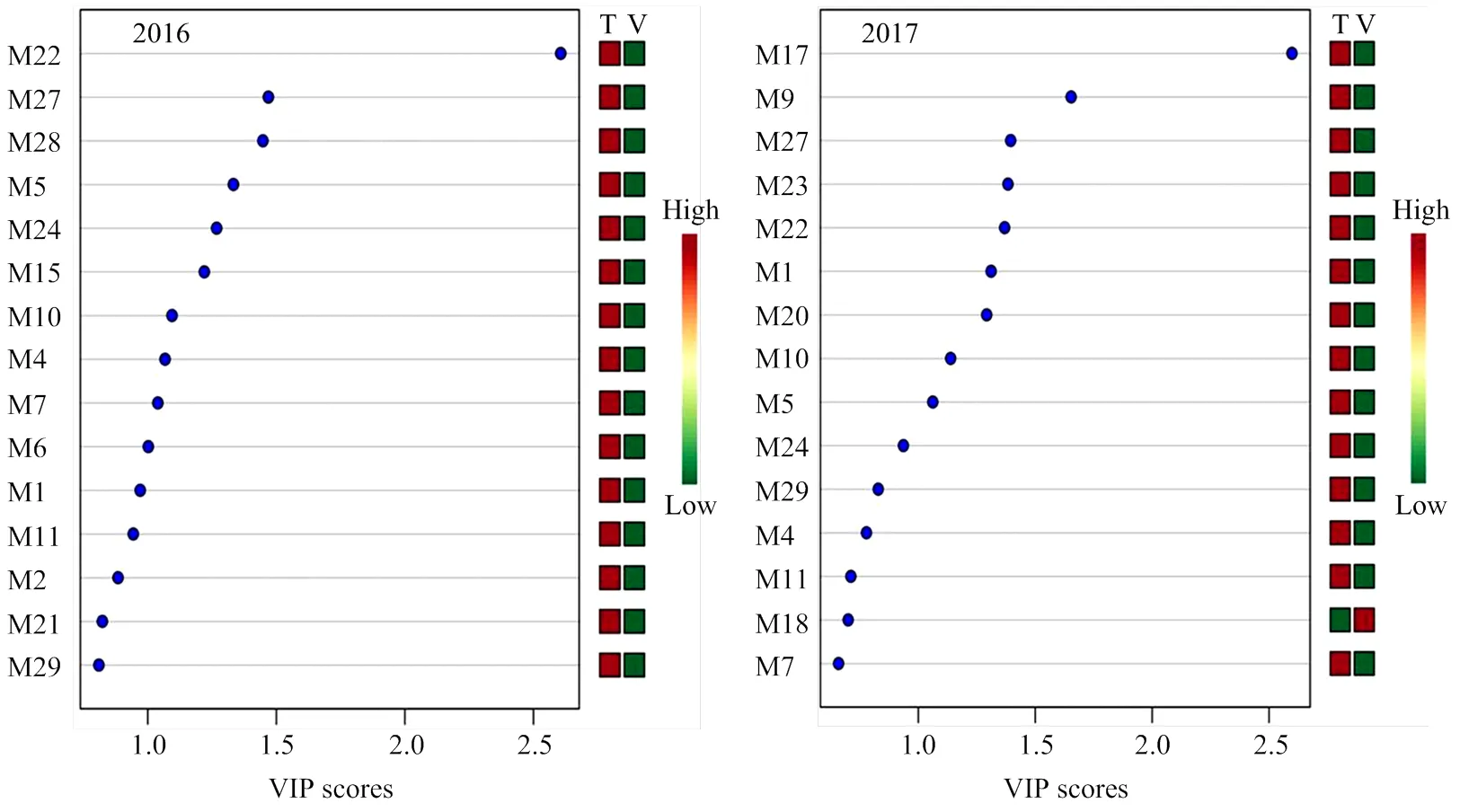
图3 不同架式葡萄果实成熟期间基于VIP值的主要化合物
3 讨论
栽培技术和栽培措施都与葡萄浆果品质有着密切关系。适宜架式的选择、架形改造和新式架型的应用是提高葡萄果实品质的重要举施。研究表明不同架式对葡萄香气物质产生重要的影响[13-16]。本研究发现T型架栽培葡萄果实中萜类物质含量更高,这可能是因为T型架栽培的相对光照强度高于V型架[19],而光照有利于香气物质积累[1]。此外,两种架式萜类化合物积累模式有差异。V型架葡萄果实萜类化合物积累高峰出现更早一些(花后48 d),T型架葡萄果实在花后57—67 d(图1)。这可能与V型架葡萄果实更早进入成熟期有关(表1)。陆贵峰等[19]也研究发现T型篱架栽培的‘凌丰’葡萄果实成熟期比V型篱架栽培晚3—5 d。随着果实成熟,大部分萜类化合物含量逐渐升高。但是在果实成熟后期,两种架式‘爱神玫瑰’葡萄果实中大部分萜类物质均呈下降趋势。有研究结果表明,‘瑞都香玉’葡萄主要呈香型萜烯成分里那醇、萜品醇含量在成熟期仍有增加,果实香气成熟期稍晚于生理成熟期,适当延迟采收有助于其特征香型的形成[20],但是对于‘爱神玫瑰’葡萄延迟采收会导致玫瑰香味品质降低,可能是由品种不同造成的差异。
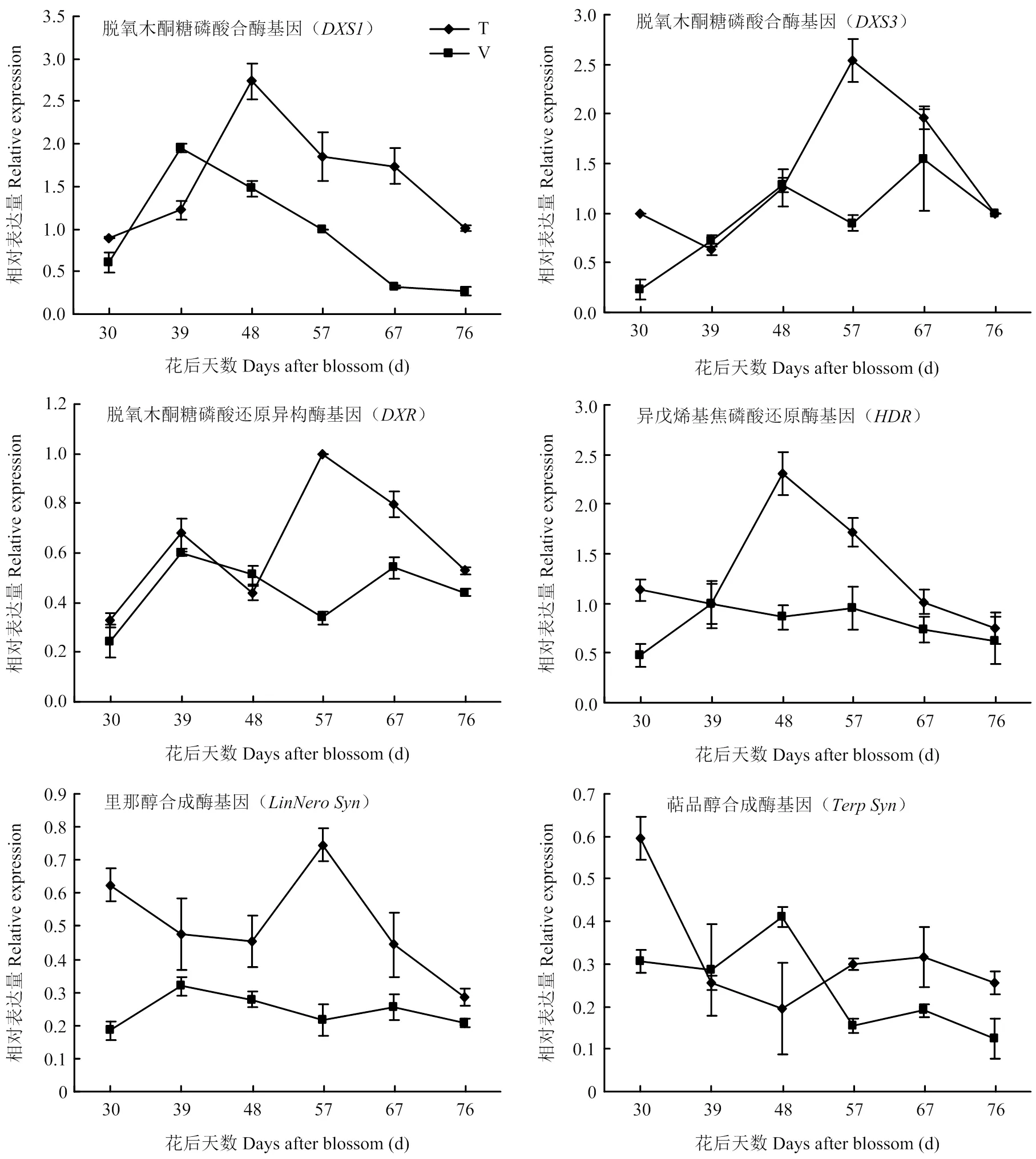
图4 同架式葡萄果实成熟期间单萜合成途径基因表达变化
一般认为玫瑰香型葡萄中主要呈香单萜类物质为里那醇、香茅醇、橙花醇、萜品醇和香叶醇[21]。本研究发现两种架式葡萄果实中主要萜类化合物组分随着果实发育发生变化(表2)。2016年在成熟期‘爱神玫瑰’葡萄果实中,主要单萜类成分有里那醇、α-萜品醇、香叶醇、柠檬烯、β-cis-罗勒烯、橙花醚和异松油烯,2017年主要有里那醇、α-萜品醇、香叶醇、橙花醇和-cis-罗勒烯,而香茅醇含量并不高。但是最小二乘判别分析结果显示不同架式主要差异萜类化合物里包含β-香茅醇(M22)、香叶醇(M27)及氧化玫瑰等化合物,被认为是主要贡献萜类成分,可见化合物含量高低并不是玫瑰香味的主要决定因素。Ruiz-García等[22]指出氧化玫瑰存在与否可以作为鲜食葡萄玫瑰香味有无的评判标准,而氧化玫瑰含量很低。本研究结果表明两个年份两种架式成熟葡萄果实中里那醇含量均比较高,且高于其香气阈值[17],可能是‘爱神玫瑰’葡萄的主要呈香成分。
葡萄中单萜主要通过DXP/MEP途径合成。本研究跟踪了单萜合成途径中6个重要基因的表达变化,各个基因表达量随着果实成熟都有一个上升的过程(图4)。不同架式葡萄果实成熟期间单萜总量积累规律与、、和表达规律相似。王继源等[23-24]研究发现‘阳光玫瑰’葡萄果实成熟过程中表达量上调促进单萜物质的生成。孙磊等[18]也发现在‘亚历山大’葡萄果实发育过程中,单萜总量积累与和的转录情况具有显著相关性,而与表达相关性较低,认为果实后期萜类积累有可能是由于表达造成的。研究认为葡萄对于玫瑰香味产生具有重要的作用,其基因序列的SNP突变是产生玫瑰香味的重要原因[25-27],但是对于其表达关注比较少。本研究发现随着果实成熟表达上调,而表达积累高峰早于,可能果实成熟早期单萜积累主要与表达有关。成熟期T型架果实中各个基因表达量明显高于V型架(图4),与单萜类化合物积累模式相一致。此外MARTIN等[28]用琼瑶浆为材料的试验结果也证明的表达与单萜积累规律相一致。和的表达高峰与里那醇和萜品醇等产物积累略有差异,T型架和V型架果实中尽管随着果实成熟表达上调,但是均在成熟初期(花后30 d)表达较高,而里那醇和萜品醇含量此时并不高,这可能与里那醇合成酶和萜品醇合酶还参与其他单萜化合物月桂烯、β-cis-罗勒烯和柠檬烯等合成有关[29-31]。T型架果实中表达量远高于V型架,这与里那醇等化合物积累相一致。除了花后48 d的果实,T型架果实中的表达也高于V型架,与化合物含量变化一致。
4 结论
单萜积累与其代谢途径中多个关键酶基因表达具有紧密相关性,其合成受到各个基因转录水平的调控。T型架式栽培‘爱神玫瑰’葡萄果实单萜类化合物积累更多。
[1] 涂崔, 潘秋红, 朱保庆, 吴玉文, 王志群, 段长青. 葡萄与葡萄酒单萜化合物的研究进展. 园艺学报, 2011, 38(7): 1397-1406.
Tu C, Pan Q H, Zhu B Q, Wu Y W, Wang Z Q, Duan C Q. Progress in study of monoterpene compounds in grape and wine., 2011, 38(7): 1397-1406. (in Chinese)
[2] Xu X Q, Cheng G , Duan L L, Jiang R, Pan Q H, Duan C Q, Wang J. Effect of training systems on fatty acids and their derived volatiles in cabernet sauvignon grapes and wines of the north foot of Mt. Tianshan., 2015, 181: 198-206.
[3] XU H Y, SUN L, ZHANG G J, YAN A L. ‘Aishenmeigui’: An extremely early maturing seedless grape with muscat flavor., 2014, 53(1): 53.
[4] MARTIN D M, CHIANG A, LUND S T, BOHLMANN J. Biosynthesis of wine aroma: Transcript profiles of hydroxyl methyl butenyl diphosphate reductase, geranyl diphosphate synthase, and linalool/ nerolidol synthase parallel monoterpenol glycoside accumulation in Gewürztraminer grapes., 2012, 236: 919-929.
[5] EI HADI M A, ZHANG F J, WU F F, ZHOU C H, TAO J. Advances in fruit aroma volatile research., 2013, 18(7): 8200-8229.
[6] ZHANG E P, CHAI F M, ZHANG H H, LI S H, LIANG Z C, FAN P G. Effects of sunlight exclusion on the profiles of monoterpene biosynthesis and accumulation in grape exocarp and mesocarp., 2017, 237: 379-389.
[7] FRIEDEL M, FROTSCHER J, NITSCH M, HOFMANN M, BOGS J, STOLL M, DIETRICH H. Light promotes expression of monoterpene and flavonol metabolic genes and enhances flavour of winegrape berries (l. cv. Riesling)., 2016, 22(3): 409-421.
[8] SCHULTZ H R. Grape canopy structure, light microclimate and photosynthesis. 1. A two-dimensional model of the spatial distribution of surface area densities and leaf ages in two canopy systems., 1995, 34(4): 211-215.
[9] 赵文东, 满丽婷, 孙凌俊, 高圣华, 赵海亮, 马丽, 郭修武. 架式与负载量对晚红葡萄果实品质的影响. 中国农学通报, 2010, 26(11): 241-244.
ZHAO W D, MAN L T, SUN L J, GAO S H, ZHAO H L, MA L, GUO X W. Effects of different trellis and fruit load on the fruit quality of Red Globe Grape., 2010, 26(11): 241-244. (in Chinese)
[10] 文旭, 边凤霞, 王富霞, 容新民. 不同架式对四师67团酿酒葡萄生长发育和果实品质的影响. 安徽农业科学, 2015, 43(33): 60-61.
WEN X, BIAN F X, WANG F X, RONG X M. Effects of different tree form on the growth and fruit quality of wine grape at the Four Division 67 Regiment., 2015, 43(33): 60-61. (in Chinese)
[11] 刘笑宏, 孙永江, 孙红, 翟衡. 不同叶幕类型对‘摩尔多瓦’葡萄果穗微域环境及果实品质的影响. 中国农业科学, 2016, 49(21): 4246-4254.
LIU X H, SUN Y J, SUN H, ZHAI H. Effect of canopy types on the cluster micro-environment and fruit quality of the ‘Moldova' grapes., 2016, 49(21): 4246-4254. (in Chinese)
[12] 刘笑宏, 肖秋红, 孙永江, 杜远鹏, 翟衡. 两种叶幕类型‘摩尔多瓦’葡萄套袋果实花色苷代谢的差异. 园艺学报, 2018, 45(3): 457-470.
LIU X H, XIAO Q H, SUN Y J, DU Y P, ZHAI H. Difference of bagged moldova grapes anthocyanin metabolism for two trellis systems., 2018, 45(3): 457-470. (in Chinese)
[13] 赵新节, 孙玉霞, 刘波, 王晓, 束怀瑞. 不同架式栽培的玫瑰香葡萄成熟期挥发性物质的变化. 园艺学报, 2005, 32(1): 87-90.
ZHAO X J, SUN Y X, LIU B, WANG X, SHU H R. Changes of volatile compounds in ‘Muscat Hambourg’ for various trellis systems during maturity., 2005, 32(1): 87-90. (in Chinese)
[14] 商佳胤, 田淑芬, 李树海, 朱志强, 黄建全, 集贤, 王丹. 玫瑰香葡萄Y型架与篱架叶幕层光照强度及果实品质的差异. 园艺学报, 2013, 40(7): 1349-1358.
SHANG J Y, TIAN S F, LI S H, ZHU Z Q, HUANG J Q, JI X, WANG D. Differences of leaf canopy of Y frame and vertical trellises on light intensity and qualities of Muscat Hamburg grape.2013, 40(7): 1349-1358. (in Chinese)
[15] JI T, DAMI I E. Characterization of free flavor compounds in Traminette grape and their relationship to vineyard training system and location.2008, 73(4): C262-C267.
[16] FRAGASSO M, ANTONACCI D, PATI S, TUFARIELLO M, BAIANO A, FORLEO L R. Influence of training system on volatile and sensory profiles of Primitivo grapes and wines., 2012. doi: 10.5344/ajev.2012.11074.
[17] WEN Y Q, ZHONG G Y, GAO Y, LAN Y B, DUAN C Q, PAN Q H. Using the combined analysis of transcripts and metabolites to propose key genes for differential terpene accumulation across two regions., 2015, 8: 1226.
[18] 孙磊, 朱保庆, 孙晓荣, 许晓青, 王晓玥, 张国军, 徐海英. ‘亚历山大’葡萄果实单萜生物合成相关基因转录及萜类物质积累规律. 中国农业科学, 2014, 47(7): 1379-1386.
SUN L, ZHU B Q, SUN X R, XU X Q, WANG X Y, ZHANG G J, XU H Y. Terpenes biosynthesis related gene transcript profiles and terpenes accumulation of ‘Alexandria’ grape., 2014, 47(7): 1379-1386. (in Chinese)
[19] 陆贵锋, 黄凤珠, 廖慧茜, 彭宏祥, 秦献泉, 林玲, 李冬波, 李鸿莉, 徐宁, 朱建华. 两种架形对酿酒葡萄凌丰生长及产量的影响. 南方农业学报, 2017, 48(5): 866-869.
LU G F, HUANG F Z, LIAO H Q, PENG H X, QIN X Q, LIN L, LI D B, LI H L, XU N, ZHU J H. Effects of V and T trellis on growth and yield of wine grape variety., 2017, 48(5): 866-869. (in Chinese)
[20] 张克坤, 王海波, 王孝娣, 史祥宾, 王宝亮, 郑晓翠, 刘凤之. ‘瑞都香玉’葡萄果实挥发性成分在果实发育过程中的变化. 中国农业科学, 2015, 48(19): 3965-3978.
ZHANG K K, WANG H B, WANG X D, SHI X B, WANG B L, ZHENG X C, LIU F Z. Evolution of volatile compounds during the berry development of ‘Ruidu Xiangyu’ grape., 2015, 48(19): 3965-3978. (in Chinese)
[21] 张明霞, 吴玉文, 段长青. 葡萄与葡萄酒香气物质研究进展. 中国农业科学, 2008, 41(7): 2098-2104.
ZHANG M X, WU Y W, DUAN C Q. Progress in study of aromatic compounds in grape and wine., 2008, 41(7): 2098-2104. (in Chinese)
[22] RUIZ-GARCÍA L, HELLIN P, FLORES P, FENOLL J. Prediction of Muscat aroma in table grape by analysis of rose oxide.. 2014, 154: 151-157.
[23] 王继源, 冯娇, 侯旭东, 陶建敏. 不同果袋对‘阳光玫瑰’葡萄香气组分及合成相关基因表达的影响. 果树学报, 2017, 34(1): 1-11.
WANG J Y, FENG J, HOU X D, TAO J M. Effects of bagging treatments with different materials on aroma components and their biosynthetic gene expression in ‘Shine Muscat’ grape berry., 2017, 34(1): 1-11. (in Chinese)
[24] 王继源, 冯娇, 侯旭东, 陶建敏. CPPU对‘阳光玫瑰’葡萄品质及香气合成相关基因表达的影响. 南京农业大学学报, 2016, 39(6): 915-923.
WANG J Y, FENG J, HOU X D, TAO J M. Effects of CPPU on aroma components and biosynthetic genes expression in ‘Shine Muscat’ grapes., 2016, 39(6): 915-923. (in Chinese)
[25] EMANUELLI F, BATTILANA J, COSTANTINI L, LE CUNFF L, BOURSIQUOT J M, THIS P, GRANDO M S. A candidate gene association study on muscat flavor in grapevine (L.)., 2010, 10: 241.
[26] BATTIILANA J, EMANUELLI F, GAMBINO G, GRIBAUDO I, GASPERI F, BOSS P K, GRANDO M S. Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphate synthase substitution K284N on Muscat flavor formation., 2011, 62(15): 5497-5508.
[27] YANG X X, GUO Y S, ZHU J C, SHI G L, NIU Z Z, LIU Z D, LI K, GUO X W. Associations between the 1-deoxy-d-xylulose-5-phosphate synthase gene and aroma in different grapevine varieties., 2017, 39: 1059-1067.
[28] MARTIN D M, AUBOURG S, SCHOWEY M B, DAVIET L, SCHALK M, TOUB O, LUND S T, BOHLMANN J, Bohlmann J. Functional annotation, genome organization and phylogeny of the grapevine () terpene synthase gene family based on genome assembly, FLcDNA cloning, and enzyme assays., 2010, 10: 226.
[29] MATARESE F, D'ONOFRIO G S C. Analysis of the expression of terpene synthase genes in relation to aroma content in two aromaticvarieties., 2013, 40(6): 552-565.
[30] MARTINEZ F J, FOGUE M, COLLl M, CANO J C, CALAFATE C T, MANZONI P. Expression of terpene synthase genes associated with the formation of volatiles in different organs of., 2014, 105(3): 12-24.
[31] MARTIN D M, BOHLMANN J. Identification of(-)--terpineol synthase by in silico screening of full-length cDNA ESTs and functional characterization of recombinant terpene synthase., 2004, 65: 1223-1229.
The Accumulation of Monoterpenes and the Expression of Its Biosynthesis Related Genes in ‘Aishen Meigui’ Grape Berries Cultivated in Different Trellis Systems During Ripening Stage
Wang Huiling1, Wang Xiaoyue2, Yan Ailing3,Sun Lei1, Zhang Guojun1,REN JianCheng1, Xu Haiying1
(1Beijing Academy of Forestry and Pomology Sciences, Beijing 100093;2Beijing Engineering Research Center for Deciduous Fruit Trees, Beijing 100097;3Key Laboratory of Biology and Genetic Improvement of Horticultural Crops (North China), Ministry of Agriculture, Beijing 100097)
【Objective】The effects of two trellis systems on the synthesis of monoterpenes and the expression of its biosynthesis related genes during the maturity of grape berries were studied, in order to reveal the relationship between gene transcription and monoterpenoids accumulation and provide a theoretical basis for trellis selection in production and improvement of aroma quality of grape fruits. 【Method】The grape berries of Aishen Meigui cultivated in the T and V trellis were used as materials. The berry samples were collected from the beginning of the color change period until the fruit ripened completely. Total soluble solid and titratable acid content in fruits were detected. The changes of monoterpene components and contents in fruits were determined by headspace solid-phase microextraction combined with gas chromatography-mass spectrometry (SPEME-GC-MS) in two consecutive years. Additionally, the expression of key enzyme genes in monoterpene biosynthesis pathway including 1-deoxy-D-xylulose 5-phosphate synthase genes (and), 1-deoxy-D-xylulose-5-phosphate reductoisomerase gene (), isopentenyl pyrophosphate reductase gene (), linalool synthase gene () and terpineol synthase gene () were analyzed by real-time fluorescence quantitative analysis (qPCR).【Result】During grape berries maturity, the total soluble solids content increased gradually, while titratable acid content decreased gradually. The total soluble solids content of the Aishen Meigui grape cultivated in T trellis was significantly higher than that of grape cultivated in V trellis at ripening stage, and there was no significant difference in titratable acid content.27 and 28 monoterpene compounds were detected in the grape berries of Aishen Meigui in 2016 and 2017, respectively. The main monoterpene components changed during berry maturity and were different in grape berries cultivated in T and V trellis. As the results shown, linalool, limonene, α-Terpineol, β-cis-Ocimene and geraniol were the main monoterpenes in grape berries cultivated in T trellis, while abundant linalool, α-Terpineol, limonene, nerol oxide and β-cis-Ocimene were detected in the berries cultivated in V trellis, and the content of linalool was the highest among them. At the maturity stage, total monoterpene content of T trellis grape berries reached 108.18 µg∙L-1, which was 1.9 times higher than that of V trellis berries in 2016. While in 2017, total monoterpene content of T trellis grape berries reached 403.24 µg∙L-1, which was 1.5 times higher than that of V trellis berries. The content of most monoterpene compounds in T trellis fruits were significantly higher than that in V trellis fruits at maturity. During grape berry development, the changes of monoterpenes accumulation in grape berries cultivated in both two trellis systems exhibited two patterns. Most of the monoterpenes including linalool, geraniol, nerol and α-Terpineol followed the first pattern: the content of monoterpenes reached the peak at maturity. But differences were observed between trellises. In the T trellis fruits, the content of compounds, such as (E,Z)-Allo-Ocimene, β-cis-Ocimene, limonene and α-terpineol, firstly decreased, and then increased sharply at 57 days after flowering, followed by a reduction during the later part of ripening stage (76 days after flowering). However, in V trellis berries, the content of these compounds increased gradually during fruit ripening, peaked at 48 days after flowering, and then decreased to the lowest level. The expression of monoterpene synthesis pathway genes (,,,,and) increased with berry ripening, of them, the changes of,,andexpression were corresponding well to the total monoterpenes accumulation patterns in grape berries cultivated in distinct trellis systems during ripening. The expression of each gene in T-trellis grape berries was significantly higher than that in V-trellis berries, which was consistent with the accumulation pattern of different monoterpenes. 【Conclusion】More accumulation of monoterpenes were detected in Aishen Meigui grape berries cultivated in T trellis. The synthesis of monoterpenes was highly correlated with the expression level of several key genes in the synthesis pathway.
grape; trellis systems; muscat flavor; monoterpenes
10.3864/j.issn.0578-1752.2019.07.002
2018-09-14;
2019-01-11
国家自然科学基金青年基金(31601712)、现代农业产业技术体系建设专项(CARS-29)、北京市农林科学院青年科学基金(QNJJ201604)、北京市自然科学基金(6182007)
王慧玲,E-mail:wanghui198216@126.com。通信作者徐海英,Tel:010-82592156;E-mail:haiyingxu63@sina.com
(责任编辑 赵伶俐)

