褐飞虱GSK-3调控糖原与海藻糖代谢的潜在功能
丁艳娟,刘永康,罗雨嘉,邓颖梅,徐红星,唐斌,徐彩娣,3
褐飞虱GSK-3调控糖原与海藻糖代谢的潜在功能
丁艳娟1,刘永康1,罗雨嘉1,邓颖梅1,徐红星2,唐斌1,徐彩娣1,3
(1杭州师范大学生命与环境科学学院,杭州 310036;2浙江省农业科学院植物保护与微生物研究所,杭州 310021;3杭州师范大学教育学院,杭州 310036)
【目的】昆虫胰岛素信号途径能够介导糖原合成酶激酶3(glycogen synthase kinase 3,简称GSK-3或GSK3)调控体内糖原及海藻糖等糖代谢过程,从而控制昆虫的各项生命活动。论文旨在探究糖原合成酶激酶在褐飞虱()体内对糖原与海藻糖代谢的调控作用。【方法】首先,基于GSK-3的cDNA编码序列,利用ExPASy工具翻译GSK-3氨基酸序列,预测蛋白分子量大小及等电点(pI);然后利用SignaIP4.1Server对其信号肽进行分析。其次,以笔者实验室饲养的褐飞虱为研究对象,从4龄开始,每12 h取材,取至成虫48 h。利用Trizol法提取褐飞虱总RNA,根据反转录试剂盒合成第一链DNA,以18S作为内参基因,通过实时荧光定量PCR(qRT-PCR)检测褐飞虱在不同龄期mRNA水平上的相对表达量。然后利用RNAi技术,向褐飞虱体内显微注射双链RNA(dsRNA)抑制,以注射ds的褐飞虱作为对照组。注射后48 h利用qRT-PCR技术检测的表达情况,确定抑制效果。另外,取注射后48 h虫体,分别测定褐飞虱体内海藻糖、葡萄糖、糖原含量及海藻糖酶(trehalase,TRE)活性变化。最后采用qRT-PCR检测胰岛素信号通路胰岛素受体基因(insulin receptor,)、类胰岛素多肽基因(insulin-like peptides,)及海藻糖代谢途径、海藻糖合成酶基因(trehalose-6-phophate synthase,)、糖原磷酸化酶基因(glycogen phosphorylase,)、糖原合成酶基因(glycogen synthase,)中相关基因的表达,分析在胰岛素信号通路及海藻糖代谢途径中的调控作用。【结果】褐飞虱开放阅读框为1 914 bp,编码637个氨基酸;预测蛋白分子量为69.25 kD,等电点为9.15,为偏碱性蛋白,无信号肽结构,序列高度保守。发育表达模式结果显示在不同发育阶段表达不一致,5龄若虫蜕皮前后低表达。的dsRNA注射后48 h,与对照组ds相比,表达极显著下降,表明RNA干扰效果明显。糖原含量和两类海藻糖酶活性显著下降,而海藻糖含量显著上升,推测糖原和葡萄糖转化为海藻糖,作为其生理活动的能量来源。qRT-PCR检测发现,当表达抑制后48 h,的表达量显著下降,而和的表达量极显著下降。另外,2个基因、以及的表达量均极显著下降;胰岛素信号通路的2个基因和4个基因的表达同样被抑制,间接表明能够调控的表达。【结论】褐飞虱低表达后能够通过调控胰岛素信号通路及海藻糖代谢途径相关基因表达来调控糖原及海藻糖代谢。相关研究结果有助于更加全面地探索褐飞虱等昆虫糖原合成酶激酶调控海藻糖及糖类物质平衡的潜在分子机理。
褐飞虱;RNA干扰;糖原合成酶激酶3;糖原与海藻糖代谢;实时荧光定量PCR(qRT-PCR)
0 引言
【研究意义】我国是水稻()种植大国,自1991年起,稻谷播种面积稳定在3 000万公顷左右,产量近年来基本维持在2.1亿吨。作为重要的粮食作物,水稻产量的稳定对我国民生具有非常重要的意义。但水稻在其生产以及储存过程经常遭到各种害虫的威胁。据报道,目前水稻害虫总数已经超过800种[1]。其中,褐飞虱()是危害最为严重的一种水稻害虫。褐飞虱是单食性害虫,具有繁殖速度快、内禀增长率较高、生命周期很短、适应性强等特点[2-5]。另外,褐飞虱具有迁飞性,每年都会从东南亚迁飞到我国危害水稻生产,造成较广的危害范围,防治难度大[6]。因此,亟需寻找一种环保、高效的褐飞虱防治方法。【前人研究进展】海藻糖(trehalose)是一种普遍存在于低等植物、藻类、细菌、真菌、酵母、昆虫及其他无脊椎动物中的非还原性双糖[7-8],也是昆虫血淋巴中的重要能量物质,为昆虫进行一系列生命活动提供能源,并调控昆虫的生长、发育、蜕皮变态等过程,因此被称为昆虫的“血糖”[9]。昆虫体内的糖原以及海藻糖代谢直接影响到昆虫的一系列生命活动,在这个过程中,糖原合成酶激酶3(glycogen synthase kinase 3,简称GSK-3或GSK3)起到了至关重要的调控作用[10-11]。相关研究表明,在动物体内,糖原合成酶的主要功能便是在糖原合成的最后一步中催化尿苷二磷酸葡萄糖上的葡萄糖基C1在糖原的非还原性末端C4形成-1,4-糖苷链,使原来的糖原分子增加一个葡萄糖单位。GSK-3可以通过使糖原合成酶磷酸化从而使糖原合成酶失活,抑制糖原合成最后一步的进行,并且还可以阻碍胰岛素信号通路的传导从而抑制糖原合成[12-15]。而糖原和海藻糖之间的转化密不可分,因此的表达对糖原和海藻糖的合成代谢具有重要的影响。GSK-3通过使糖原合成酶磷酸化以及影响胰岛素信号通路从而抑制糖原的合成,而糖原与其他的糖类物质之间存在紧密的联系,它们可以通过酶的催化作用从而互转化。当昆虫体内表达失常,其体内糖代谢过程便会失衡,从而昆虫的发育、蜕皮等一系列生命活动都会出现异常[10,16-20]。目前对GSK-3的调控作用也有一定的研究进展,比如Akt1可以通过调节GSK-3活性来保证黑腹果蝇()的雌性生殖系干细胞(germline stem cell)的维持[21]。【本研究切入点】前期研究表明GSK3在各种信号传导途径中发挥着重要的作用,例如对果蝇的WNK神经起正调节作用[22]。但关于GSK-3与褐飞虱糖类物质代谢关系的研究鲜见报道,GSK-3在褐飞虱胰岛素信号通路中的作用也有待研究。【拟解决的关键问题】以重要的农业害虫褐飞虱的为对象,研究其分子特性、时期表达特征,并探究褐飞虱体内GSK-3调控昆虫主要糖类物质代谢的功能,为将来通过调控昆虫“血糖”平衡或能量供应来控制害虫提供理论依据。
1 材料与方法
试验于2017—2018年在杭州师范大学完成。
1.1 供试昆虫及材料
褐飞虱采自中国水稻研究所,在本实验室饲养。水稻品种全部采用感虫水稻TN1(Taichung Native 1)。水稻种植步骤:首先将水稻种子浸入约70℃的温水中浸泡10 min左右,打破休眠;再将种子浸泡到自来水中放至于30℃人工气候培养箱泡种24 h;随后倒去泡种的水,自来水冲洗数次后用湿纱布包裹种子,置于30℃人工气候培养箱催芽24—48 h,种子发芽后播种于塑料盆;适当施肥促进小苗生长,待长至10 cm左右后,转移至大田插秧;待水稻生长至分蘖中期后将其移至养虫笼,每隔2—3 d更换一次水稻。褐飞虱饲养条件:温度(26±1)℃,光周期16 h/8 h,相对湿度为70%。从4龄若虫至发育为成虫后3 d的褐飞虱虫体,每12 h取材,用于发育表达模式研究。用于后期注射试验的材料均取5龄若虫后的褐飞虱。
1.2 主要试剂
Trizol试剂盒(购自Lifetech Scientific Corporation);pMD18-T、AMV反转录试剂盒、6×Loading buffer、DNA Marker DL2000及实时荧光定量PCR试剂(购自大连TaKaRa公司);PCR引物(上海英潍捷基有限公司合成);T7 RiboMax Express RNAiSystem(Promega,Madison,USA);氯仿、异丙醇、EDTA等常规试剂(国药集团化学试剂有限公司);实时荧光定量PCR96孔透明板和光学粘性封膜等耗材(Bio-RAD,USA)。
1.3 试验方法
1.3.1cDNA序列分析 根据褐飞虱转录组中获得的cDNA编码序列,克隆测序后,利用NCBI中的ORF Finder(Open Reading Frame Finder)(http://cms.ncbi.nlm.nih.gov/orf finder/)工具找到GSK-3的全长ORF序列,并用ExPASy网站translate tool翻译成氨基酸序列(https://web.expasy.org/ translate/),预测蛋白分子量大小及等电点(pI);利用SignaIP4.1Server对其氨基酸序列进行信号肽分析(http://www.cbs.dtu.dk/services/ SignalP/)。
1.3.2 总RNA抽提及cDNA合成 利用Trizol试剂盒并按照说明书提取褐飞虱虫体的总RNA。提取后用1%的琼脂糖凝胶电泳检测总RNA的质量,然后利用NanoDrop 2000分光光度计测定RNA的浓度及纯度。使用Prime Script®RT reagent Kit with gDNA Eraser试剂盒配置体系并合成cDNA第一链。
1.3.3 dsRNA的合成 根据dsRNA特异性片段设计并合成特异性引物,进行PCR扩增,扩增产物再进行T克隆,随后用带T7启动子的引物进行交叉PCR反应,相关引物序列见表1。根据T7 RiboMAXTMExpress RNAi System试剂盒的说明进行ds的合成,随后采用NanoDropTM2000分光光度计测定ds的浓度,采用同样的方法合成的dsRNA作为对照组[11]。
1.3.4 褐飞虱的显微注射 用于显微注射的材料分为ds以及作为对照的ds。在注射前向标准毛细管注射dsRNA确定显微注射器每次泵出dsRNA的体积,然后通过调整氮气压来调整泵出dsRNA的体积,使其泵出体积符合注射所需量。将用CO2麻醉后的5龄褐飞虱虫体腹部朝上放置于有琼脂胶板的一次性培养皿中,注射部位为第一对足中间偏下较软部位。取5龄第1天的褐飞虱用于显微注射,注射量均为200 ng/头,每个处理组注射100头褐飞虱。注射后48 h取材,用于海藻糖、葡萄糖、糖原含量和海藻糖酶活性测定,以及相关基因表达量测定。
1.3.5发育表达模式及RNAi后海藻糖通路、胰岛素信号通路相关基因表达量测定 从4龄若虫至发育为成虫后3 d的褐飞虱虫体,每12 h取材,用于发育表达模式研究;取注射后48 h褐飞虱用于检测海藻糖通路及胰岛素信号通路关键基因表达量。采取平行取样,即每个处理组取3管,每管5头褐飞虱,最后每个样品得到3管平行cDNA,放置于-80℃冰箱保存。试验时,再进行重复点样,即每管cDNA做3个定量,3管平行cDNA 共得到9个数据,每个样品为平均值±标准误,保证数据的可靠性。qRT-PCR反应体系(20 μl):10 µL SYBR Premix Ex Taq;1 μl上游/下游引物;1 μl cDNA;7 μl灭菌超纯水。定量引物见表1。反应程序:95℃预变性10 s,95℃解链5 s,59℃退火并延伸30 s,40个循环。
1.3.6 海藻糖、葡萄糖、总糖原含量以及海藻糖酶活性测定 取每个处理及对照组材料,加入100 μl PBS,研磨,再加100 μl PBS,超声破碎至无块状组织,破碎后加入800 μl PBS,4℃,1 000×离心20 min。取350 μl上清,4℃,20 800×超离心60 min。超离心后的上清用于葡萄糖、可溶性海藻糖酶(TRE1)和蛋白质(Pr1)的测定,沉淀用PBS悬浮后用于葡萄糖、膜结合海藻糖酶(TRE2)和蛋白质(Pr2)的测定,具体步骤按照试剂盒说明操作。
1.3.7 数据分析 取3个重复孔的平均CT值用于计算,即最后得到的数据为平均值±标准误。再带入2-ΔΔCT公式计算,对照组为褐飞虱注射ds组的CT值。2-ΔΔCT计算公式:
2-ΔΔCT= 2-[(CT实验组-CT实验18S)- (CT对照组-CT对照18S)]
应用Excel软件绘制图表,并使用STATISTICA 8.0和SigmaPlot 10.0进行统计分析,采用One-Way ANOVA法进行差异显著性检验(<0.05为差异显著,用*表示;<0.01为差异极显著,用**表示)。
2 结果
2.1 GSK-3的序列结构特征
根据褐飞虱转录组数据及克隆验证后,发现褐飞虱cDNA开放阅读框全长1 914 bp,编码637个氨基酸,预测蛋白分子量为69.25 kD,等电点为9.15,为偏碱性蛋白,无信号肽结构(图1)。GSK-3蛋白含有20种氨基酸,其中丝氨酸(Ser)、甘氨酸(Gly)、亮氨酸(Leu)和天冬酰胺(Asn)等含量较丰富,所占比例分别为11.1%、8.0%、7.7%和7.5%。酸性氨基酸(带负电荷)为46个,碱性氨基酸(带正电荷)为78个。

图1 褐飞虱GSK-3的核苷酸和氨基酸序列
2.2 褐飞虱GSK-3发育表达模式
褐飞虱在不同发育阶段的表达量不同,在4龄初期和末期、5龄48 h和成虫36 h表达量相对较高;在4龄24 h、5龄的初期及末期表达量相对较低(图2)。
2.3 RNAi后GSK-3的表达
体外合成的dsRNA注射到褐飞虱体内后,与注射ds组相比较注射后48 h其mRNA表达水平极显著下降(图3),该结果表明RNAi有效抑制了的表达。
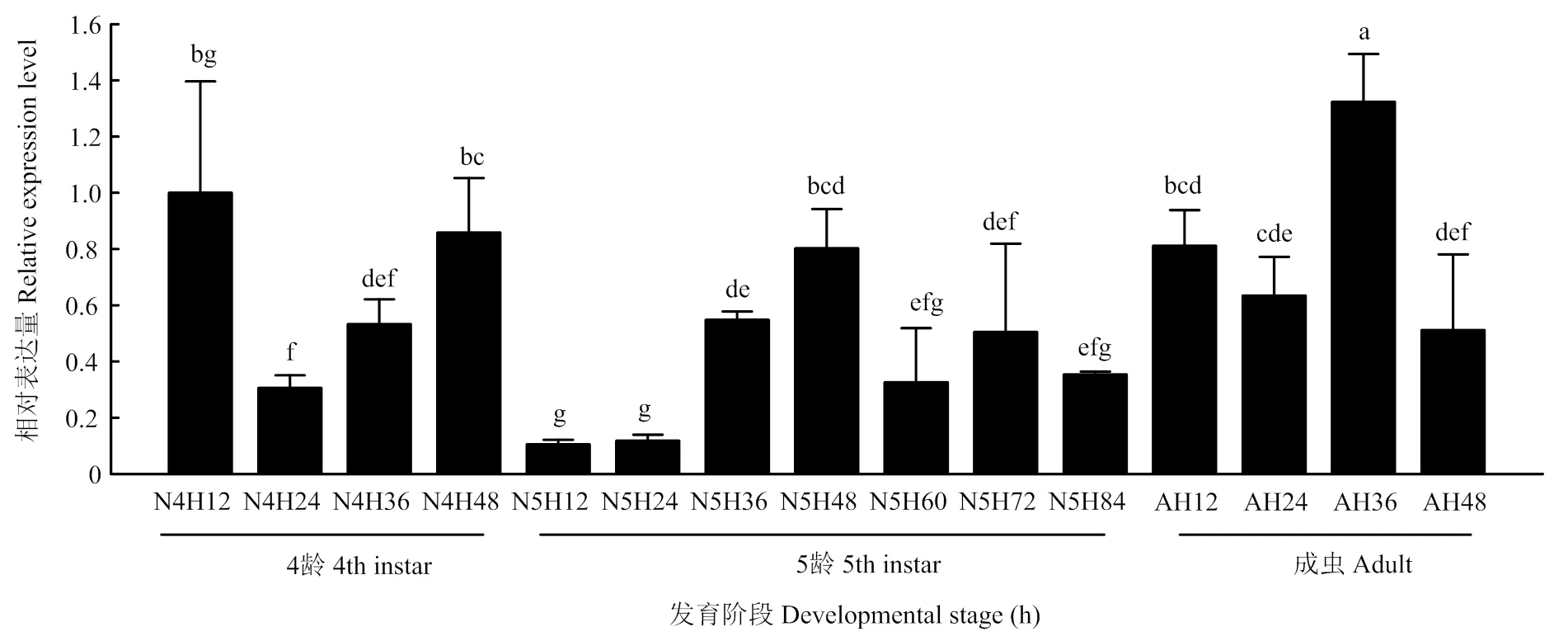
GSK-3在褐飞虱4龄(第1—4天)、 5龄(第1—7天)和成虫早期(第1—4天)不同发育天数的表达The relative expression of GSK-3 in different days of 4th instar nymphs (day 1 to day 4), 5th instar nymphs (day 1 to day 7), and early stages of adult (day 1 to day 4)
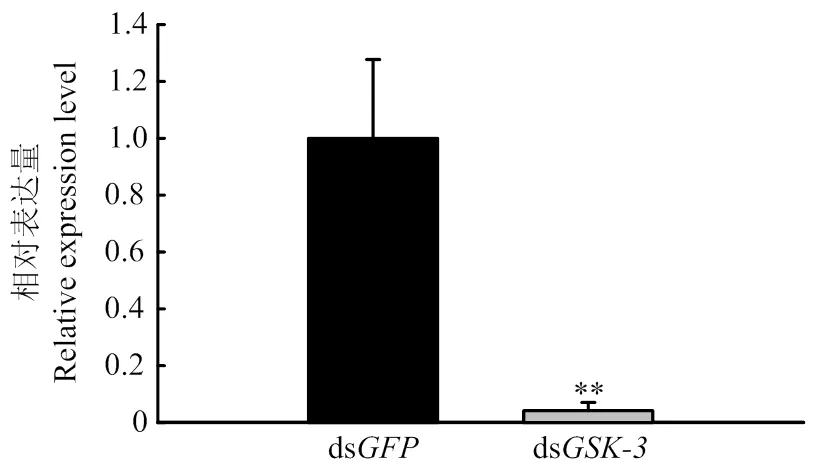
图3 RNAi后GSK-3的表达情况
2.4 GSK-3 RNAi后对糖原及葡萄糖含量的影响
与注射ds组相比较,的dsRNA 注射后48 h时糖原含量极显著下降(<0.01,图4-A),葡萄糖含量下降,但无显著差异(>0.05,图4-B)。
2.5 GSK-3 RNAi后对褐飞虱海藻糖代谢的影响
RNAi抑制表达后48 h,海藻糖含量及海藻糖酶活性检测结果显示,与注射ds的对照组相比,抑制后48 h褐飞虱海藻糖含量显著上升(<0.05,图5-A),可溶性和膜结合型两类海藻糖酶活性均显著下降(<0.05,图5-B、5-C)。
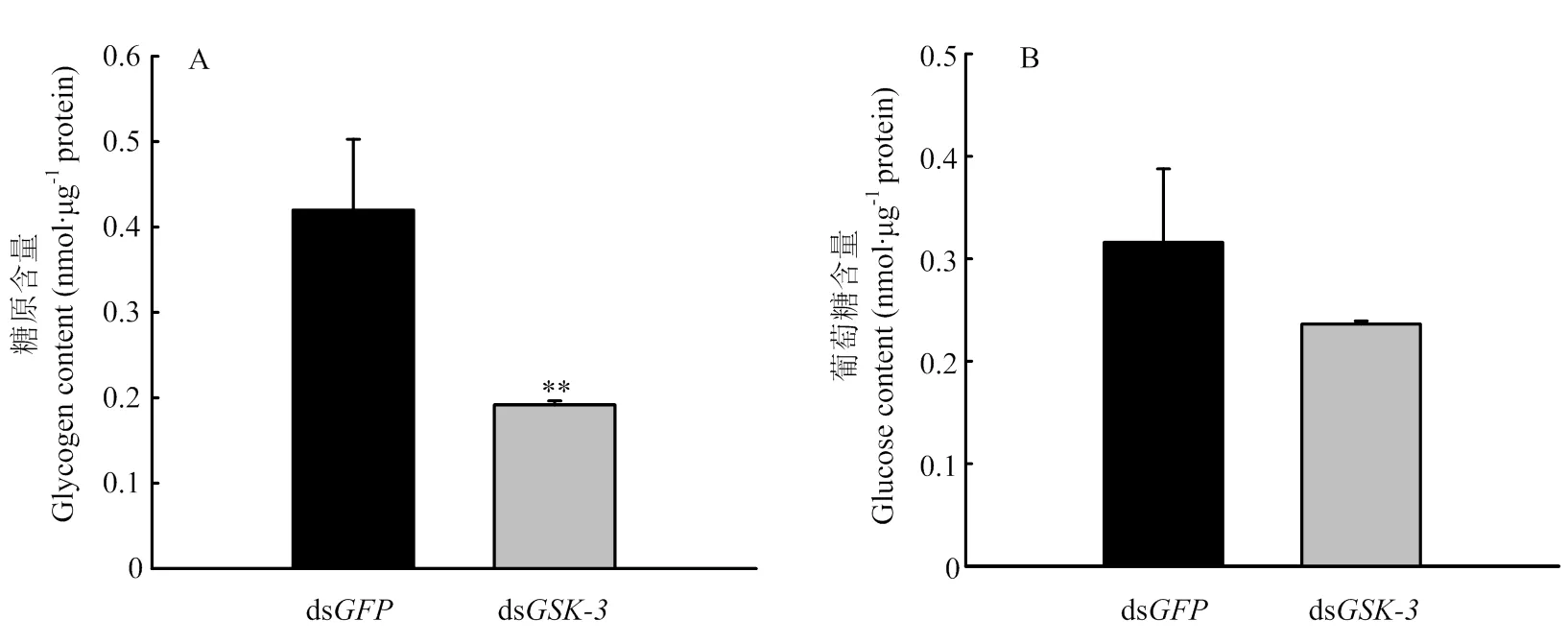
图4 GSK-3 RNAi后对糖原及葡萄糖含量的影响

图5 GSK-3 RNAi后对褐飞虱海藻糖代谢的影响
2.6 GSK-3 RNAi后褐飞虱海藻糖代谢通路及胰岛素信号通路中相关基因的表达变化
采用RNAi抑制褐飞虱的表达后,与注射ds相比较,qRT-PCR检测结果显示褐飞虱胰岛素信号通路及海藻糖代谢通路相关基因中的、、、、、表达量均显著或极显著下降(图6)。

图6 GSK-3 RNAi后褐飞虱海藻糖代谢通路及胰岛素信号通路相关基因的相对表达水平
3 讨论
昆虫中GSK-3主要作为糖原合成的一个重要限速酶,其序列相对比较保守[23]。本研究通过对GSK-3序列的结构特征进行分析,发现GSK-3为偏碱性蛋白,无信号肽结构,序列高度保守。前期研究发现褐飞虱海藻糖代谢途径中的和表达被抑制后,糖原的合成也同时受到影响,多表现为糖原含量下降[24],并且能够直接影响昆虫几丁质合成与蜕皮[25]。并且当糖原合成酶(GS)和糖原磷酸化酶(GP)表达受到抑制后,能够介导海藻糖代谢调控几丁质合成途径(待发表)。相关研究结果显示,家蚕幼虫在取食期GSK-3mRNA表达量相对较高,在蜕皮期表达量较低,在幼虫游走期表达量最低[23]。而且,褐飞虱蜕皮激素响应相关基因与其龄期表达模式有密切关系,对其蜕皮过程至关重要[26]。本研究中,褐飞虱在5龄初期和末期表达量相对较低。
褐飞虱不仅是一种重要的农业害虫,随着其基因组测序的完成[27],发现其非常适合作为基因功能研究的靶标昆虫[4-5,15]。RNA干扰是基因功能研究的有效工具,主要是通过显微注射dsRNA或siRNA抑制基因的表达[4],该技术已经广泛用于探索和研究昆虫的相关基因功能,当昆虫的关键发育基因被抑制后,其影响通常会表现在不同组织的表型上[5,28-31]。本试验中,褐飞虱dsRNA注射后48 h,该基因的表达与注射ds相比较,表达量极显著下降,表明RNA干扰效果明显。在前期研究中发现GSK-3参与胰岛素、Wnt/-连环蛋白、Hedgehog以及Notch等信号传导通路,在调控细胞的分化、代谢、凋亡以及基因表达等方面都起着重要作用[32]。GSK-3主要通过胰岛素受体底物-1(IRS-1)的Ser332位点实现对胰岛素信号通路的阻碍,从而抑制糖原合成[33]。本研究发现,被抑制后48 h糖原和葡萄糖含量极显著降低或下降,表明GSK-3能够调控糖原和葡萄糖的合成。GSK-3还能通过糖原合成酶磷酸化以及影响胰岛素信号通路从而抑制糖原的合成,而糖原与其他的糖类物质之间存在紧密的联系,它们可以通过酶的催化作用从而相互转化[10]。这一点从本研究中也得到了验证,当表达被抑制后,糖原和葡萄糖含量降低,转化为海藻糖而导致含量显著上升,作为其生理活动的能量来源。上述研究结果表明,GSK-3在多种细胞信号通路中都起到关键性的调节作用[28]。
GSK-3广泛存在于动物体内,主要在动物脑组织中表达,负责信号的传递[11,34-36]。在家蚕幼虫中注射家蚕素II时,其体内海藻糖浓度会降低,且海藻糖酶的活性得到提高;同时还能降低糖原含量和提高糖原酸化酶的活性[37],但是当家蚕成虫注射家蚕素时,其血淋巴中的海藻糖或脂质水平却没有受到影响[38]。本研究发现,当表达抑制后48 h,及的表达极显著下降,同时,2种海藻糖酶活性也显著下降,海藻糖含量上升,表现出一致性。另外,2个的表达也极显著下降,同时被抑制后48 h能够极显著降低或降低糖原、葡萄糖含量,这与前期相关的研究结果一致[39],说明可以通过调控TRE活性变化和表达来影响3种糖类物质含量。相关研究报道胰岛素进入昆虫体内后,先激活和,再激活磷脂酰肌醇激酶(PI3K),活化的PI3K催化磷脂酰肌醇的磷酸化,接着引起效应器Akt的磷酸化,并丧失磷酸化糖原合成激酶(GSK-3)活性,抑制其对糖原合成酶(GS)的磷酸化作用,促使GS变为有活性的分子,从而促进糖原的合成[15]。从本试验来看,表达抑制后,降低了及的表达量,从而影响糖原及其他糖类物质的合成,即表达抑制后能够下调胰岛素通路中的相关基因,从而调控海藻糖等糖类物质代谢。而抑制后,葡萄糖含量变化不显著,推测是因为褐飞虱体内还存在其他糖代谢途径,例如胰岛素信号通路的其他基因对褐飞虱糖代谢的调控等。对于胰岛素途径中的和,当的表达被抑制后,2个和4个的表达同样被抑制,间接表明能够调控的表达,其具体机制有待于进一步研究。
4 结论
RNA干扰后可以有效抑制褐飞虱体内靶标基因的表达;GSK-3能够降低海藻糖和糖原代谢相关基因的表达及海藻糖酶活性,从而降低糖原和葡萄糖含量,提高海藻糖含量,并调控昆虫海藻糖平衡。
[1] BARRION A T, LITSINGER J A. Taxonomy of rice insect pests and their arthropod parasites and predators//Heinrichs E A.. Wiley Eastern Ltd., India and IRRI, Manila, Philippines, 1994: 13.
[2] 赵颖, 黄凤宽, 童晓立, 庞雄飞. 水稻品种对褐飞虱不同生物型抗性的HPLC分析. 华南农业大学学报, 2005, 26(2): 52-55.
ZHAO Y, HUANG F K, TONG X L, PANG X F. HPLC analysis of rice variety resistance to different biotypes of., 2005, 26(2): 52-55. (in Chinese)
[3] WANG Y C, TANG M, HAO P Y, YANG Z F, ZHU L L, HE G C. Penetration into rice tissues by brown plant hopper and fine structure of the salivary sheaths., 2008, 129(3): 295-307.
[4] XI Y, PAN P L, YE Y X, YU B, XU H J, ZHANG C X. Chitinase-like gene family in the brown planthopper,., 2015, 24(1): 29-40.
[5] XI Y, PAN P L, ZHANG C X. The-N-acetylhexosaminidase gene family in the brown planthopper,., 2015, 24(6): 601-610.
[6] GHAFFAR M B, PRITCHARD J, FORD-LLOYD B. Brown planthopper (Stål) feeding behavior on rice germplasm as an indicator of resistance., 2011, 6(7): e22137.
[7] YASUGI T, YAMADAL T, NISHIMURA T. Adaptation to dietary conditions by trehalose metabolism in., 2017, 7: 1619.
[8] 安涛, 张洪志, 刘晨曦, 王孟卿, 陈红印, 张礼生. 胰岛素信号通路和FOXO调控烟蚜茧蜂海藻糖积累的机制初探//植保科技创新与农业精准扶贫——中国植物保护学会2016年学术年会论文集. 中国植物保护学会, 2016: 549.
AN T, ZHANG H Z, LIU C X, WANG M Q, CHEN H Y, ZHANG L S. Preliminary study on the mechanism of insulin signaling pathway and FOXO regulation of trehalose accumulation inAshmead//—. China Plant Protection Society, 2016: 549. (in Chinese)
[9] 于彩虹, 卢丹, 林荣华, 王晓军, 姜辉, 赵飞. 海藻糖——昆虫的血糖. 昆虫知识, 2008, 45(5): 832-837.
YU C H, LU D, LIN R H, WANG X J, JIANG H, ZHAO F. Trehalose—the blood sugar in insects., 2008, 45(5): 832-837. (in Chinese)
[10] PLOTKIN B, KAIDANOVICH O, TALIOR I, ELDAR-FINKELMAN H. Insulin mimetic action of synthetic phosphorylated peptide inhibitors of glycogen synthase kinase-3., 2003, 305(3): 974-980.
[11] MAQBOOL M, MOBASHIR M, HODA N. Pivotal role of glycogen synthase kinase-3: A therapeutic target for Alzheimer’s disease., 2016, 107: 63-81.
[12] COHEN P. Identification of a protein kinase cascade of major importance in insulin signal transduction.,, 1999, 354(1382): 485-495.
[13] CONTRERAS C J, SEGVICH D M, MAHALINGAN K, CHIKWANA V M, KIRLEY T L, HURLEY T D, DE PAOLI- ROACH A A, ROACH P J. Incorporation of phosphate into glycogen by glycogen synthase., 2016, 597: 21-29.
[14] 张妍, 阮杨, 周旭晨. Akt/GSK-3信号通路在高血压心肌肥厚中的作用. 中国分子心脏病学杂志, 2010, 10(1): 61-64.
ZHANG Y, RUAN Y, ZHOU X C. The roles of Akt/GSK-3signal pathway in myocardial hypertrophy., 2010, 10(1): 61-64. (in Chinese)
[15] 薛建. 褐飞虱翅型分化分子机理研究[D]. 杭州: 浙江大学, 2015.
XUE J. Molecular mechanism of the wing dimorphism of the brown planthopper,[D]. Hangzhou: Zhejiang University, 2015. (in Chinese)
[16] 巩涛, 刘德海, 王继雯, 杨文玲, 解复红. 海藻糖合成途径及分子生物学研究进展. 中国农学通报, 2016, 32(14): 62-67.
GONG T, LIU D H, WANG J W, YANG W L, xIE F H. Advances in trehalose biosynthesis pathways and application of molecular biology technique., 2016, 32(14): 62-67. (in Chinese)
[17] AVONCE N, MENDOZA-VARGAS A, MORETT E, ITURRIAGA G. Insights on the evolution of trehalose biosynthesis., 2006, 6: 109.
[18] 陈静, 张道伟. 德国小蠊两个海藻糖合成酶基因的克隆、组织分布及温度诱导表达分析. 昆虫学报, 2015, 58(10): 1046-1053.
CHEN J, ZHANG D W. Molecular cloning, tissue distribution and temperature-induced expression of two trehalose-6-phosphate synthasegenes in(Blattodea: Blattellidae)., 2015, 58(10): 1046-1053. (in Chinese)
[19] MITSUMASU K, KANAMORI Y, FUJITA M, IWATA K, TANAKA D, KIKUTA S, WATANABE M, CORNETTE R, OKUDA T, KIKAWADA T. Enzymatic control of anhydrobiosis- related accumulation of trehalose in the sleeping chironomid,., 2010, 277(20): 4215-4228.
[20] SHUKLA E, THORAT L J, NATH B B, GAIKWAD S M. Insect trehalase: physiological significance and potential applications., 2015, 25(4): 357-367.
[21] ARMSTRONG A R, DRUMMOND-BARBOSA D. Insulin signaling acts in adult adipocytes via GSK-3and independently of FOXO to controlfemale germline stem cell numbers., 2018, 440(1): 31-39.
[22] SATO A, SHIBUYA H. Glycogen synthase kinase 3functions as a positive effector in the WNK signaling pathway., 2018, 13(3): e0193204.
[23] 张瑜, 李京, 杜孟芳. 家蚕GSK3氨基酸序列分析及其mRNA转录水平研究. 西北农林科技大学学报(自然科学版), 2012, 40(4): 25-30.
ZHANG Y, LI J, DU M F. Amino acid sequence analysis and study on mRNA transcription level ofglycogen synthase kinase 3., 2012, 40(4): 25-30. (in Chinese)
[24] ZHANG L, WANG H J, CHEN J Y, SHEN Q D, WANG S G, XU H X, TANG B.and: gene cloning and expression analysis reveal their role in trehalose metabolism in the brown planthopper,Stål (Hemiptera: Delphacidae)., 2017, 17(2): 42.
[25] 张露, 朱世城, 郑好, 沈祺达, 王世贵, 唐斌. 褐飞虱海藻糖酶基因在表皮几丁质代谢中的调控作用. 中国农业科学, 2017, 50(6): 1047-1056.
ZHANG L, ZHU S C, ZHENG H, SHEN Q D, WANG S G, TANG B. Regulatory function of trehalase genes on chitin metabolism in the cuticle of., 2017, 50(6): 1047-1056. (in Chinese)
[26] 李凯龙. 褐飞虱蜕皮及变态信号途径相关基因的功能分析[D]. 北京: 中国农业科学院, 2016.
LI K L. Functional analysis of genes involved in molting and metamorphosis signal pathways in[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[27] XUE J, ZHOU X, ZHANG C X, YU L L, FAN H W, WANG Z, XU H J, XI Y, ZHU Z R, ZHOU W W, PAN P L, LI B L, COLBOURNE J K, NODA H, SUETSUGU Y, KOBAYASHI T, ZHENG Y, LIU S, ZHANG R, LIU Y, LUO Y D, FANG D M, CHEN Y, ZHAN D L, LV X D, CAI Y, WANG Z B, HUANG H J, CHENG R L, ZHANG X C, LOU Y H, YU B, ZHOU J C, YE Y X, ZHANG W Q, SHEN Z C, YANG H M, WANG J, WANG J, BAO Y Y, CHENG J A. Genomes of the rice pest brown planthopper and its endosymbionts reveal complex complementary contributions for host adaptation., 2014, 15(12): 521.
[28] FRAME S, COHEN P. GSK 3 takes center stage more than 20 years after its discovery., 2001, 359(1): 1-16.
[29] FIRE A, XU S, MONTGOMERY M K, KOSTAS S A, DRIVER S E, MELLO C C. Potent and specific genetic interference by double- stranded RNA in., 1998,391(6669): 806-811.
[30] ZHU Q S, ARAKANE Y, BEEMAN R W, KRAMER K J, MUTHUKRISHNAN S. Functional specialization among insect chitinase family genes revealed by RNA interference., 2008,
[31] FU K Y, LI Q, ZHOU L T, MENG Q W, Lü F G, GUO W C, LI G Q. Knockdown of juvenile hormone acid methyl transferase severely affects the performance of(Say) larvae and adults., 2016, 72(6): 1231-1241.
[32] 周谊霞. DKD大鼠肾组织中GSK-3对GSK-Wnt通路与RANKL-NF-κB通路交互作用相关因子调控机制研究[D]. 贵阳: 贵州医科大学, 2015.
ZHOU Y X. GSK-3regulates positively of RANKL, NF-κB, OPN through the cross-talk of GSK-Wnt and RANKL-NF-κB pathway in renal tissue of the rats with DKD[D]. Guiyang: Guizhou Medical University, 2015. (in Chinese)
[33] LIBERMAN Z, ELDAR-FINKELMAN H. Serine 332 phosphorylation of insulin receptor substrate-1 by glycogen synthase kinase-3 attenuates insulin signaling., 2005, 280(6): 4422-4428.
[34] WOODGETT J R, COHEN P. Multisite phosphorylation of glycogen synthase. Molecular basis for the substrate specificity of glycogen synthase kinase-3 and casein kinase-II (glycogen synthase kinase-5)., 1984, 788(3): 339-347.
[35] KHAN I, TANTRAY M A, ALAM M S, HAMID H. Natural and synthetic bioactive inhibitors of glycogen synthase kinase., 2017, 125: 464-477.
[36] 刘军, 肖颂华, 刘中霖. 鼻咽癌放疗后神经损伤学. 广州: 广东科技出版社, 2010.
LIU J, XIAO S H, LIU Z L.. Guangzhou: Guangdong Science and Technology Press, 2010. (in Chinese)
[37] SATAKE S, MASUMURA M, ISHIZAKI H, NAGATA K, KATAOKA H, SUZUKI A, MIZOGUCHI A. Bombyxin, an insulin-related peptide of insects, reduces the major storage carbohydrates in the silk worm.:, 1997, 118(2): 349-357.
[38] SATAKE S, NAGATA K, KATAOKA H, MIZOGUCHI A. Bombyxin secretion in the adult silk moth: sex-specificity and its correlation with metabolism., 1999, 45(10): 939-945.
[39] XU H J, XUE J, LU B, ZHANG X C, ZHUO J C, HE S F, MA X F, JIANG Y Q, FAN H W, XU J Y, YE Y X, PAN P L, LI Q, BAO Y Y, NIJHOUT H F, ZHANG C X. Two insulin receptors determine alternative wing morphs in planthoppers., 2015, 519 (7544): 464-467.
Potential functions ofGSK-3 in Regulating glycogen and trehalose metabolism
DING YanJuan1, LIU YongKang1, LUO YuJia1, DENG YingMei1, XU HongXing2, TANG Bin1, XU CaiDi1,3
(1College of Life and Environmental Science, Hangzhou Normal University, Hangzhou 310036;2Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021;3College of Education, Hangzhou Normal University, Hangzhou 310036)
【Objective】The insect insulin signaling pathway can mediate glycogen synthase kinase 3 (GSK-3 or GSK3) to regulate glucose metabolism in the body, such as glycogen and trehalose, thereby controlling different life activities of insects. The objective of this study is to explore the regulation of glycogen synthase kinase on the metabolism of glycogen and trehalose in.【Method】 Firstly, based on the cDNA coding sequence of GSK-3, the GSK-3 amino acid sequence was translated using the ExPASy tool to predict the molecular weight and isoelectric point (pI) of the protein, and then the signal peptide was analyzed by SignalaIP4.1Server. Secondly, theraised in the author’s laboratory was collected every 12 hours from the 4th instar to 48-h-old adult. The total RNA ofwas extracted by Trizol method. The first strand DNA was synthesized according to the reverse transcription kit, and 18S was used as the internal reference gene. The relative expression ofdifferent ages at mRNA level was detected by quantitative real-time PCR (qRT-PCR). Then, double-stranded RNA (dsRNA) was microinjected intowith RNAi technology to inhibit the, andof dswas injected as a control group. The expression ofwas detected by qRT-PCR 48 h after injection to determine the inhibitory effect. In addition, thewas taken 48 h after injection, and the change of trehalose, glucose, glycogen content and trehalase (TRE) activity inwas determined. Finally, the relative expression of related genes in insulin signaling pathway (including insulin receptor (), insulin-like peptides ()) and trehalose metabolism pathway (, trehalose-6-phophate synthase (), glycogen phosphorylase (), glycogen synthase ()) was detected by qRT-PCR to analyze the regulation of【Result】The open reading frame ofis 1 914 bp, encoding 637 amino acids; the predicted molecular weight of the protein is 69.25 kD, and the isoelectric point is 9.15. It is a basic protein with no signal peptide structure and the sequence is highly conserved. The results of developmental expression pattern showed that the expression ofwas inconsistent at different developmental stages, and the expression was low before and aftermolting of5th instar nymph.At 48 h after the dsRNA injection of, the expression ofdecreased significantly compared with the dsof the control group, indicating that the RNA interference effect was obvious. Glycogen content and two types of trehalase activity decreased significantly, while trehalose content increased significantly. It is speculated that glycogen and glucose are converted to trehalose as an energy source for their physiological activities.The results of qRT-PCR showed that the expression ofsignificantly decreased 48 h after the inhibition ofexpression, while the expression ofandextremely significant decreased. In addition, the expression of twogenes,andgenes all extremely significant decreased; the expression of twogenes and fourgenes in the insulin signaling pathway were also inhibited, indirectly indicating thatcan regulate the expression of. 【Conclusion】 The low expression ofcan regulate glycogen and trehalose metabolism by regulating insulin signaling pathway and trehalose metabolism pathway related gene expression. The relevant research results will help to explore more comprehensive molecular mechanisms for the regulation of the balance of trehalose and carbohydrates by insect glycogen synthase kinases such as.
; RNA interference (RNAi);glycogen synthase kinase 3; glycogen and trehalose metabolism; quantitative real-time PCR (qRT-PCR)
10.3864/j.issn.0578-1752.2019.07.011
2018-11-15;
2018-12-29
国家自然科学基金(31672081,31371996)、国家级大学生创新创业训练计划项目(201810346031)
丁艳娟,E-mail:dyj061004djy@163.com。通信作者徐彩娣,Tel:0571-28865680;E-mail:xucaidi001@163.com
(责任编辑 岳梅)

