不同糖源对葡萄试管苗蛋白激酶相关基因表达的影响
梁国平,李文芳,陈佰鸿,左存武,马丽娟,何红红,万鹏,安泽山,毛娟
不同糖源对葡萄试管苗蛋白激酶相关基因表达的影响
梁国平,李文芳,陈佰鸿,左存武,马丽娟,何红红,万鹏,安泽山,毛娟
(甘肃农业大学园艺学院,兰州 730070)
【目的】探究不同外源糖对葡萄试管苗生长发育及蛋白激酶基因转录调控的影响,应用转录组测序挖掘蛋白质磷酸化过程中的基因,为葡萄蛋白激酶相关基因功能的验证奠定一定基础。【方法】在基本培养基中分别添加2%的蔗糖、葡萄糖和果糖,以无糖为对照,分别命名为S20、G20、F20和CK,经过37 d培养后,测定不同处理的地上和地下鲜重,并采用Illumina HiSeqTM2000对各处理叶片进行转录组测序,通过综合生物信息学分析(参考基因组比对、差异基因(DEGs)筛选、COG(Cluster of Orthologous Groups of proteins)注释、GO(Gene Ontology)注释等)筛选出蛋白激酶相关基因,通过qRT-PCR分析该蛋白激酶相关基因的表达特性。【结果】F20、G20和S20处理下的葡萄(‘红地球’)试管苗与CK相比,地上鲜重具有明显差异,且F20最高,而G20地下鲜重最高。SNP统计发现,转换是主要的变异类型,颠换次之,且发生在基因间区的SNP数量最多,其次是下游;剪接位点供体和同义终止发生的基因数量最少且相等。4个样品中共获得了2 633个差异基因,3个处理与CK相比,共有差异基因180个且被聚类为3组,第一组中127个基因仅在CK中高表达,第二组19个基因仅在G20下高表达,而第三组34个基因在3个处理下表达模式不尽相同。这些共有的差异基因在COG中注释到了26个基因并分在11个功能类别中,且主要注释在一般的功能类别中。在GO分类中,共有的基因分别被注释在分子功能、生物学过程和细胞组分的14、22和13个功能类别中。共筛选出7种蛋白激酶,分别为葡萄糖激酶(Glucokinase,GK)、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPKs)、钙调蛋白激酶(Calcineurin protein kinase,CBL)、蛋白磷酸酶2(Protein phosphatase 2,PP2A)、己糖激酶(Hexokinase,HXK)、组氨酸蛋白激酶(Histidine protein kinase,HPK)和酪氨酸激酶(Tyrosine kinase,TK),其不同激酶的基因在不同处理中具有各自的表达模式,经qRT-PCR验证,选择的20个差异基因中有17个基因表达与转录组测序结果相一致。【结论】在葡萄试管苗培养中,果糖较葡萄糖和蔗糖相比对生长较好。测序得出180个差异基因对3种不同糖均作出响应,这些基因在COG数据库中主要富集在膜酯转运和代谢、次级代谢物和碳水化合物的合成、转运和分解;GO中大多注释在蛋白激酶和氧化还原酶的活性中;筛选出了7种蛋白激酶,这些差异基因在数量、功能分类和代谢通路上对糖的响应各不相同。
RNA-Seq;外源糖;蛋白激酶;信号转导
0 引言
【研究意义】在植物组织培养过程中,糖不仅调节细胞内的渗透势,以维持水分平衡[1],而且还是组培植物能量的供应者[2]和信号分子[3]。SOLAROVA等[4]指出,糖是初期组培苗幼芽生长和叶片光合作用所必须的。在葡萄良种繁育和脱毒苗培育过程中,糖对试管苗的形态建成具有决定性作用[5]。然而,在常规培养过程中,试管苗处在自养与异养的混合状态[6],且不同外源糖的供应对试管苗的生长也具有不同的作用。蛋白激酶可将ATP分子上γ位的磷酸基团转移并共价结合到底物蛋白质氨基酸残基(丝氨酸、苏氨酸或络氨酸)上,从而实现蛋白质磷酸化并引起蛋白质构象的改变,进而调控蛋白质的活性和功能,最终对物质转运、能量代谢和信号转导等过程起到开关作用[7]。因此,通过转录组测序深入分析不同外源糖对葡萄试管苗生长发育的调控,特别是对蛋白激酶基因表达的影响,为在组培条件下深入了解糖对植株的形态建成和进一步优化碳源具有重要意义。【前人研究进展】在组织培养诱导植物产生不定根的过程中,培养基的初始糖浓度对其生长有很大影响,低浓度糖难以满足植物生长的需要,而高浓度糖则导致细胞内渗透压过高,最终对不定根的生长产生抑制[8]。邹英宁[9]在培养基中分别添加蔗糖、葡萄糖、山梨醇、果糖4种糖源对中国李进行诱导增殖的研究中得出,葡萄糖浓度为30 g·L-1和15 g·L-1对促进增殖及生长和生根率及生根倍数最好。在诱导白桦愈伤组织的过程中发现,培养基中分别添加20—30 g·L-1的蔗糖、葡萄糖和果糖后,其鲜重积累量均显著高于对照[10]。王思瑶等[11]研究了不同外源糖对柽柳丛生芽生长的影响,蔗糖浓度为10 g·L-1时有助于其丛生芽的生长。然而,KOZAI等[12]研究发现,将含有一片叶的单芽茎段葡萄试管苗继代在无糖培养基中也可生长。这些结果表明,不同外源糖对组培植物的生长发育具有不同的作用,且目的不同需求糖的种类也不尽相同。植物蛋白激酶在信号感知、传导、生长发育以及基因的表达调控中起重要作用。葡萄糖激酶(Glucokinase,GK)对葡萄糖具有特异性,在水稻[13]、豌豆[14]和马铃薯[15]中研究发现,该酶可优先磷酸化葡萄糖,从而提前进入糖酵解途径。促分裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)是一种丝氨酸/苏氨酸类蛋白激酶,它介导多种生物和非生物胁迫的相关信号通路,以磷酸化方式实现信号的级联放大,最后引起相应的生物学效应,对植物的生长发育起重要的调控作用[16]。类钙调磷酸酶B蛋白作为(Calcineurin B-like protein,CBL)Ca2+传感蛋白之一[17],以丝氨酸/苏氨酸蛋白激酶CIPK(CBL-interacting protein kinase)作为靶蛋白[18-19],并形成蛋白激酶复合物CBL-CIPK,调节下游基因的表达来维持细胞离子平衡[20]。在拟南芥突变体中研究发现,CBL-CIPK信号通路参与调控盐胁迫下Na+稳态分布和Na+、K+平衡[21]。蛋白磷酸酶2A(Protein phosphatase 2,PP2A)包含一系列丝氨酸/苏氨酸磷酸酶[22],该家族从酵母到哺乳动物在功能和结构上较为保守,并且在调节细胞的多种功能中起关键作用[23]。己糖激酶(Hexokinase,HXK)催化己糖磷酸化并使之参与糖酵解[24]。KARVE等[25]用RT-PCR法研究拟南芥HXK基因中不同家族成员在6种器官(幼叶、成熟叶、根、花、角果和茎)的表达情况发现,在所有器官中都具有较高的丰度;在叶中高表达,但在库组织中表达略低。在根和角果中丰度高,但低于。和表达量低于,且这两者在不同器官中表达丰度相近,仅在花中有表达。组氨酸蛋白激酶(Histidine protein kinase,HPK)是一个磷酸化组氨酸保守残基的信号传导酶家族[26],与它们的下游靶蛋白一起构成了双组分信号传导系统,响应各种生物和非生物胁迫[27]。酪氨酸激酶(Tyrosinekinase,TK)是细胞信号转导过程中最为重要的物质之一,对细胞调节、通讯和发育生物学方面具有重要的意义。在动物中研究发现,该酶的活性过高会导致其下游信号途径激活,从而使细胞转化、增殖、对抗细胞凋亡促进细胞生存,形成非正常组织[28],而植物中报道甚少。【本研究切入点】虽然前人已在组培中对碳源影响植物生长发育方面做了大量报道,目的是确定最适碳源和浓度,以达到商品化生产和降低组培成本,然而在分子水平研究不同外源糖对其生长的影响,特别是对蛋白磷酸化中基因表达的研究鲜有报道。【拟解决的关键问题】应用高通量测序手段,在分子层面深入分析在不同外源糖条件下‘红地球’葡萄(L Red Globe)试管苗叶片中转录本的变化,特别是蛋白激酶相关基因如何响应不同的外源糖,为研究糖对植物生长发育的调控奠定一定的理论基础。
1 材料与方法
1.1 试验材料及处理
本试验于2016—2017年在甘肃农业大学园艺学院果树生理与生物技术实验室进行,试验材料为本实验室保存的‘红地球’试管苗。
选择继代健壮、长势一致且无污染的试管苗,剪成单芽茎段(2—3 cm)并留一片叶,接种在不含糖以及含2%不同外源糖的50 mL MS培养基中,培养基分装在150 mL的三角瓶中,每瓶接1个外植体,外源糖分别为蔗糖、葡萄糖和果糖,以无糖为对照,基本培养基组分为:4.43 g·L-1MS+6 g·L-1琼脂+0.2 mg·L-1IAA,pH为5.8—6.0,分别命名为CK、S20、G20和F20,每个处理接种30瓶,培养条件为(25±1)℃,白炽光36 mmol·m-2·s-1光照16 h,黑暗8 h。经过37 d培养后,每个处理随机挑选9瓶长势一致的试管苗,测定其生物量,并迅速收集叶片液氮速冻,-80℃保存用于RNA的提取。每个处理进行3次生物学重复。
1.2 生物量测定
将培养37 d后的试管苗从培养基中取出,不损伤根系,从基部第一个芽处剪断,测定其地上鲜重。用蒸馏水将根系表面的培养基洗干净,后将根系在滤纸上轻轻滚动一圈,吸干表面多余水分,用于测定其地下鲜重,每个处理重复3次。
1.3 RNA提取和质检
RNA提取采用植物提取试剂盒(中科泰瑞生物技术有限公司,北京)并按操作说明书进行。用Nanodrop和Agilent 2100(安捷伦有限责任公司,美国)检测RNA的纯度、浓度及完整性。
1.4 cDNA文库的构建
cDNA文库构建参照本课题组前期的试验方案进行[29]。样品检测合格后,用带有Oligo(dT)的磁珠,通过A-T互补配对与mRNA的ployA尾结合的方式富集mRNA。随后加入Fragmentation Buffer将mRNA打断成短的片段。以打断的mRNA为模板,用六碱基随机引物合成第一条cDNA链,然后加入缓冲液、dNTPs和DNA polymerase I合成第二条cDNA链,随后利用AMPure XP beads纯化双链cDNA。纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,最后通过PCR富集得到cDNA文库。
1.5 cDNA库检及测序
文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库至1 ng·μL-1,随后使用Agilent 2100对文库插入片段的长度进行检测,插入片段大小符合预期后,使用qPCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol·L-1)。
库检合格后,采用Illumina HiseqTM2000进行测序,测序读长为PE100。
1.6 测序数据过滤
去除带测序接头的reads、无法确定碱基信息的比 例大于10%的reads及低质量reads(Qphred≤20的碱基数占整个read长度50%以上的reads)。
1.7 参考序列比对分析
利用TopHat将Clean Reads与指定的参考基因组进行序列比对[30],获取在参考基因组或基因上的位置信息以及测序样品特有的序列特征信息。
1.8 差异基因筛选
通过设定FDR(False discovery rate)<0.01和∣Log2(FC)∣≥2作为筛选差异基因的阈值进行差异基因的筛选[31]。
1.9 qPCR验证
用差异基因的Gene ID对葡萄数据库(http://www. genoscope.cns.fr/externe/GenomeBrowser/Vitis/)检索并获得相应的CDS区,通过在线引物设计软件Primer 3 Input(http://primer3.ut.ee/)进行引物设计,引物见表1。对1.3的RAN使用Primer ScriptTMRT regent Kit with gDNA Eeaser(TaKaRa)试剂盒并按照说明书进行反转录获得cDNA,并用SYBR Primer Ex TaqTMII(TaKaRa)试剂盒说明书进行定量,定量PCR仪为Light Cycler® 96 Real-Time PCR System(Roche,瑞士)。内参基因为(GenBank accession no. CB973647)。引物由生工生物工程股份有限公司合成。反应程序为:95℃预变性30 s,95℃变性10 s,60℃退火30 s,72℃延伸30 s,40个循环,重复3次。反应结束后分析荧光值变化曲线及熔解曲线。基因的相对表达量采用2-ΔΔCT计算[32]。
2.0 统计分析
试验结果数据经Excel 2010整理,统计分析采用单因素ANOVO的Duncan’s法,显著性水平为<0.05,用Origin 9.0作图。
2 结果
2.1 不同外源糖对葡萄试管苗生长量的影响
以CK为对照,在2%的不同外源糖处理下,葡萄试管苗经37 d培养后,地上和地下生长具有明显差异。其中地上鲜重表现出显著差异,且在F20下生物量最大,而S20和G20处理下无显著变化。地下的鲜重在S20和G20下没有显著差异,而F20与两个处理均表现出显著差异(图1-A、B)。
2.2 测序数据统计
对4个样品的转录组测序共获得21.53 Gb Clean Data,各样品Clean Data均达到4.69 Gb,不同处理获得的Clean reads分别是:CK为19 840 139条,S20为19 619 720条,G20为24 923 975条和F20为20 579 635条。Q30碱基百分比均在90.26%以上(表2)。表明测序质量较好,可以用于后期的数据分析。
2.3 SNP/InDel分析
SNP是个体基因组DNA同一位置单个核苷酸变异(转换、颠换、插入和缺失)所引起的多态性。对不同外源糖处理葡萄测序结果的单个核苷酸变异位点进行统计(表3),4个样品的SNP数量分别为:403 332、489 805、358 014和331 527个,且主要发生的变异类型是转换,其频率在65.89%—67.18%,而颠换频率在32.82%—34.11%。进一步对不同的SNP事件数量进行统计,结果表明发生在基因间区的SNP数量最多,为238 351个;其次是发生在下游的,为42 382个;而剪接位点供体和同义终止发生最少,且相等。(图2)。

不同小写字母表示不同糖处理水平上差异显著(P<0.05)。下同

表2 转录组测序数据

表3 SNP位点统计

图2 SNP注释分析
通过InDel注释分类,结果如图3所示。2%的不同外源糖处理‘红地球’测序结果与参考基因组比对后,共获得15种InDel类型,有21 479个差异表达基因的InDel类型为其他类型,而发生在基因间区的数量最多,为16 824个,其次是在下游,为3 343个;密码子改变与缺失、终止获得及剪接位点受体这3类事件的数量最少,都为1个。
2.4 可变剪接事件分析
对每个样品存在的可变剪接类型统计,结果如图4所示。不同外源糖处理下的葡萄试管苗中,其第一个外显子可变剪接和最后一个外显子可变剪接事件数量最多,其次是单内含子滞留,而多外显子跳跃(模糊边界)和单外显子跳跃(模糊边界)事件数量最少。
2.5 差异基因表达分析
通过设定FDR和Log2(FC)两个阈值对不同外源糖处理的葡萄试管苗测序结果进行差异基因筛选,共获得2 633个差异基因,其中共有的差异基因为180个(图5-A)。对共有的差异基因以Log2(FPKM)值进行表达量分析(图5-B),所有基因被聚类为3组,第一组包括127个基因,仅CK中高表达,而其余处理下均下调表达;第二组包括19个基因,仅在G20下高表达,其余处理中均下调;第三组的34个基因,与CK相比表达模式不尽一致,且表达在处理之间具有明显差异。

图3 InDel注释分析
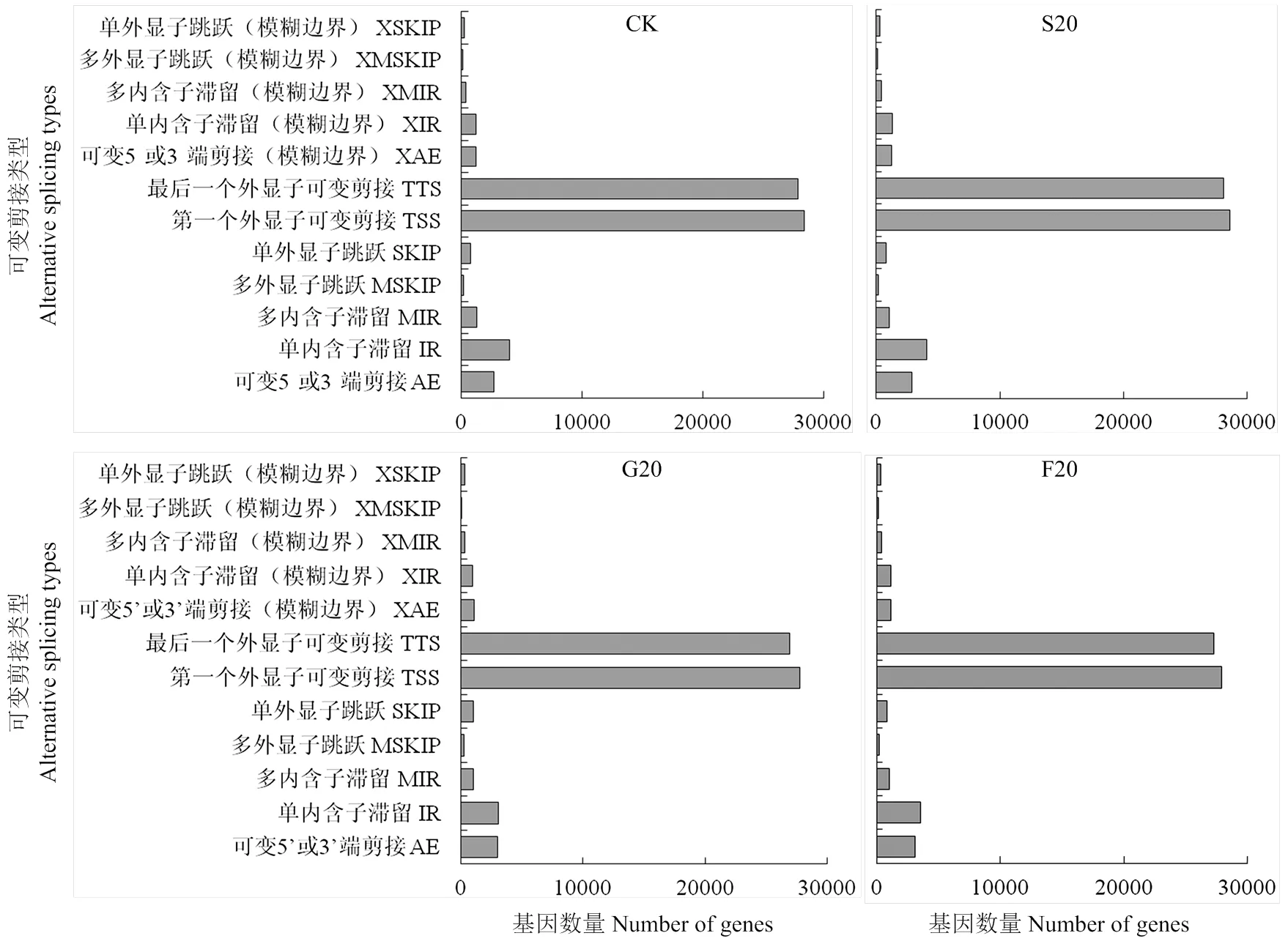
图4 可变剪接分析
2.6 差异基因的COG分析
将共有的180个差异基因进行COG注释,结果仅注释到了26个,包括6个上调基因和20个下调基因(图6)。其中,注释到一般功能预测的差异基因数量最多,为10个,其次是次级代谢物的合成、转运和分解,包括4个上调和3个下调差异基因。在转录,能量产生和转运,氨基酸转运和代谢、翻译后修饰、蛋白质周转、分子伴侣和防御机制4个功能分类中各注释到1个基因。

图5 差异基因的Venn图和共有差异基因的表达分析

图6 差异基因COG分析
2.7 差异基因的GO富集分析
通过对共有的差异基因进行GO功能注释,发现这些差异基因主要被注释在分子功能(14)、生物学过程(22)和细胞组分(13)功能类别中(图7)。在分子功能中,注释在ATP结合(ATP binding (GO: 0005524))、丝氨酸/苏氨酸蛋白激酶活性(protein serine/threonine kinase activity (GO: 0004674))和氧化还原酶活性(oxidoreductase activity (GO: 0016491))的基因数量最多;生物学过程中,注释在蛋白质磷酸化(protein phosphorylation (GO: 0006468))、氧化还原过程(oxidation-reduction process (GO: 0055114))和碳水化合物代谢过程(carbohydrate metabolic process (GO: 0005975))的基因个数分别为23、20和10个,而在细胞组分中,细胞外区域(extracellular region (GO: 0005576))、质膜(plasma membrane (GO: 0005886))占比最高。在分子功能中也注释到了蛋白激酶活性(protein kinase activity (GO: 0004672))、6-磷酸果糖激酶活性(6-phosphofructokinase activity (GO: 0003872))和生长因子激活(growth factor activity (GO: 0008083))等。生物学过程中也注释到了负调控细胞程序性死亡(negative regulation of programmed cell death (GO: 0043069))、果糖6-磷酸代谢过程(fructose 6-phosphate metabolic process (GO: 0006002))及生长发育等(developmental growth (GO: 0048589))功能类别。

2.8 7个蛋白激酶差异基因表达
蛋白激酶对植物的生长具有重要的作用。通过对本次测序结果进行筛选,获得了7种与植物生长发育相关的蛋白激酶基因,包括GK的2个基因、MAPKs的34个基因、CBL的6个基因、PP2A的6个基因、HXK的6个基因、HPK的14个基因和TK的164个基因(图8-A—G,G图基因名称见电子版附件)。与CK相比,2个GK基因在S20处理中上调表达(图8-A)。MAPKs中的、、、、和在CK中上调表达,而在其余处理中均下调表达,S20下的4个基因包括、、和较CK、G20和F20表达量高(图8-B)。CBL中的分别在CK和S20中出现下调,而在S20和F20中均上调表达(图8-C)。有5个PP2A,包括、、、及仅在G20中上调表达,其余处理下均出现下调(图8-D)。在HXK中,与CK相比在S20中仅有和为下调表达,其余的4个基因为上调表达(图8-E)。在HPK中,仅在CK中高表达,而在S20、G20和F20中出现低表达,、、、和只在S20中上调,而、、、和只在G20中上调(图8-F)。TK的164个基因在不同的处理中,表达具有明显差异(图8-G)。
2.9 qRT-PCR验证
选择了20个差异基因包括MAPK(5个)、HXK(1个)、PP2A(4个)、HPK(2个)和TK(8个)进行qRT-PCR分析,结果如图9所示。有3个基因分别为GSVIVG01015297001()GSVIVG01009192001()和GSVIVG01014110001()在不同的外源糖处理下,表达趋势与转录组测序结不一致,其余的17个基因基本一致,表明测序结果可靠。
3 讨论
糖对植物的形态建成和基因表达调控是其代谢产生的效应。近年来研究表明,糖作为信号分子在胞内形成不同信号转导途径,将信号转导到细胞核或细胞器中目标基因的转录起始位点上,控制相关基因的转录,引起相应的生理生化变化,从而调控植物的生长和发育[33]。本次测序共获得21.53 Gb Clean Data,各样品Clean Data均达到4.69 Gb。对SNP统计发现,获得转换和颠换的SNP覆盖率分别为65.89%—67.18%和32.82%—34.11%不等。在注释到的15种InDel类型中,除21 479个差异基因的InDel类型未知外,最多的是发生在基因间区和下游中,获得终止、密码子改变与缺失和剪接位点受体这三类事件的数量最少,均为1个差异基因。可变剪接能够使一个转录单位形成多个转录本和蛋白同系物,从而增加转录本和蛋白质的复杂性,这是导致真核生物基因和蛋白质数量较大差异的重要原因[34]。对本次测序结果进行可变剪接分析得出,12种可变剪接事件中TTS和TSS数量最多,其次是IR,而MSKIP和XMSKIP事件最少。
进行COG注释,可从基因组水平上寻找直系同源体,预测未知的ORF生物学功能,并提高基因注释的准确性和完整性[35]。对筛选出的180个共有的差异基因通过COG注释,共获得了26个基因,包括6个下调和20个上调,且注释到最多的是一般功能预测,而转录相关和信号转导机制功能类别次之,最少的则是核苷酸转运与代谢和染色体结构与活力,在细胞核结构、细胞运动和胞外结构中均没有注释到差异基因,这一结果与张雪等[36]研究山葡萄果皮着色的转录组注释结果基本一致,表明转录和信号转导对植物生长发育和果实着色的调控具有重要作用。GO注释分类发现这些差异基因主要被注释在分子功能、生物学过程和细胞组分的12、22和13个功能类别中。在分子功能中,注释到丝氨酸/苏氨酸蛋白激酶活性的基因数量较多,其次是氧化还原酶活性;在生物学过程中,注释到蛋白质磷酸化、氧化还原过程和碳水化合物代谢过程的基因个数分别为21、20和7个,而在细胞组分中,细胞外区域和质膜占比最高,达到11.2%和5.6%,这一结果与魏利斌等[37]在研究芝麻发育转录组分析结果一致。

大量研究表明蛋白质的磷酸化与去磷酸化过程在细胞的信号识别与转导中起重要作用,它是生物体中普遍存在的一种调节机制,几乎涉及所有的生理和病理过程,如糖代谢、细胞的生长发育、光合作用、基因表达等[38]。本研究通过设定差异基因阈值,筛选出了与植物生长发育相关的7种蛋白激酶,包括GKs、MAPKs、CBLs、PP2A、HXK、HPK和TK,这些蛋白激酶基因在不同外源糖处理下表达各不相同。
GKs能催化葡萄糖和其他己糖的磷酸化,包括果糖、甘露醇和半乳糖,也在大肠杆菌、酵母、哺乳动物和植物中充当信号感受器[39-40]。在拟南芥中研究发现,与线粒体胞膜相关的HXK1感知葡萄糖存在后,会特异性地下调编码与光合作用过程中相关蛋白质基因的表达,例如Chl a/b结合蛋白(CAB)和Rubisco小亚基(RBCS)等[41-42]。在本研究中,GK中的两个基因在S20处理中上调表达,在G20处理中下调,这一结果与CHO等[43]的研究一致。HXK作为双功能酶存在于所有的有机体中,它不仅磷酸化己糖转变为己糖6磷酸,而且对糖信号的感知具有重要作用[44]。对测序结果进行HXK筛选得出,G20下分别有两个和与其余3个处理相比均上调表达,表明这几个基因较其余的处理更能快速感应葡萄糖的存在。
PP2A在植物中具有多重作用,例如对细胞周期性进程的调控,根皮质细胞伸长,组织发育和植物对生物和非生物胁迫的反应等[45]。RAZAVIZADEH等[46]研究发现,在不同程度的干旱胁迫和4 μmol·L-1的ABA处理下均表现出显著上调。本研究中对PP2A进行差异基因筛选,获得6个差异表达基因,其中、、、及仅在G20中上调表达,其余处理均出现下调,且与对照相比,在果糖中出现上调趋势。拟南芥中研究发现,CIPK9与CBL3相互作用有助于在低K+胁迫下细胞K+的动态平衡,且CBL2和CBL3的过表达提高了对低K+的敏感性[47],而本研究筛选到的6个CBL中,、和在G20下低表达,另一个、和却表现出上调,表明这些基因在响应不同的外源糖时表达模式不尽相同。
在植物中,由环境条件或激素改变产生的信号均是通过MAPKs所介导的级联反应进行传递的[48]。通过遗传和生化方法研究发现,MAPKs不仅参与生物和非生物胁迫的信号转导,而且还参与激素对生长发育信号的转导过程[49]。如今,MAPKs已在大量植物物种中被发现,表明MAPKs级联信号转导机制在高等植物中也非常保守[50]。通过转录组测序,本研究筛选到了MAPKs的34个差异表达基因,其中、、、、和在CK中上调表达,而在其余处理下均下调表达。HPKs是一个大的信号转导酶家族,能够在保守的组氨酸残基上自磷酸,并与其下游的靶蛋白形成双组分信号系统响应生物和非生物胁迫[51]。本研究筛选到了10个组氨酸蛋白激酶基因,通过聚类分析发现,、、、和只在S20中上调,而、、、和只在G20中上调,表明这些基因对响应不同的糖具有明显选择性。酪氨酸(Tyr)磷酸化是动物体内受体酪氨酸激酶(RTKs)介导信号转导的关键分子开关[52],在植物中虽然缺乏典型的RTKs,但是拥有数百个与动物具有相似结构域结构的RTKs[53]。最近研究表明,在植物中酪氨酸磷酸化对于调控诱导免疫过程(PTI)的信号传递具有重要作用[54]。本研究筛选到酪氨酸蛋白激酶的164个差异基因,这些基因在响应不同的外源糖时具有各自的表达模式。
应用qRT-PCR对测序结果挑选了20个基因进行验证,发现有17个基因的表达趋势与测序结果一致,表明转录组测序结果可靠,这为通过基因表达研究蛋白激酶响应不同外源糖,并深入分析糖在植物生长发育中的作用提供了理论依据。
4 结论
本研究应用RNA-Seq技术对不同外源糖处理下的葡萄试管苗进行测序分析,共获得了2 633个差异基因,有180个差异基因对3种不同外源糖都作出响应,且共有的这些基因表达对糖源具有选择性。筛选到了7种蛋白质磷酸化相关的基因,这些差异基因在数量、功能分类和代谢通路上对糖的响应各不相同,且有各自的选择表达特异性,为丰富糖在调节植物生长发育及进一步探究蛋白质磷酸化响应外源糖提供了参考。
[1] KADLECEK P, RANK B, TICHA I. Photosynthesis and photoprotection inL. in vitro-grown plantlets., 2003, 160(9): 1017.
[2] RUAN Y L. Sucrose metabolism: Gateway to diverse carbon use and sugar signaling., 2014, 65: 33-67.
[3] YUE C, CAO H L, WANG L, ZHOU Y H, HUANG Y T, HAO X Y, WANG Y C,WANG B, YANG Y J, WANG X C. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season., 2015, 88: 591-608.
[4] SOLAROVA J, POSPHILSILOVA J, CATSKY J, SANTRUCEK J. Photosynthesis and growth of tobacco plantlets independence on carbon supply., 1989, 23(4): 629-637.
[5] SMEEKENS S, MA J K, HANSON J, ROLLAND F. Sugar signals and molecular networks controlling plant growth., 2010, 13(3): 273-278.
[6] NGUYEN Q T, KOZAI T, NIU G, NGUYEN U V. Photosynthetic characteristics of coffee () plantletsin response to different CO2concentrations and light intensities., 1999, 55: 133-139.
[7] 张曦, 林金星, 单晓昳. 拟南芥无机氮素转运蛋白及其磷酸化调控研究进展.植物学报, 2016, 51(1): 120-129.
ZHANG X, LIN J X, SHAN X Y. Progress in inorganic nitrogen transport proteins and their phosphorylation regulatory mechanism in, 2016, 51(1): 120-129. (in Chinese)
[8] 尹双双, 高文远, 王娟, 刘辉, 左北梅. 药用植物不定根培养的影响因素. 中国中药杂志, 2012, 37(24): 3691-3694.
YIN S S, GAO W Y, WAN J, LIU H, ZUO B M. Influencing factors on culture of medicinal plants adventitious roots., 2012, 37(24): 3691-3694. (in Chinese)
[9] 邹英宁. 不同碳源对中国李离体培养的影响. 安徽农业科学, 2010, 38(4): 1720, 1776.
ZOU Y N. Effect of different carbon sources on the culture of Chinese plum ().s, 2010, 38(4): 1720, 1776. (in Chinese)
[10] 王博, 范桂枝, 詹亚光, 李康. 不同碳源对白桦愈伤组织生长和三萜积累的影响. 植物生理学通讯, 2008, 44(1): 97-99.
WANG B, FAN G Z, ZHAN Y G, LI K. Effects of different carbon sources on callus growth and accumulation of triterpenoids in Birch ()., 2008, 44(1): 97-99. (in Chinese)
[11] 王思瑶, 崔瞳肸, 翟睿, 林香雨, 李欣, 孙璐, 詹亚光, 尹静. 不同碳源对柽柳丛生芽生长、三萜及黄酮物质积累的影响. 植物生理学报, 2017, 53 (12): 2189-2196.
WANG S Y, CUI T X, ZHAI R, LIN X Y, LI X, SUN L, ZHAN Y G, YIN J. Effects of different carbon sources on the growth and accumulation of triterpenoids and flavonoids in tufted buds of., 2017, 53(12): 2189-2196. (in Chinese)
[11] 王爱民, 刘文, 傅中滇. 不同碳源对红边朱蕉组培苗生长的影响. 徐州师范大学学报 (自然科学版), 2003, 21(3): 76-78.
WANG A M, LIU W, FU Z D. A preliminary study on the reducing cost of tissue culture plantlet of cordyline terminalis.(), 2003, 21(3): 76-78. (in Chinese)
[12] KOZAI T, KUBOTA C, JEONGB R. Environmental control for the large-scale production of plants through in vitro techniques., 1997, 51: 49-56.
[13] GUGLIELMINETTI L, PERATA P, MORITA A, LORETI E, YAMAGUCHI J, ALPI A. Characterization of isoforms of hexose kinases in rice embryo., 2000, 53(2): 195-200.
[14] TURNER J F, CHENSEE, HARISSON D D. Glucokinase of pea seeds., 1997, 480: 367-375.
[15] MARTINEZ-BARAJAS E, RANGALL D D. Purification and characterization of a glucokinase from young tomato (. Mill.) fruct., 1998, 205: 567-573.
[16] 赵书平, 谈宏斌, 鹿丹, 裴丽丽, 崔喜艳, 马有志, 陈明, 徐兆师, 张小红. 植物蛋白激酶介导的非生物胁迫和激素信号转导途径的研究进展. 植物遗传资源学报, 2017, 18(2): 358-366.
ZHAO S P, TAN H B, LU D, PEI L L, CUI X Y, MA Y Z, CHEN M, XU Z S, ZHANG X H. Research progress of plant protein kinase mediated abiotic stress and hormone signal transduction pathway., 2017, 18(2): 358-366. (in Chinese)
[17] RANTY B, ALDON D, GALAUD J P. Plant calmodulins and calmodulin-related proteins: Multifaceted relays to decode calcium signals., 2006, 1(3): 96-104.
[18] BATISTIC O, KUDLA J. Integration and channeling of calcium signaling through the CBL calciumsensor/CIPK protein kinase network., 2004, 219: 915-924.
[19] WEINL S, KUDLA J. The CBL-CIPK Ca2+-decoding signaling network: Function and perspectives., 2009, 184(3): 517-528.
[20] LUAN S. The CBL-CIPK network in plant calcium signaling., 2009, 14: 37-42.
[21] YU Q Y, AN L J, LI W L. The CBL-CIPK network mediates different signaling pathways in plants., 2014, 33: 203-214.
[22] KENTARO F, TOMOYUKI F, SHUN-ICHI Y, TETSU S, YUSUKE K, YUTAKA Y, HIROMI K, HITOSHI N, TOMOTAKE K. The PP2A-like protein phosphatase ppg1 and the far complex cooperatively counteract CK2-mediated phosphorylation of Atg32 to inhibit mitophagy., 2018, 23: 3579-3590.
[23] 刘钊, 贾霖, 贾盟, 关明俐, 曹英豪, 刘丽娟, 曹振伟, 李莉云, 刘国振. 水稻PP2Ac类磷酸酶蛋白质在盐胁迫下的表达. 中国农业科学, 2012, 45(12): 2339-2345.
LIU Z, JIA S, JIA M, GUAN M L, CAO Y H, LIU L J, CAO Z W, LI L Y, LIU G Z. Expression on profiling of rice PP2Ac type phosphatase proteins in seedlings under salt-stressed conditions., 2012, 45(12): 2339-2345. (in Chinese)
[24] 雍彬, 何兵, 徐攀, 虞传洋, 王东. 甘薯基因的克隆、组织表达及生物信息分析. 四川大学学报(自然科学版), 2014, 51(2): 378-384.
YONG B, HE B, XU P, YU C Y, WANG D. Cloning, organ-specific expression pattern and sequence analysis ofgene in sweet potato.(), 2014, 51(2): 378-384. (in Chinese)
[25] KARVE A, RAUH B L, XIA X. Expression and evolutionary features of the hexokinase gene family in., 2008, 228(3): 411-425.
[26] HERICOURT F, CHEFDOR F, DJEGHDIR I, LARCHER M, LAFONTAINE F, COURDAVAULT V, AUGUIN D, COSTE F, DEPIERREUX C, TANIGAWA M, MAEDA T, GLEVAREC G, CARPIN S. Functional divergence of poplar histidine-aspartate kinase hk1 paralogs in response to osmotic stress., 2016, 17(12): 2061.
[27] WOLANIN P M, THOMASON P A, STOCK J B. Histidine protein kinases: Key signal transducers outside the animal kingdom., 2002, 3(10): reviews3013.1.
[28] HUPFELD T, CHAPUY B, SCHRADER V, BEUTLER M, VELTKAMP C, KOCH R, CAMERON S, AUNG T, HAASE D, LAROSEE P, TRUEMPER L, WULF G G. Tyrosinekinase inhibition facilitates cooperation of transcription factor SALL4 and ABC transporter A3 towards intrinsic CML cell drug resistance., 2013, 161(2): 204.
[29] MAO J, LI W F, MI B Q, DAWUDA M M, CALDERON-URREA A, MA Z H, ZHANG Y M, CHEN B H. Different exogenous sugars affect the hormone signal pathway and sugar metabolism in ‘Red Globe’ (L.) plantlets grown in vitro as shown by transcriptomic analysis., 2017, 246: 537-552.
[30] KIM D, PERTEA G, TRAPENLL C, PIMENTEL H, KELLEYR R, SALZBERG S L. TopHat2: Accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions., 2013, 14(4): R36.
[31] ANDERS S, HUBER W. Differential expression analysis for sequence count data., 2010, 11(10): R106.
[32] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative and the 2-ΔΔCTmethod., 2001, 25: 402- 408.
[33] ROLLAND F, BAENA-GONZALEZ E, SHEEN J. Sugar sensing and signaling in plants: Conserved and novel mechanisms., 2006, 57: 675-709.
[34] FILICHKIN S A, HAMILYON M, DHARMAWARDHANA P D, SINGH S K, SULLIVAN C, BEN-HUR A, REDDY A S N, JAISWAL P. Abiotic stresses modulate landscape of poplar transcriptome via alternative splicing, differential intron retention, and isoform ratio switching., 2018. doi: 10.3389/fpls. 2018.00005.
[35] 贾新平, 孙晓波, 邓衍明, 梁丽建, 叶晓青. 鸟巢蕨转录组高通测序及分析. 园艺学报, 2014, 41(11): 2329-2341.
JIA X P, SUN X B, DENG Y M, LIANG L J, YE X Q. Sequencing and analysis of the transcriptome of., 2014, 41(11): 2329-2341. (in Chinese)
[36] 张雪, 唐铭浩, 陈蒙, 李春艳, 刘海峰. 山葡萄不同着色时期果皮转录组测序分析. 果树学报, 2017, 34(7): 781-789.
ZHANG X, TANG M H, CHEN M, LI C Y, LIU H F. Sequencing analysis of transcriptome ofduring different periods of coloration., 2017, 34(7): 781-789. (in Chinese)
[37] 魏利斌, 苗红梅, 张海洋. 芝麻发育转录组分析. 中国农业科学, 2012, 45(7): 1246-1256.
WEI L B, MIAO H M, ZHANG H Y. Transcriptomic analysis of sesame development., 2012, 45(7): 1246-1256. (in Chinese)
[38] PROUD C G. Phosphorylation and signal transduction pathways in translational control., 2018. doi: 10.1101/cshperspect.a033050.
[39] IRWIN D M, TAN H. Evolution of glucose utilization: Glucokinase and glucokinase regulator protein., 2014, 70(1): 195-203.
[40] GUTIERREZNOGUES A, GARCIAHERRERO C M, ORIOLA J,VINCENT O, NAVAS M A. Functional characterization of MODY2 mutations in the nuclear export signal of glucokinase., 2018, 1864(7): 2385-2394.
[41] KAWAI S, MUKAI T, MORI S, MIKAMI B, MURATA K. Hypothesis: structures, evolution, and ancestor of glucose kinases in the hexokinase family., 2005, 99(4): 320-330.
[42] MOORE B, SHEEN J. Role of theglucose sensor, 2003, 300(5617): 332-336.
[43] CHO Y H, YOO S D, SHEEN J. Regulatory functions of nuclear hexokinase1 complex in glucose signaling., 2007, 127(2): 579-589.
[44] KELLY G, SADE N, DORON-FAIGENBOIM A, LERNER S, SHATIL-COHEN A, YESELSON Y, EGBARIA A, KOTTAPALLI J, SCHAFFER A A, MOSHELION M, GRANOT D. Sugar and hexokinase suppress expression of PIP aquaporins and reduce leaf hydraulics that preserves leaf water potential., 2017, 91: 325-339.
[45] HU R B, ZHU Y F, SHEN G X, ZHANG H. Overexpression of thegene confers increased salt tolerance in., 2017, 12(2): e1276687.
[46] RAZAVIZADEH R, SHOJAIE B, KOMATSU S. Characterization of, mRNA expression and growth patterns in, under drought stress and abscisic acid., 2018(1): 1-13.
[47] LIU L L, REN H M, CHEN L Q, WANG Y, WU W H. A protein kinase, calcineurin B-like protein-interacting protein Kinase9, interacts with calcium sensor calcineurin B-like Protein3 and regulates potassium homeostasis under low-potassium stress in., 2013, 161(1): 266-277.
[48] COLCOMBET J, HIRT H. Arabidopsis MAPKs: A complex signalling network involved in multiple biological processes., 2008, 413(2): 217-226.
[49] ANDREASSON E, ELLIS B. Convergence and specificity in theMAPK nexus., 2010, 15(2): 106-113.
[50] SINGHA H S, CHAKRABORTY S, DEKA H. Stress induced MAPK genes show distinct pattern of codon usage in,and., 2014, 10(7): 436-442.
[51] WOLANIN P M, THOMASON P A, STOCE J B. Histidine protein kinases: Key signal transducers outside the animal kingdom., 2002, 3(10): reviews3013.1.
[52] LIM W A, PAWSON T. Phosphotyrosine signaling: Evolving a new cellular communication system., 2010, 142: 661-667.
[53] LIN W W, LI B, LU D P, CHEN S X, ZHU N, HE P, SHAN L B. Tyrosine phosphorylation of protein kinase complex BAK1/BIK1 mediatesinnate immunity.2014, 111(9): 3632-3637.
[54] REDDY M M, RAJASEKHARAN R. Serine/threonine/tyrosine protein kinase fromis dependent on serine residues for its activity., 2007, 460(1): 122-128.
Effects of Different Sugar Sources on Protein Kinase Gene Expression in Grape Plantlets
LIANG GuoPing, LI WenFang, CHEN BaiHong, ZUO CunWu, MA LiJuan, HE HongHong, WAN Peng, AN ZeShan, MAO Juan
(College of Horticulture, Gansu Agricultural University, Lanzhou 730070)
【Objective】To explore the effects of different exogenous sugars on the growth and development of grape plantlets and the regulation of protein kinase gene transcription, the candidate genes were tapped in the process of protein phosphorylation by using transcription, which made a foundation for the verification of grape protein kinase-related gene function.【Method】Sucrose (2%), glucose (2%) and fructose (2%) were added to the basic medium, and the free-sugar treatment was as control, which were named as S20, G20, F20 and CK, respectively. After 37 days of culture, the fresh weight of the leaf-stem and root under different treatments was determined. Transcriptome sequencing of each treated foliages was performed by using Illumina HiSeqTM2000, and a series of protein kinases related genes were screened by integrated bioinformatics analysis, including reference genomic alignment, differentially expressed gene (DEGs) screening, COG (Cluster of Orthologous Groups of proteins) annotation, GO (Gene Ontology) annotation, etc., and the expression characteristic of these genes were further analyzed by qRT-PCR. 【Result】Compared with CK, ‘Red Globe’ grape plantlets under F20, G20 and S20 treatments exhibited significant differences in the fresh weight of leaf-stem, and the highest was obtained by F20 treatment, while the weight of fresh root under G20 was the highest. The SNP statistics found that the Transition was the main type of mutation, the second was Transversion. The highest number of SNPs that occurred in the Intergenic, and the next was the Upstream. Splice_Site_Donor and Synonymous_Stop events occurred with the least number of genes and equal. A total of 2 633 deferentially expressed genes were obtained in the 4 samples. The Venn diagram showed that there were a total of 180 differential genes under the 3 treatments compared with CK, and these genes were clustered into 3 groups. In the first group, 127 genes were only highly expressed under CK. The 19 genes of the second group were only highly expressed under G20, while the expression patterns of the 34 genes in third group were different under three treatments. The common 180 differential genes were annotated with 26 genes in the COG database to 11 functional categories, and these DEGs were mainly enriched in general functional categories. In the annotation of GO, the common genes were annotated in 14, 22 and 13 functional categories of molecular function, biological process and cellular component, respectively. Seven kinds of protein kinases were screened by this sequencing, including Glucokinase (GK), Mitogen-activated protein kinases (MAPKs), Calcineurin protein kinase (CBL), Protein phosphatase 2 (PP2A), Hexokinase (HXK), Histidine protein kinase (HPK) and Tyrosine kinase (TK), and these different protein kinases genes showed their own expression patterns among different treatments. By qRT-PCR analysis, 17 out of 20 screened genes expression were consistent with the transcriptome sequencing results. 【Conclusion】Compared with glucose and sucrose, fructose was the best sugar during grape culture process. The sequencing results showed that 180 DEGs all responded to three different sugars. In the COG annotation, these genes were mainly enriched in membrane ester transport and metabolism, the synthesis, transport and decomposition of secondary metabolites and carbohydrates. In the GO databases, the most of common DEGs were annotated in the activities of protein kinases and oxidoreductases. Seven protein kinases were identified, which were selectively in responses to different exogenous sugars in quantity, functional, category and metabolic pathways, and had their own choice of expression specificity.
RNA-seq; exogenous sugar; protein kinase; signaling transduction
10.3864/j.issn.0578-1752.2019.07.001
2018-07-25;
2018-10-15
国家自然科学基金(31460500)、甘肃省科技重大专项计划(18ZD2NA006-4)、甘肃省现代水果产业体系岗位专家项目(GARS-SG-3)
梁国平,Tel:18298344227;E-mail:1143016341@qq.com。通信作者毛娟,E-mail:maojuan@gsau.edu.cn
(责任编辑 赵伶俐)

