根系局部NaCl处理对葡萄植株伤害度、Na+积累和碳氮分配的影响
孙红,姜亦文,于昕,相广庆,姚玉新
根系局部NaCl处理对葡萄植株伤害度、Na+积累和碳氮分配的影响
孙红,姜亦文,于昕,相广庆,姚玉新
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安 271018)
【目的】盐胁迫严重影响果树作物产量及品质。自然条件下,土壤中盐分浓度不均一,同一植株根系不同部位所处的盐环境不同。本文旨在测定根系局部盐处理对葡萄植株的伤害程度,并从Na+积累特性和碳氮分配角度揭示非处理侧根系缓解盐伤害的机理。【方法】利用分根栽培控制根系盐环境,根系两侧NaCl浓度(mmol·L-1)设置为0/0、0/50、50/50、0/100、100 /100 5种处理。通过测定叶绿素、丙二醛(MDA)和叶绿素荧光参数来反应植株伤害程度;通过测定Na+含量、离子流和根域介质电导率来检测Na+体内运转特性;通过测定氮肥利用率和碳氮分配率分析不同盐处理下各组织碳、氮水平。【结果】处理15 d和30 d时,双侧均匀盐处理显著降低叶绿素含量,提高叶片和根系MDA水平;同浓度单侧盐处理能有效缓解叶绿素下降和MDA积累。Fv/Fm、ETR等叶绿素荧光参数测定表明了相似的结果。以上结果表明,单侧盐处理下,非处理侧根系能有效减轻盐对葡萄植株的伤害。处理15 d时,各种方式的NaCl处理均不同程度增加了根系和叶片Na+含量;尤其是在单侧盐处理下,非处理侧根系Na+含量显著增加;与同浓度双侧均匀盐处理相比,单侧盐处理显著降低了叶片Na+水平,100 mmol·L-1单侧盐处理显著降低了处理侧根系Na+浓度。非盐处理对照根系Na+流为内运;处理24 h时,双侧盐处理的根系外排Na+,100 mmol·L-1单侧盐处理下非处理侧根系Na+流转变为外运。此外,单侧盐处理下,非处理侧根系周围栽培介质电导率较对照显著提高。以上结果表明,处理侧根系吸收的Na+能从非处理侧根系排出体外,避免处理侧根系和叶片Na+大量积累。根系双侧NaCl处理显著降低了氮肥利用率,且与处理浓度有关;单侧盐处理能减缓氮肥利用率的下降,并且0/100 mmol·L-1处理下,非处理侧根系氮肥利用率较对照显著提高。双侧盐处理尤其是100 mmol·L-1重度盐胁迫不利于氮向叶片和根中分配,而促进了氮向多年生蔓中分配,利于氮的储存。而单侧盐处理降低了多年生蔓中氮的储藏,同时缓解了叶片和根系中氮分配率的下降。双侧盐处理降低了叶片和根中碳分配率,单侧盐处理能缓解叶片碳分配率的下降,提高盐处理下根系碳分配率。50和100 mmol·L-1盐处理对一年生蔓和多年生蔓碳的分配率具有不同的影响,50 mmol·L-1单、双侧盐处理提高了多年生蔓的碳分配率,而100 mmol·L-1单、双侧处理降低了多年生蔓的碳分配率。【结论】与均匀盐处理相比,同浓度单侧盐处理对葡萄植株的伤害程度较轻。盐处理侧根系吸收的Na+可运输到非处理侧根系,进而排出体外,降低叶片Na+积累水平。非处理侧根系能缓解盐胁迫导致的叶片和根系碳、氮分配率的下降。
葡萄;局部盐处理;伤害程度;Na+离子流;碳氮分配
0 引言
【研究意义】盐胁迫是最主要的非生物胁迫之一,严重影响作物的生长、产量和品质。植物盐胁迫响应及代谢改变依赖于所处的土壤盐环境。自然条件下,由于降水、灌溉、蒸腾等因素的影响,多数土壤盐分浓度不均一,同一植株不同根区所处的盐环境不同。研究不均匀盐环境下低盐或非盐区根系在缓解盐胁迫伤害中的作用及机理,对于揭示作物对不均一盐环境的响应机制和丰富抗盐机理具有重要意义,同时也为通过局部土壤改良开展盐碱地葡萄种植提供理论依据。【前人研究进展】土壤盐分主要导致渗透胁迫和离子毒害。盐胁迫首先产生渗透胁迫,影响水分吸收,导致细胞膨压损失;随着Na+和Cl-过度积累,在渗透的基础上产生离子毒害[1]。植物通过渗透调节来缓解渗透胁迫,其中最主要的方式是通过吸收无机离子来提高渗透势[2]。此外,大量研究表明,Na+液泡区隔化是防止叶片Na+毒害的重要保护措施[3]。再者,将Na+排到质外体或直接排出体外也是降低Na+过度积累的重要方式;在这个过程中,质膜H+-ATPase和Na+/H+运输载体起到关键作用[4]。碳、氮代谢是植物体内最主要的两大代谢过程。氮素是土壤营养元素的重要组分,是构成植物体内蛋白质及核酸的重要元素,氮素水平影响植物生长[5]。并且氮素对作物抗逆性具有重要的调节作用,供氮有利于减缓叶片光合作用的下降,提高耐盐能力[6]。光合是受盐影响的主要代谢过程之一[7];光合组织对胁迫高度敏感,各种胁迫均能影响光能捕获和碳固定及产生氧化胁迫[8]。碳代谢调节是植物适应胁迫的重要防御机制;比如,盐胁迫激活的黄瓜核心抗逆机制包括过度激发能的无害耗散和PSII光化学反应最适化等[9]。【研究切入点】根系对不均一盐胁迫的响应和调控已成为研究耐盐机制的重要方面[10],不均匀盐处理不仅对植株伤害较小,而且能通过提高水分吸收来促进植物生长[11]。目前关于植物对不均匀盐胁迫响应的研究相对较少,急需在不同作物上进一步评价和探讨机制。【拟解决的关键问题】本研究通过根系分根控制来评价不均匀盐胁迫对葡萄植株的伤害程度,并从Na+含量及碳、氮分配角度来研究不均匀盐处理缓解胁迫伤害的机制,以期为全面、深入认识不均匀盐胁迫对作物代谢的影响提供理论支撑。
1 材料与方法
试验于2017年在山东农业大学南校区实验基地进行。
1.1 试验材料及处理
本试验在温室大棚进行,试验材料为二年生‘克瑞森无核’葡萄扦插苗。移栽入盆前,首先修剪根系,使每个植株根系量基本相近,然后将每一株扦插苗的根系等量分成两部分,分别放入直径20 cm的黑色软塑料营养钵里,再将两个营养钵一并放入直径35 cm的塑料花盆内(图1);营养钵内栽培介质为田间1—10 cm表层土,pH 6.4,有机质含量10.85 g·kg-1, 氮、磷、钾含量分别为0.31、0.35、13.24 g·kg-1。待植株生长到6—8片叶时,选择长势相近的盆栽苗进行处理。
分区NaCl处理浓度(mmol·L-1)为0/0、0/50、50/50、0/100、100/100。0/50表示根系两侧NaCl浓度分别为0和50 mmol·L-1,其他依次类推。每个处理10盆,每2 d处理一次;首次盐处理后24 h测根尖离子流,处理7次(15 d)后,测定叶绿素荧光、叶绿素、叶片和根系MDA、碳氮分配等指标,处理14次(30 d)后,测定叶片叶绿素和MDA含量。
1.2 叶绿素含量、电导率、MDA含量测定
叶绿素、MDA含量以及电导率测定方法参照赵世杰等[12]。
1.3 叶绿素荧光参数测定
利用Dual-PAM 100便携式脉冲调制式荧光仪(Walz,德国)测定叶绿素荧光参数:选取植株中部功能叶,暗适应15 min,打开测量光,测得荧光F0;打开单饱和白光脉冲,测定最大荧光Fm;照射PAR为611 µmol·m-2·s-1的作用光及饱和脉冲光,仪器自动读取F0、F0′、Fm、Fm′、qP和ETR等参数。
1.4 Na+含量测定
根系(包含主根顶部及侧根)、功能叶于70℃干燥48 h,研磨后与硝酸和硫酸(4﹕1,V/V)混合提取,过滤,稀释,Na+含量用原子吸收分光光度计(Perkin Elmer AA300,PerkinElmer Inc.,Waltham,MA,USA)测定。

图1 分根栽培效果图
1.5 根尖Na+离子流测定
采用非损伤微测技术测定根系离子流速:在首次盐处理后24 h取根系顶端幼嫩部位,固定于灭菌的小培养皿中,加入4 mL离子流速基本测试液,没过测试根系0.1 mm,平衡根系10 min,然后将培养皿放在防震台的电极固定支架上,将电极放置于待测根系根尖近根表的位置,调整好最佳测试位置,直到在电脑显示屏上能看到清晰图像,并把参比电极放入培养皿测试液中,用屏蔽罩隔离防震台,启动软件,记录测试过程。利用旭月科技有限公司提供的ASET软件(ASET2.O Sciencewares,Fal-mouth, MA02540,USA)进行数据显示、图像获取、数据的预处理、电极三维位置调试和显微镜精细聚焦的步进控制等操作。
1.6 碳、氮分配率测定
13C脉冲标记在一个由透明农用塑料薄膜做成的标记室内进行,标记前检查标记室的封闭性。用注射器向装有0.2 g Ba2CO3的离心管中加入1 mL浓度为1 mol·L-1的HCl溶液。此后每隔0.5 h向其中注入一次HCl溶液,以维持CO2浓度,保持环境CO2浓度为360 µmol·L-1,标记时间持续4 h。15N标记用含15N的尿素溶液根施标记,将50 mL 0.4%的15N尿素溶液分别施入根系两侧栽培介质中。处理15 d后,样品经清水、洗涤剂、清水、1%盐酸、3次去离子水冲洗后,105℃杀青30 min,随后在80℃下烘干至恒重,粉碎后过0.25 mm筛,混匀后备用。13C和15N丰度用CNOHS同位素质谱仪(Thermo Fish,USA)测定。计算公式如下:
氮肥利用率(%)=Ndff×器官全氮量/施氮量;其中Ndff(%)=(植物中15N丰度-自然丰度)/(肥料中15N丰度-自然丰度)×100;
氮肥分配率(%)=各器官中从氮肥中吸收的氮量/总吸收氮量×100;
13C在各器官的分配率:13Ci(%)=13Ci/13C净吸收×100。
2 结果
2.1 根系局部NaCl处理对葡萄植株伤害程度评价
叶片叶绿素和MDA含量测定结果表明,处理30 d时,50和100 mmol·L-1NaCl双侧处理显著降低了叶绿素含量,增加了MDA含量。尤其是100 mmol·L-1双侧盐处理导致叶片叶绿素含量下降56.05%,MDA为对照1.12倍(图2-A、B),表明植株受到严重伤害。相比之下,同浓度的单侧盐处理能有效缓解叶绿素下降和MDA积累(图2-A、B)。此外,叶绿素荧光参数表明,处理后15 d,各种盐处理均未显著影响Fv/Fm和ETR,但100 mmol·L-1双侧盐处理下该值显著低于单侧盐处理(图2-C)。与对照相比,100 mmol·L-1双侧盐处理显著提高Wk值;双侧盐处理均显著降低qP值,单侧盐处理提高了qP值,但未达到显著水平(图2-D)。再者,单侧盐处理下,非处理侧根系MDA含量显著低于处理侧根系,与非处理对照无显著差异;并且单侧处理较双侧处理降低了处理侧MDA积累(图2-E)。以上数据表明,单侧盐处理能有效缓解NaCl对葡萄植株的伤害。
2.2 根系局部NaCl处理对Na+含量、Na+流及根际栽培介质电导率的影响
为了研究单侧盐处理缓解盐胁迫的机制,首先检测了不同处理对葡萄植株Na+含量的影响。与对照相比,不同方式的NaCl处理均不同程度增加了根系Na+含量(图3-A)。50和100 mmol·L-1NaCl双侧处理导致根系Na+浓度分别为对照的0.75和2.10倍。50和100 mmol·L-1NaCl单侧处理下,处理侧根系(0/50-50、0/100-100,表示方法下同)Na+浓度分别为对照的1.21和1.77倍,非盐处理侧Na+浓度也得到增加,尤其是0/100-0侧根系Na+浓度显著高于对照;表明Na+能从处理侧运输到非处理侧。并且,0/50-50侧Na+浓度显著高于50/50处理,表明中度盐处理下Na+向非处理侧的运输促进了处理侧Na+的吸收。相比之下,0/100-100侧根系Na+浓度显著低于100/100处理,表明高盐处理下Na+向非处理侧的运输缓解了处理侧Na+过度积累。此外,与双侧盐处理相比,单侧盐处理显著降低叶片Na+含量(图3-B)。
为了进一步分析单侧盐处理对根系Na+吸收、运输特性的影响,检测了不同处理后24 h根尖Na+离子流(图4-A)。非盐处理条件下,离子流为负值,表明根系吸收Na+。双侧盐处理下,根系外排Na+,并且外排速率与处理浓度相关。单侧盐处理下,处理侧根系外排Na+,0/50-0侧根系仍然吸收Na+,但吸收速率显著低于对照;0/100-0侧根系转变为外排Na+(图4-A)。此外,非处理侧根系周围栽培介质电导率显著提高,表明更多的离子被排到介质中(图4-B)。以上表明当处理侧根系吸收过量的Na+后,部分Na+运输到非处理侧,进而被排出根系。
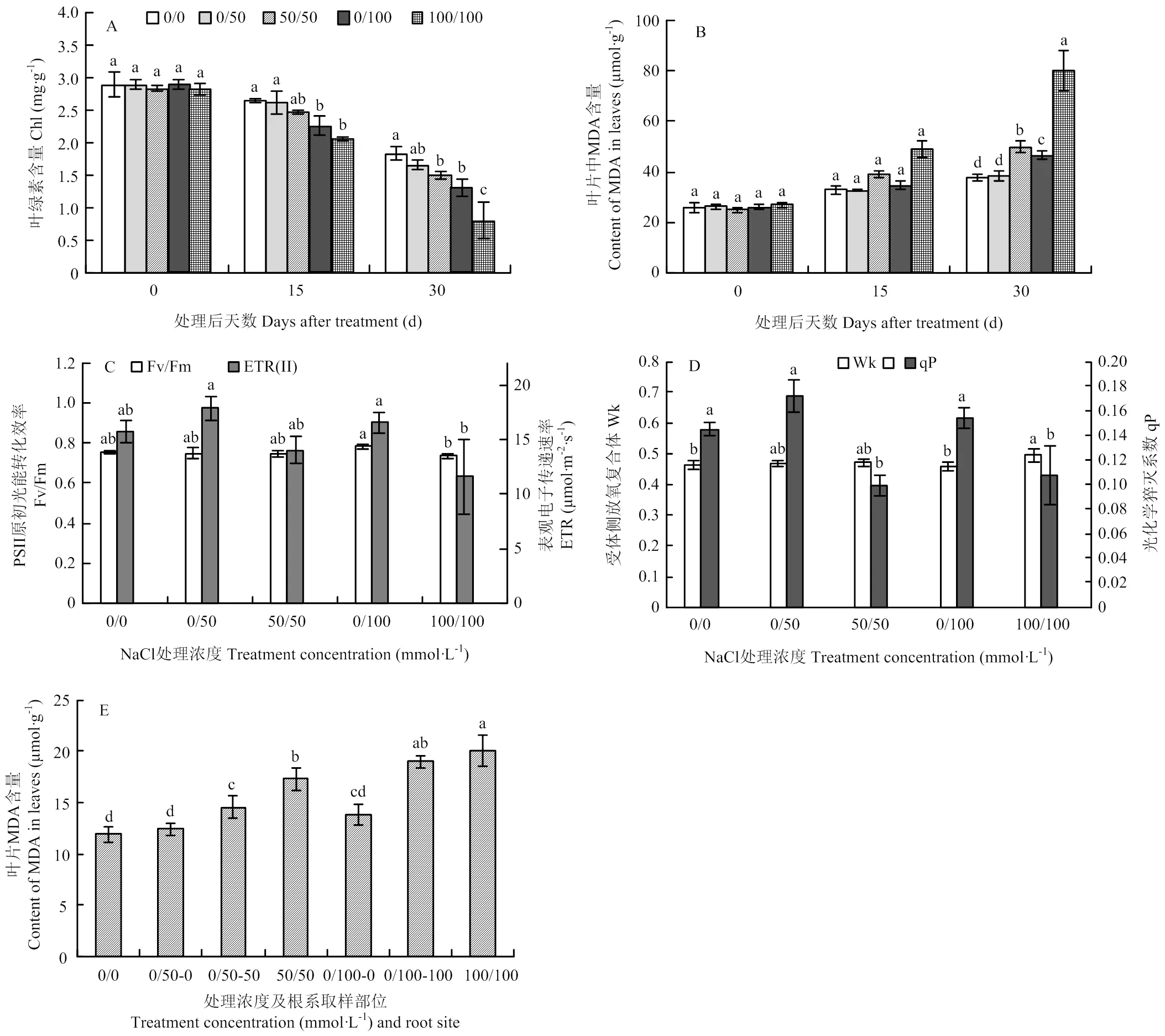
不同字母表示差异显著(P<0.05)。下同Values indicated by the different letters are significant at P<0.05. The same as below

图3 根系盐处理对葡萄根系(A)和叶片(B)中Na+含量的影响

图4 根系分区盐处理对葡萄根尖Na+离子流的影响
2.3 根系局部NaCl处理对葡萄氮肥利用率和分配率的影响
根系双侧NaCl处理显著降低了氮肥利用率,且浓度越高氮肥利用率越低;100 mmol·L-1双侧处理下,植株氮肥利用率仅为对照的56.19%(图5)。50 mmol·L-1NaCl单侧处理下,根系两侧氮肥利用率与对照均无显著性差异;而100 mmol·L-1单侧处理显著提高了非处理侧氮肥利用率,并且处理侧根系氮肥利用率显著高于同浓度双侧处理(图5)。

图5 根系局部NaCl处理对葡萄植株氮肥利用率的影响
与对照相比,50 mmol·L-1双侧盐处理对叶片氮分配率未产生影响,而100 mmol·L-1双侧处理则显著降低叶片氮分配率,为对照的81.42%;相比之下,单侧盐处理提高叶片氮分配率,但未达到显著水平。单、双侧盐处理不同程度提高了一年生蔓N分配率,50 mmol·L-1/50 mmol·L-1和0/100 mmol·L-1处理下差异达到显著水平。双侧盐处理促进氮向多年生蔓中分配,100 mmol·L-1处理下多年生蔓中氮分配率达到对照的1.89倍;相反,单侧盐处理降低多年生蔓氮分配率。所有盐处理均显著降低根系氮分配率。就单侧盐处理而言,非处理侧根系比处理侧具有相对较高的氮分配率;100 mmol·L-1单侧处理下,非处理侧为处理侧的2.01倍(表1)。
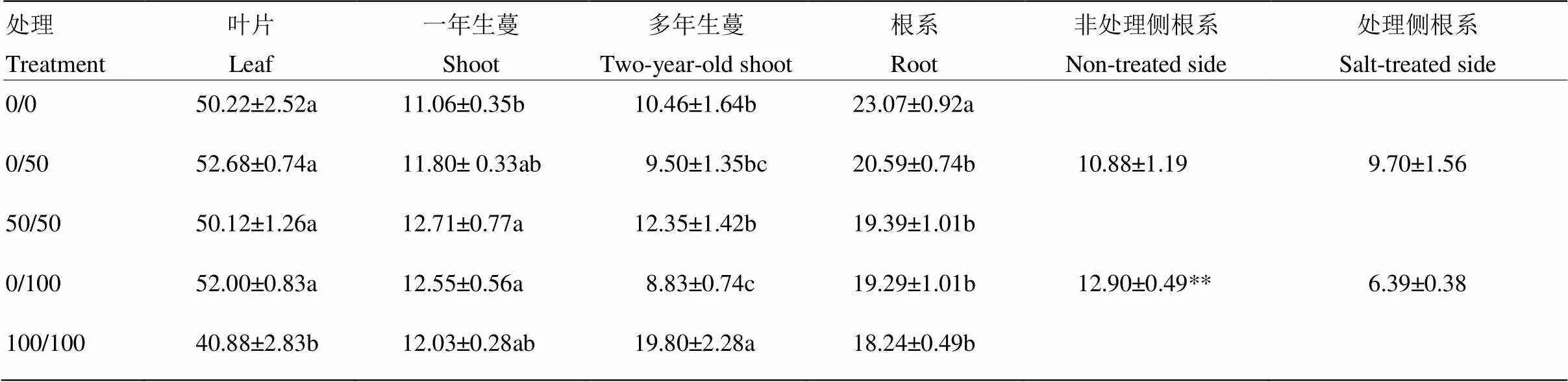
表1 根系局部盐处理对葡萄植株15N分配率(%)的影响
字母标记用于纵向比较同一组织不同处理的差异显著性,不同字母表示显著差异。**表示处理侧和非处理侧的差异极显著。下同
Small letter corresponds to the comparison of the same tissues with different treatments, and values indicated by the different letters are significant at<0.05. ** indicates the highly significant difference between the salt-treated and non-treated sides of roots. The same as below
以上数据表明,双侧盐处理尤其是100 mmol·L-1重度盐胁迫不利于氮向叶片和根中分配,而促进了氮向多年生蔓中分配,利于氮的储存。而单侧盐处理降低了多年生蔓氮的储藏,同时缓解了叶片和根系中氮分配率的下降。
2.4 根系局部NaCl处理对葡萄碳分配率的影响
与对照相比,双侧盐处理大幅度降低了碳向叶片分配,50和100 mmol·L-1处理下叶片碳分配率仅为对照的85%左右;单侧盐处理缓解叶片碳分配率的下降。盐处理对一年生蔓的碳分配率无显著影响,但在50和100 mmol·L-1处理间差异显著。50 mmol·L-1单、双侧盐处理提高了多年生蔓的碳分配率,而100 mmol·L-1单、双侧处理降低了多年生蔓碳分配率。50和100 mmol·L-1双侧盐处理不同程度降低了根系碳分配率,尤其是100 mmol·L-1双侧盐处理下根系碳分配率仅为对照的58.69%;相比之下,100 mmol·L-1单侧盐处理显著提高了根系碳分配率,处理侧和非处理侧碳分配率差异不显著(表2)。以上数据表明,单侧盐处理能缓解叶片碳分配率的下降,提高盐处理下根系碳分配率;50和100 mmol·L-1盐处理对一年生蔓和多年生蔓碳分配率具有不同的影响。
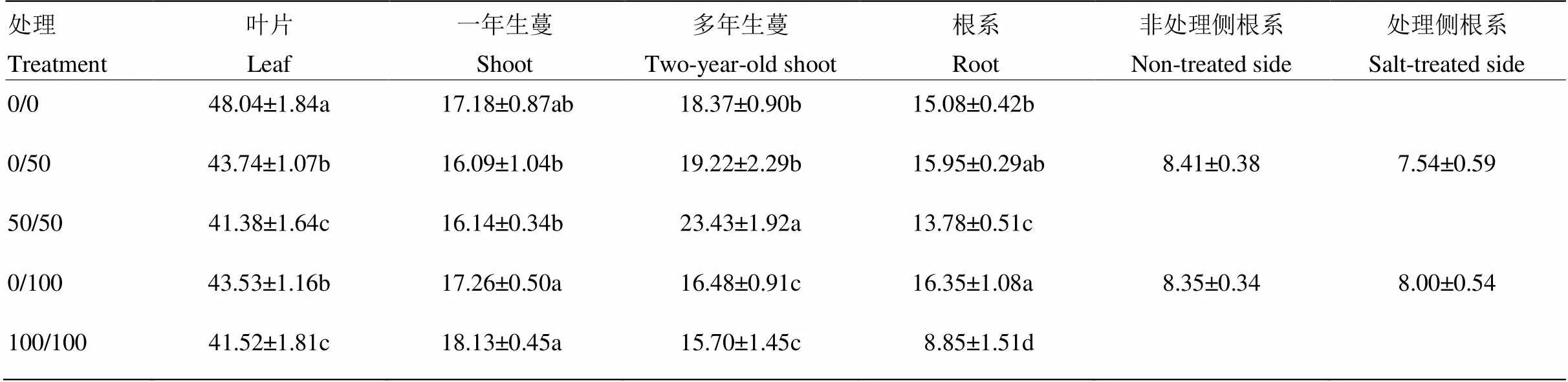
表2 局部盐处理对葡萄植株13C分配率(%)的影响
3 讨论
目前关于不均匀盐胁迫对作物伤害的研究很少,本文通过测定MDA、叶绿素和叶绿素荧光参数评价了单、双侧盐处理对葡萄植株的伤害程度。盐离子过度积累导致植株伤害,生物膜生理功能受损,致使植物生物膜透性增大和膜脂过氧化,产生MDA,电导率增大,叶绿素加速降解[13-14]。叶绿素荧光参数能反应光合组织受伤害部位及程度[15]。比如,Fv/Fm反映PSⅡ反应中心最大光能转换效率;Wk表示放氧复合体受伤害程度,其数值越高表示供体侧受伤害程度越严重;ETR(II)、qP分别代表了PSⅡ的电子传递效率和PSⅡ反应中心的开放程度。根据以上参数,在处理后15 d,单侧盐处理降低了盐对植株的伤害。尤其是在处理后30 d,100 mmol·L-1NaCl双侧处理对植株产生较大伤害,部分植株频临枯萎死亡;相比之下,100 mmol·L-1单侧盐处理能有效降低伤害程度。以上研究表明在不均一盐环境下,非盐区或低盐区根系能有效缓解高盐对植株的伤害。相关机理可能在于以下几个方面。
首先,本研究揭示了非盐区根系Na+外排能有效缓解高盐区根系和叶片Na+过度积累。在棉花和等作物[10,16-17]上也证实,根系在高盐区吸收的Na+可以通过低盐或非盐区根系排出体外,并降低叶片Na+积累,暗示不同作物对不均匀盐胁迫具有相似的响应机制。与根系相比,叶片更容易受Na+毒害[18]。非/低盐区根系降低叶片Na+积累的原因可能在于非/低盐区Na+外排降低了Na+上运,同时不均匀盐环境促进了Na+由茎向非处理根的再分配[3,16]。此外,在棉花等作物上发现,IAA、H2O2和ABA是低盐和高盐区根系交流的重要信号转导物质,在调节植株生长和调控Na+吸收、运输和外排上起重要作用[10]。葡萄根系施用ABA能改变根、茎等组织中Na+、Cl-等离子分配[19],暗示ABA调控盐胁迫下离子运输和外排。并且,抗逆响应不是由单一的信号物质控制,而是受ABA、H2O2等信号分子的互作调控[20];因此,推测非盐区和盐区间信号交流包含了不同信号物质间的交叉对话。
其次,盐胁迫严重影响根区氮等营养物质的转化、吸收和利用及水分吸收[21-22];本研究表明100 mmol·L-1NaCl单侧处理下,非处理根系具有较高的氮肥利用率。相似的,在盐浓度不均匀的环境下,棉花根系可从低盐区吸收水分和养分以供生长需要[16];在苹果等作物上研究也发现,一侧根系的水肥供应可不同程度地弥补盐区根系吸收功能下降导致的水肥亏缺[11,23]。因此,非处理侧根系的水肥供应可能是缓解葡萄盐伤害的重要保障。
本研究发现非处理侧根系能缓解叶片和根系碳、氮分配率的下降。胁迫下足量的碳、氮供应是提高植物抗逆和正常生长的重要保障,盐胁迫下氮素可用于合成更多的氨基酸,作为渗透调节物质提高抗性水平[24]。氮素是Rubisco和硝酸还原酶所必须的,足够的氮供应是胁迫条件下维持光合性能,防止氧化胁迫,增强植株抗性所必须的[25-26]。在盐胁迫下芥菜对氮的需求增加,足够的氮可以提高乙烯水平,调节脯氨酸含量,恢复光合性能,提高抗盐性[27]。本研究发现高盐胁迫下非处理侧氮肥利用率较对照显著提高,暗示了植株对氮的需求增加。另一方面,叶片糖代谢是盐影响的主要途径之一,包括各种糖分在内的碳水化合物积累是盐胁迫适应的重要措施[28]。可溶性糖本身可作为渗透调节物质,并且也能通过提高脯氨酸含量来提高盐抗性[29]。并且,碳、氮代谢紧密相连,氮代谢需要碳源和能量,同时为植物光合提供酶蛋白和光合色素[30]。尽管目前在其他作物上未见不均匀盐处理对作物碳、氮分配影响的研究,但碳、氮在抗逆过程中的重要作用足以表明非处理侧根系缓解根和叶碳、氮分配下降是提高葡萄抗盐能力的重要原因。
4 结论
与均匀盐处理相比,非处理侧根系能有效缓解NaCl对葡萄植株的伤害。盐区根系吸收的Na+可运输到非处理侧根系,改变根系离子流,进而排出体外,降低高盐区根系和叶片的Na+含量。非处理测根系能缓解盐胁迫导致的叶片和根系碳、氮分配率的下降,为生长器官提供足够养分或渗透调节物质。
[1] MUNNS R, TESTER M. Mechanisms of salinity tolerance., 2008, 59: 651-681.
[2] HARIADI Y, MARANDON K, TIAN Y, JACOBSEN S E, SHABALA S. Ionic and osmotic relations in quinoa (Willd.) plants grown at various salinity levels., 2011, 62: 185-193.
[3] BERTHOMIEU P, CONÉJÉRO G, NUBLAT A, BRACKENBURY W J, LAMBERT C, SAVIO C, UOZUMI N, OIKI S, TAMADA K, CELLIER F, GOSTI F, SIMONNEAU T, ESSAH P A, TESTER M, VÉRY A, SENTENAC H, CASSE F. Functional analysis of AtHKT1 in Arabidopsis shows that Na+recirculation by the phloem is crucial for salt tolerance., 2003, 22: 2004-2014.
[4] SUN J, CHEN S L, DAI S X, WANG R G, LI N Y, SHEN X, ZHOU X Y, LU K F, ZHENG S J, HU Z M, ZHANG Z K, SONG J, XU Y. NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt resistant and salt-sensitive poplar species., 2009, 149: 1141-1153.
[5] SULLIVAN P F. Evidence of soil nutrient availability as the proximate constraint on growth of treeline trees in northwest Alaska: Reply., 2016, 97(3): 803-808.
[6] 徐晨, 刘晓龙, 李前, 凌凤楼, 武志海, 张志安. 供氮水平对盐胁迫下水稻叶片光合及叶绿素荧光特性的影响. 植物学报, 2018, 53(2): 185-195. XU C, LIU X L, LI Q, LING F L, WU Z H, ZHANG Z A. Effect of salt stress on photosynthesis and chlorophyll fluorescence characteristics of rice leaf for nitrogen levels., 2018, 53(2): 185-195. (in Chinese)
[7] MUNNS R, JAMES R A, LAUCHLI A. Approaches to increasing the salt tolerance of wheat and other cereals., 2006, 57: 1025-1043.
[8] KUŹNIAK E, KORNAS A, GABARA B, ULLRICH C, SKLODOWSKA M, MISZALSKI Z. Interaction ofwith the intermediate C3-CAM plant., 2010, 69: 137-147.
[9] CHOJAK-KOŹNIEWSKA J, KUŹNIAK E, LINKIEWICZ A, SOWA S. Primary carbon metabolism-related changes in cucumber exposed to single and sequential treatments with salt stress and bacterial infection., 2018, 123: 160-169.
[10] KONG X Q, LUO Z, DONG HZ, ENEJI A E, LI W J. H2O2and ABA signaling are responsible for the increased Na+efflux and water uptake inL. roots in the non-saline side under non-uniform root zone salinity., 2016, 67(8): 2247-2261.
[11] BAZIHIZINA N, BARRETT-LENNARD E G, COLMER T D. Plant responses to heterogeneous salinity: Growth of the halophyteis determined by the root-weighted mean salinity of the root zone., 2012, 63: 6347-6358.
[12] 赵世杰, 史国安, 董新纯. 植物生理实验学指导. 北京: 中国农业科学技术出版社, 2002. ZHAO S J, SHI G A, DONG X C.Beijing: China Agricultural Science and Technology Press, 2002. (in Chinese)
[13] 彭春雪, 耿贵, 砖丽华, 杨云, 邱植, 孙菲, 孙学伟, 赵慧杰. 不同浓度钠对甜菜生长及生理特性的影响. 植物营养与肥料学报, 2014, 20(2): 459-465. PENG C X, GENG G, ZHUAN L H, YANG Y, QIU Z, SUN F, SUN X W, ZHAO H J. Effects of different Na+concentrations on growth and physiological traits of sugar beet., 2014, 20(2): 459-465. (in Chinese)
[14] 孙璐, 周宇飞, 李丰先, 肖木辑, 陶冶, 许文娟, 黄瑞冬. 盐胁迫对高粱幼苗光合作用和荧光特性的影响. 中国农业科学, 2012, 45(16): 3265-3272. SUN L, ZHOU Y F, LI F X, XIAO M J, TAO Y, XU W J, HUANG R D. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings., 2012, 45(16): 3265-3272. (in Chinese)
[15] 胡文海, 喻景权. 低温弱光对番茄叶片光合作用和叶绿素荧光参数的影响. 园艺学报, 2001, 28(1): 41-46.
HU W H, YU J Q. Effects of chilling under low light on photosynthesis and chlorophyll fluorescence characteristic in tomato leaves., 2001, 28(1): 41-46. (in Chinese)
[16] KONG X Q, LUO Z, DONG H Z, ENEJI A E, LI W J. Effects of non-uniform root zone salinity on water use, Na+recirculation, and Na+and H+flux in cotton., 2012, 63: 2105-2116.
[17] WEST D W. Water use and sodium chloride uptake by apple trees. II. The response to soil oxygen deficiency., 1978, 50: 51-65.
[18] MUNNS R. Comparative physiology of salt and water stress., 2002, 25: 239-250.
[19] DEGARIS K A, WALKER R R, LOVEYS B R, TYERMAN S D. Exogenous application of abscisic acid to root systems of grapevines with or without salinity influences water relations and ion allocation., 2017, 23: 66-76.
[20] SAXENA I, SRIKANTH S, CHEN Z. Cross talk between H2O2and interacting signal molecules under plant stress response., 2016, 7: 570.
[21] WANG X P, BAI T C, ZHI J H, LI Z Y. Effects of salt water drip irrigation on jujube roots soil available nitrogen distribution: a security assurance perspective., 2016, 10(2): 267-278.
[22] PARDO J M. Biotechnology of water and salinity stress tolerance., 2010, 21(2): 185-196.
[23] BAZIHIZINA N, COLMER T D, BARRETT-LENNARD E G. Response to non-uniform salinity in the root zone of the halophyte: growth, photosynthesis, water relations and tissue ion concentrations., 2009, 104: 737-745.
[24] XU J W, HUANG X, LAN H X, ZHANG H S, HUANG J. Rearrangement of nitrogen metabolism in rice (L.) under salt stress., 2016, 11(3): e1138194.
[25] 马晓东, 钟小莉, 桑钰. 干旱胁迫下胡杨实生幼苗氮素吸收分配与利用. 生态学报, 2018, 38(20): 1-11.
MA X D, ZHONG X L, SANG Y. Characteristics of nitrogen absorption, distribution, and utilization byseedlings under drought stress., 2018, 38(20): 1-11. (in Chinese)
[26] AHANGER M A, AGARWAL R M. Salinity stress induced alterations in antioxidant metabolism and nitrogen assimilation in wheat (L) as influenced by potassium supplementation., 2017, 115: 449-460.
[27] IQBAL N, UMAR S, KHAN N A. Nitrogen availability regulates proline and ethylene production and alleviates salinity stress in mustard ()., 2015, 178(15): 84-91.
[28] RICHTER J A, ERBAN A, KOPKA J, ZORB C. Metabolic contribution to salt stress in two maize hybrids with contrasting resistance., 2015, 233: 107-115.
[29] HELLMANN H, FUNCK D, RENTSCH D, FROMMER W. Hypersensitivity of an arabidopsis sugar signaling mutant toward exogenous proline application., 2000, 123: 779-790.
[30] FU J, WANG Y F, LIU Z H, LI Z T, YANG K J.alleviates the effects of saline-alkaline stress on maize seedlings via the regulation of photosynthesis and nitrogen metabolism., 2018, 85: 363-374.
Effects of Local Root Zone Salinity on Grapevine Injury, Na+Accumulation and Allocation of Carbon and Nitrogen
SUN Hong, JIANG YiWen, YU Xin, XIANG GuangQing, YAO YuXin
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology/ Key Laboratory of Biology and Genetic Improvement of Horticultural Crops in Huanghuai Region, Ministry of Agriculture, Tai’an 271018, Shandong)
【Objective】 Salt stress seriously affects yield and fruit quality of fruit crops. Soil salinity is often heterogeneous in saline fields, and within the different root zones of single plant the salinity of the soil solution might vary widely. This paper was aimed to determine the injury extent of grapevine under the non-uniform salt treatment, and to disclose the corresponding mechanism through the determination of Na+flux and allocation of carbon and nitrogen in grapevine. 【Method】 Saline environment of vine roots was controlled through split-root system and five treatments with different NaCl concentration (mmol·L-1) were set: 0/0, 0/50, 50/50, 0/100, and 100/100. Grapevine injury was evaluated via determining content of chlorophyll and malondialdehyde (MDA) as well as the changes of chlorophyll fluorescence parameters. Na+transport was analyzed by the determination of Na+content, Na+flux and electrical conductivity of culture medium around roots. Nitrogen utilization efficiency and distribution rate of carbon and nitrogen were used to detect the changes of carbon and nitrogen in different tissues under different treatments.【Result】The uniform salt treatment of bilateral roots significantly reduced the content of chlorophyll and enhanced the MDA levels in roots and leaves at 15 and 30 days after treatment. In contrast, salt treatment of local roots alleviated the chlorophyll decrease and the MDA accumulation. Additionally, the determination of chlorophyll fluorescence parameters, such as Fv/Fm and ERT, showed the similar results. Therefore, the roots in the non-saline side could alleviate the grapevine injury in comparison to the uniform salt treatments. All of salt treatments increased Na+content in roots and leaves to varying extents at 15 days after treatment; particularly, the Na+content of the roots in the non-saline side was also enhanced; additionally, local root zone salinity significantly decreased the Na+content in leaves, and local treatment of 100 mmol·L-1NaCl significantly reduced the Na+content in saline side roots, compared to the uniform NaCl treatment. The Na+efflux was observed in non-treated roots, however, the Na+flux was reversed to influx in the non-saline side roots under non-uniform salt treatment. Additionally, the electrical conductivity of the culture medium around the roots in the non-saline side was significantly enhanced. Therefore, the Na+absorbed from the salt-treated side could be transported to the non-saline side roots and thereby expelled out of the roots. Nitrogen utilization efficiency was significantly reduced by the uniform salt treatment and the decline was associated with salt treatment concentration. In contrast, the non-uniform salt treatment alleviated the declines in nitrogen utilization efficiency and particularly, which was significantly enhanced in the non-saline side roots under the 0/100 mmol·L-1treatment. The uniform salt treatments and particularly 100 mmol·L-1NaCl decreased the distribution rate of nitrogen in roots and leaves and increased the values in the two-year-old shoots, favoring the storage of nitrogen. In contrast, the non-saline side roots alleviated the declines of nitrogen distribution rate in roots and leaves. The uniform salt treatment decreased carbon distribution rate in leaves and roots; in contrast, the non-saline side roots not only alleviated the declines of carbon distribution rate in leaves but also elevated carbon distribution rate in roots. It was noteworthy that 50 and 100 mmol·L-1NaCl treatments imparted different effects on carbon distribution in new shoots and two-year-old shoots, i.e., the uniform and non-uniform treatments of 50 mmol·L-1NaCl enhanced carbon distribution in the two-year-old shoots while the treatments of 100 mmol·L-1NaCl produced the contrary results.【Conclusion】Compared with the uniform salt treatment, NaCl treatment of local roots produced the lesser injury for grapevines. Na+absorbed from the salt-treated side was transported to the non-treated side, expelled them from the roots, and thereby reduced Na+accumulation in leaves. The non-saline side roots alleviated the declines in carbon and nitrogen distribution rate of leaves and roots.
grapevine; salt treatment of local roots; injury extent; Na+flux; allocation of carbon and nitrogen
10.3864/j.issn.0578-1752.2019.07.005
2018-07-18;
2018-10-20
国家自然科学基金(31872068)、国家葡萄产业技术体系建设专项(CARS-29)、山东省自然科学基金(ZR2018MC021)
孙红,E-mail:1250462609@qq.com。通信作者姚玉新,Tel:0538-8246258;E-mail:yaoyx@sdau.edu.cn
(责任编辑 赵伶俐)

