硫辛酸和甜菜碱在小麦组织培养中的作用
郑冠鹏,王晓雨,刘新伦,田增荣,王 超,吉万全
(西北农林科技大学农学院/国家小麦改良中心杨凌分中心/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
近年来,以转基因技术提高小麦产量、品质和抗逆性的研究已日趋广泛。农杆菌转化法具有操作简单、成本低、可转移较大片段 DNA等优点,并且外源基因的整合多为单拷贝,遗传稳定性好,后代多数符合孟德尔遗传规律,所以在小麦转基因研究中被广泛应用[1]。然而在农杆菌转化过程中,褐化问题严重影响了小麦转化的成功率,其与玻璃化和菌类污染并称为组织培养的三大难题[2]。
褐化是外植体受到胁迫后释放出酚类物质并诱导植保素或物理屏障生成的一种自我保护机制。由于酚类物质不稳定,易在多酚氧化酶的作用下氧化形成褐色醌类物质,醌类物质又会在酪氨酸酶等酶的作用下,与外植体中的蛋白质聚合,进一步导致其他酶系统紊乱,导致外植体生长停滞直至死亡[3]。研究表明,在培养基中添加一些抗褐化剂,如半胱氨酸(Cys)、抗坏血酸(Vc)、谷胱甘肽(GSH)及AgNO3等[4],可以减轻愈伤组织的褐化。赵 玮[5]在茶树组织培养中使用1/2 MS培养基并加入0.50 g·L-1的Na2S2O3和0.50 g·L-1的活性炭,使茶树的褐化率降为40.5%。饶慧云等[6]在葡萄组织培养中研究了7种抗褐化剂的作用,效果为PVP(2.0 g·L-1)>甘露醇(20.0 g·L-1)>AgNO3(0.02 g·L-1)>Vc(0.006 g·L-1)>活性炭(2.5 g·L-1)>柠檬酸(0.6 g·L-1)。在杉木精简组织培养中加入Vc和Cys可有效降低愈伤组织的褐化程度[7];在碱茅种胚的诱导、继代和芽分化培养基中添加500 mg·L-1的脯氨酸可有效防止愈伤组织褐化[8];在小麦遗传转化的侵染和共培养培养基中添加400 mg·L-1的Cys,降低了愈伤组织的褐化率[9]。
硫辛酸(lipoic acid,LA)作为一种独特的抗氧化剂,广泛存在于各种原核和真核细胞中,它的存在可有效减少氧化应激反应的发生[10]。硫辛酸的抗氧化功能体现在以下5个方面:(1)直接清除活性氧和活性氮;(2)通过螯合金属离子发挥抗氧化作用;(3)循环再生其他内源性抗氧化剂;(4)增强自身氧化酶的活性;(5)增加线粒体膜电位和细胞氧消耗,降低活性氧的产生。硫辛酸在木本植物的组织培养中有所应用,Uchendu等[11]的研究表明,培养基中添加4~8 mmol·L-1的硫辛酸可显著提高两种树莓茎尖的再生率。但硫辛酸在小麦组织培养中的研究尚未见报道。
甜菜碱(glycine betaine,GB)是一种植物抵抗非生物胁迫的保护剂[12],研究表明,甜菜碱可诱导H2O2介导的抗氧化机制[13]。Cuin等[14]研究发现,培养液中添加低浓度(5 mmol·L-1)的甜菜碱可减少拟南芥根部伸长区的氧自由基。Uchendu等[11]的研究表明,在培养基中添加10 mmol·L-1的甜菜碱可有效提高冻存茎尖的再生率。然而甜菜碱在小麦组织培养中的研究尚未见报道。
本研究以小麦幼胚为试验材料,研究硫辛酸和甜菜碱在组织培养中对愈伤组织的作用,以期找到克服小麦愈伤组织褐化的方法,为进一步优化小麦遗传转化体系提供参考。
1 材料与方法
1.1 试验材料
所用小麦受体材料为弱春性小麦品种小偃22,半冬性小麦品种Z50和郑麦366,农杆菌菌株为GV3101,均由西北农林科技大学染色体工程实验室保存。植物表达载体DRB-bar-TaGW2由本实验室构建。
1.2 培养基
诱导培养基:MS+2 mg·L-12,4-D,+30 g·L-1蔗糖+7 g·L-1琼脂,pH 5.8。重悬液:1/10MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+150 mmol·L-1乙酰丁香酮,pH 5.8。共培养基:1/10MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖,pH 5.8。抑菌培养基:基础培养基为MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+7 g·L-1琼脂,分别添加不同浓度的硫辛酸和甜菜碱(表1)。硫辛酸与甜菜碱均于灭菌前加入并将pH调至5.8,灭菌结束后温度降至约50 ℃时加入终浓度为500 mg·L-1的羧苄青霉素。

表1 抑菌培养基中硫酸锌(LA)和甜菜碱(GB)的添加量Table 1 Concentration of lipoic acid(LA) and glycine betaine(GB) in the bacteriostatic medium
基础培养基均为MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+7 g·L-1琼脂。
The basic medium is MS+2,4-D(2 mg·L-1)+30 g·L-1sucrose+7 g·L-1agar.
1.3 小麦幼胚愈伤组织的诱导
取扬花后13~15 d的小麦未成熟种子,用75%乙醇浸泡30 s,无菌水冲洗2~3次,随后用0.1%升汞处理10 min,无菌水冲洗4~5次。于超净工作台中用灭菌的手术刀切取幼胚置于诱导培养基上,置于25 ℃下暗培养15 d。
1.4 幼胚愈伤组织的侵染
将含有载体DRB-bar-TaGW2的农杆菌GV3101接种于LB液体培养基(含50 mg·L-1利福平+100 mg·L-1壮观霉素)中,28 ℃ 280 r·min-1过夜培养至OD600为0.6~0.8,4 000 r·min-1离心10 min,弃上清后加入与上清等量的重悬液重悬农杆菌,用重新悬浮的菌液浸泡愈伤组织20 min后除去多余菌液。将愈伤组织转入含有适量共培养基的滤纸培养皿中,25 ℃共培养48 h,再转入含有不同处理的抑菌培养基中。各处理均重复3次,每重复取愈伤组织50枚左右。
1.5 数据统计与分析
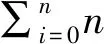
a:0级;b:1级;c :2级;d: 3级。 a:Level 0; b:Level 1; c:Level 2; d:Level 3.
2 结果与分析
2.1 不同品种的褐化及水渍化程度
本研究发现,在均未添加LA和GB时,于5、10和15 d抑菌处理后,Z50和小偃22的褐化程度均显著低于郑麦366 ,各品种随着抑菌时间的延长,褐化程度均呈现先升高后降低的趋势,但除小偃22外,差异均不显著(图2)。三个品种的水渍化程度均表现为随抑菌培养时间的延长而降低,Z50、郑麦366抑菌10 d时的水渍化程度均显著低于5 d。抑菌5 d时小偃22水渍化程度显著低于郑麦366,但抑菌10和15 d时差异不显著(图3)。
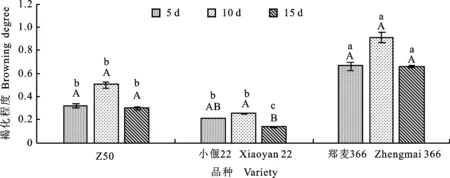
图柱上小写字母不同表示相同抑菌时间内不同品种之间差异显著(P<0.05),大写字母不同表示相同品种在不同抑菌时间下差异显著(P<0.05)。图3同。
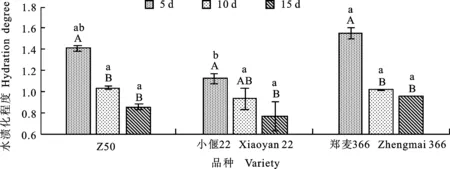
图3 不同品种在不同抑菌处理天数后的水渍化程度
2.2 硫辛酸处理对抑菌阶段愈伤组织的影响
2.2.1 硫辛酸处理对抑菌阶段愈伤组织褐化程度的影响
从图4可以看出,Z50、小偃22和郑麦366的褐化程度基本呈现随硫辛酸浓度的升高而降低的趋势,并且随着抑菌时间的延长,其中添加4和8 mmol·L-1硫辛酸处理的褐化程度均显著低于CK(小偃22处理15 d的情况例外)。在抑菌培养第10 d,添加4 mmol·L-1硫辛酸的Z50褐化程度最低,仅为对照的10.50%。在硫辛酸对小偃22愈伤组织的处理中,添加2 mmol·L-1硫辛酸褐化程度最高,而添加4和8 mmol·L-1硫辛酸处理的褐化程度显著低于CK。郑麦366在抑菌第5 d,2 mmol·L-1硫辛酸处理的褐化程度略高于CK,而在第10和15 d的褐化程度均随硫辛酸浓度的升高而降低。这说明硫辛酸在抑制愈伤组织褐化方面起到积极的作用,且其影响程度与品种类型密切相关。
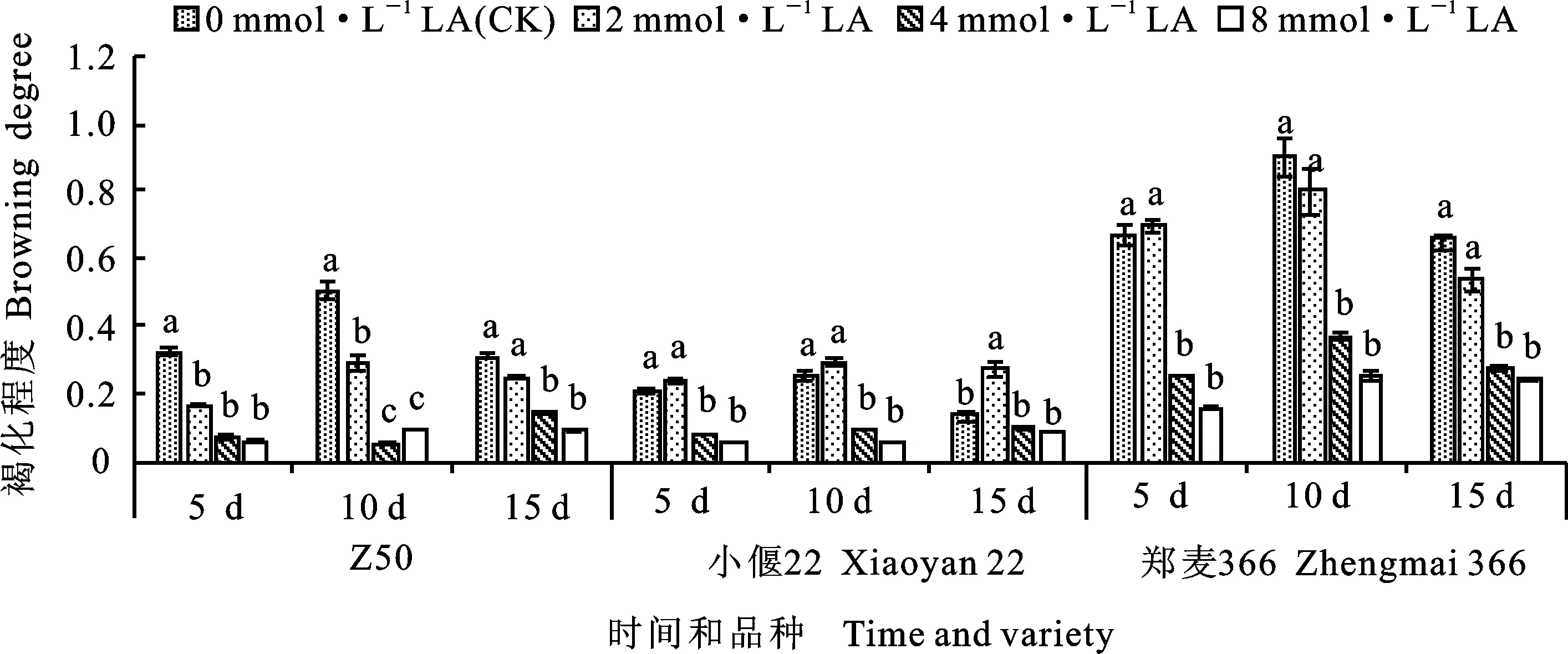
横坐标上的天数为抑菌处理的时间;图柱上小写字母不同表示在不同浓度硫辛酸处理下相同品种和相同抑菌时间内褐化程度在0.05水平上差异显著。图5、图6、图7同。
2.2.2 硫辛酸处理对抑菌阶段愈伤组织水渍化程度的影响
如图5所示,在添加不同浓度硫辛酸处理5、10和15 d后,随着硫辛酸浓度的提高,Z50和小偃22愈伤组织的水渍化程度依次增加。添加8 mmol·L-1硫辛酸的Z50水渍化程度在5、10和15 d均显著高于CK。添加4和8 mmol·L-1硫辛酸的小偃22在抑菌15 d时水渍化程度显著高于CK。添加硫辛酸对郑麦366的影响与另两个品种不同,在抑菌5 d时,添加8 mmol·L-1硫辛酸处理的水渍化程度显著高于CK,抑菌处理10和15 d时,添加2、4和8 mmol·L-1硫辛酸处理的水渍化程度与CK的差异均未达到显著水平。
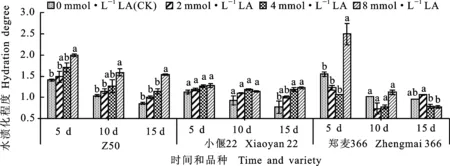
图5 硫辛酸浓度对抑菌处理后各品种水渍化程度的影响
2.3 甜菜碱处理对抑菌阶段愈伤组织的影响
2.3.1 甜菜碱处理对抑菌阶段愈伤组织褐化程度的影响
如图6所示,统计了甜菜碱处理下Z50和小偃22愈伤组织的褐化程度,由于郑麦366处理较少,不具有统计学意义,故未计入其中。在抑菌5 d的愈伤组织中,添加10 mmol·L-1甜菜碱的Z50表现为褐化程度加深,而在抑菌的第10 和15 d,添加甜菜碱的愈伤组织褐化程度低于对照,但差异均未达到显著水平。而添加甜菜碱后,在抑菌的第5、10和15 d,小偃22愈伤组织的褐化程度均高于对照,但差异均未达到显著水平。说明添加10 mmol·L-1甜菜碱对这两个品种愈伤组织褐化程度的影响都不明显。
2.3.2 甜菜碱处理对抑菌阶段愈伤组织水渍化程度的影响
由图7可知,在对Z50、小偃22幼胚愈伤组织遗传转化的抑菌阶段,添加10 mmol·L-1的甜菜碱略微降低了愈伤组织的水渍化程度,但处理5、10和15 d后与CK的差异均未达到显著水平。说明添加10 mmol·L-1甜菜碱对Z50和小偃22水渍化程度的影响均不明显。
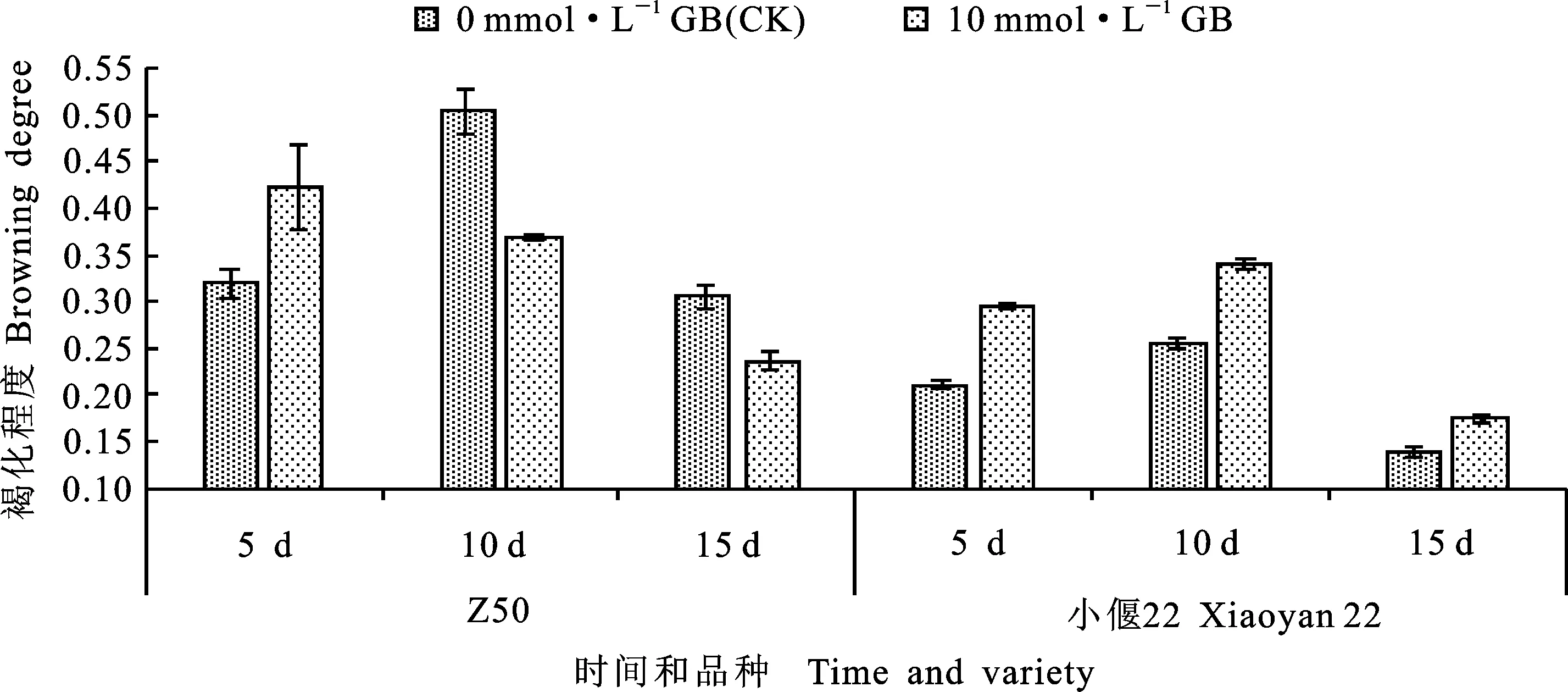
图6 甜菜碱浓度对抑菌处理后Z50和小偃22褐化程度的影响
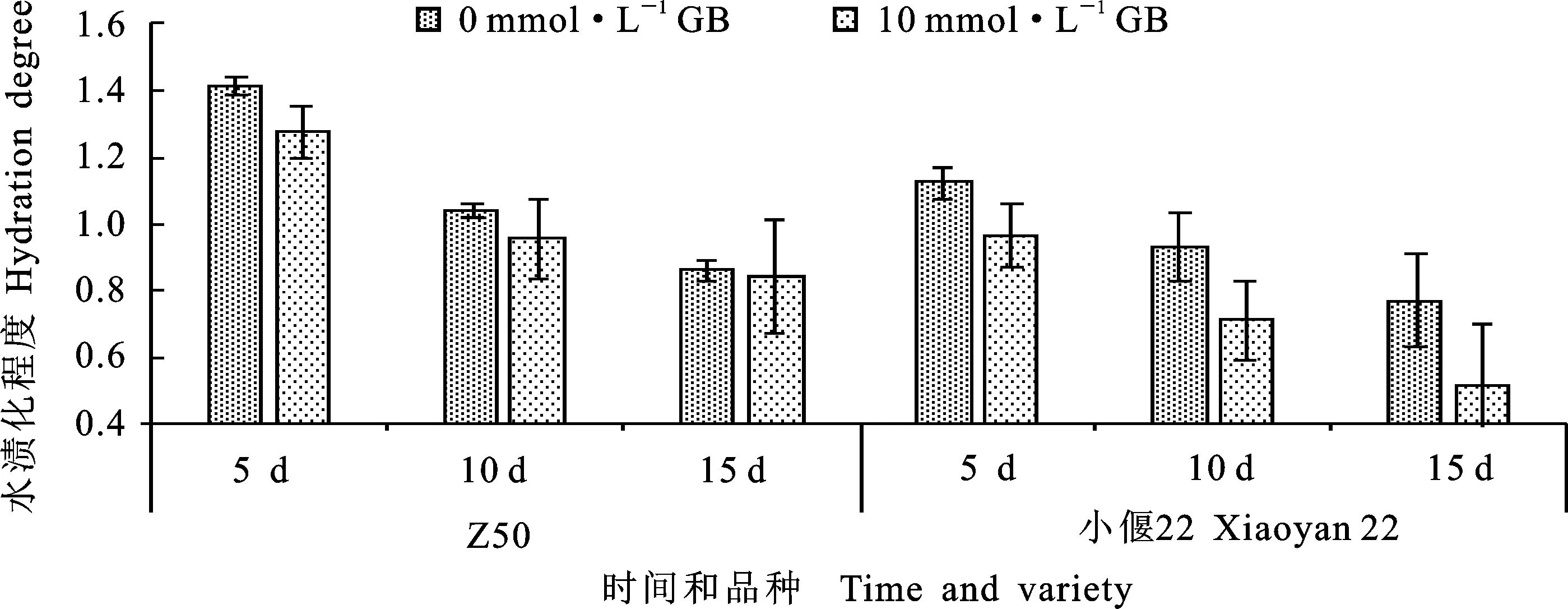
图7 甜菜碱浓度对抑菌处理后Z50和小偃22水渍化程度的影响
3 讨 论
本研究发现,硫辛酸可以有效地降低小麦幼胚愈伤组织的褐化程度,但也会提高愈伤组织的水渍化程度,这可能是由于小麦幼胚愈伤组织的不适应造成的。且在后期的继续培养中发现,添加硫辛酸浓度较高的处理组,愈伤组织生长缓慢甚至停止生长,考虑可能由于硫辛酸浓度过高,处理时间过长,导致愈伤组织受到毒害。所以笔者认为,硫辛酸虽在抑制褐化方面具有一定的作用,但在添加时间、浓度、添加方法等方面还需进一步的研究。
甜菜碱作为一种渗透调节物质,可以参与细胞的渗透调节,外源甜菜碱可提高小麦幼苗SOD和APX的活性,缓解活性氧带来的伤害[15]。但本研究发现,甜菜碱对小麦品种Z50和小偃22幼胚愈伤组织的褐化程度及水渍化程度均无明显影响,这可能是因为这两个品种对甜菜碱都不敏感的缘故。前人的一些研究证明甜菜碱的添加与品种有关,例如孙文越等[16]研究发现,外源甜菜碱对“黑芒”小麦受到干旱胁迫引起的伤害具有加深作用;而赵博生等[17]的研究却表明,外源甜菜碱可降低干旱/盐胁迫对“京核 931”小麦生长的抑制作用。

