花药培养与麦谷蛋白亚基分子标记结合选育小麦新品种的研究
王 炜 ,陈 琛 ,叶春雷,杨随庄,欧巧明,罗俊杰
(1.甘肃省农业科学院生物技术研究所,甘肃兰州 730070;2.西南科技大学生命科学与工程学院,四川绵阳 621010)
麦谷蛋白是小麦贮藏蛋白的主要成分之一,麦谷蛋白亚基的组成和含量对小麦品质形成具有重要作用[1]。近年来,若干麦谷蛋白亚基基因功能分析、分子标记的开发为进行小麦品质改良提供了有力支撑[1-2]。随着农业供给侧改革的展开,小麦的育种目标逐步从高产、抗病转向优质专用,以满足人们多方面、多层次的需求。在小麦育种的早期世代,由于品质性状表型较难区分,对大量材料进行品质检测则成本高昂,利用与品质相关的麦谷蛋白亚基分子标记进行辅助选择,在一定程度上可提高育种效率并节省成本。
花药培养具有缩短育种时间并提高育种效率等优点,是单倍体育种技术中应用最成功和最广泛的方法。然而由于基因型依赖性、诱导率和分化率低等诸多原因[3],与传统常规育种相比,应用该技术育成的品种偏少。近年来的研究表明,包含花药培养在内的单倍体育种技术可与分子标记辅助选择技术和转基因技术等现代生物技术有机结合,使有益基因快速聚合[3-4],进而进行种质资源创制和新品种选育,该项技术重新得到相关研究者的重视[5]。本研究以矮败小麦群体为平台,通过对其与优质材料的杂交后代进行花药培养,并结合麦谷蛋白分子标记检测,进行小麦新品种的选育,为提升小麦品质育种技术水平提供参考依据。
1 材料与方法
1.1 供试材料
矮败小麦材料由甘肃省农业科学院作物研究所提供;用于矮败小麦群体改良的种质资源材料和尚头、甘春20号、临麦34号、陇春23号、陇春27号、陇春29号、银春8号由甘肃省农业科学院小麦研究所提供,宁春4号、陇春31号、定丰16号和200706由本研究室提供。其中,和尚头、甘春20号具有优良的营养加工品质;宁春4号、陇春27号、陇春31号和200706具有优良的花培特性;宁春4号、定丰16号、陇春23号、陇春27号、陇春31号、定丰16号、临麦34号和银春8号的综合性状优良,是近些年来甘肃中部地区重要的栽培品种。
1.2 方 法
1.2.1 矮败小麦改良群体组建
依照王世红等[6]的方法,将和尚头、甘春20号、临麦34号、陇春23号、陇春27号、陇春31号、定丰16号、宁春4号、银春8号和200706的种子等量混合作为混合父本,与引进的矮败小麦群体材料按行数比1∶2播种,行长3 m,行距0.2 m,共种植120行,面积为72 m2,成熟后收获全部籽粒;次年按上述方法继续播种,并淘汰不良可育株。连续进行3年(2013-2015)。
1.2.2 花药培养
2013年按照文献[7]的方法进行花药培养并统计花培特性相关指标。其中,接种矮败小麦材料30瓶,用于改良群体的种质资源材料10瓶,每瓶60枚花药,3次重复。2016年接种矮败小麦改良群体材料736瓶,约44 160枚花药。
1.2.3 分子标记检测
选取3个HMW-GS(Bx7、Bx14、Dx5)和3个LMW-GS(Glu-A3ac、Glu-A3d、Glu-B3b)特异标记引物,2016年对花药培养所获得的115份花培后代材料进行麦谷蛋白亚基分子标记检测,标记引物相关信息见文献[8]。PCR反应体系(15 μL):模板DNA 50 ng,2×Taq MasterMix(中科瑞泰北京生物科技有限公司)7.5 μL,标记基因上下游引物(10 μmol·L-1)(上海生工)各0.6 μL,用双蒸水补充反应体系至15 μL。Bx7和Dx5的PCR扩增程序参照芦 静等[9]的方法;Bx14的扩增程序参照王 欣等[10]的方法,Glu-A3ac、Glu-A3d和Glu-B3b的扩增程序参照Wang等[11]的方法。1%琼脂糖凝胶电泳分离,溴化乙锭(EB)染色。缓冲体系为1×TAE溶液,120 V电压下电泳30 min,紫外成像系统扫描成像。
1.2.4 农艺性状鉴定
2017-2018年按照常规育种方法对44份含有4种及4种以上麦谷蛋白亚基的花培小麦株系进行了连续2年的田间观察鉴定,对照品种为陇春23号,田间常规管理。记载主要农艺性状并考种。
1.3 数据统计与分析
采用Excel 2003和SPSS 13.0软件进行数据统计分析。方差齐性检验用Duncan法检测,非齐性检验用Tamhane’s T2法检测[12]。
2 结果与分析
2.1 花药培养
花药培养结果(表1)表明,11份供试材料的愈伤组织诱导率在1.45%~37.28%之间,其中以陇春31号最高,且显著高于其他材料,和尚头最低;诱导率超过10%的有7份,其余4份材料均在5%以下。绿苗分化率在6.27%~66.21%之间,最高为引进的矮败小麦,最低为和尚头,绿苗分化率超过50%的有5份;20%~50%之间的有2份,其总体趋势与愈伤组织诱导率基本一致。绿苗生产率在0.22%~21.11%之间,陇春31号最高,陇春29号则最低,超过10%的材料有3份材料,5%~10%之间的有3份。
在对矮败小麦改良群体的花药培养中,共接种约44 160枚,获得愈伤组织2 628块,愈伤组织诱导率为5.95%;获得绿苗1 237个,绿苗分化率为47.07%,绿苗生产率为2.80%。经炼苗一周后于当年10月份移栽入温室,成活866株,移栽成活率为70.01%;次年4月统计结实的株数为571株,即自发加倍率为65.94%,每株粒数在3~46粒之间。经田间种植筛选获得115个株系。
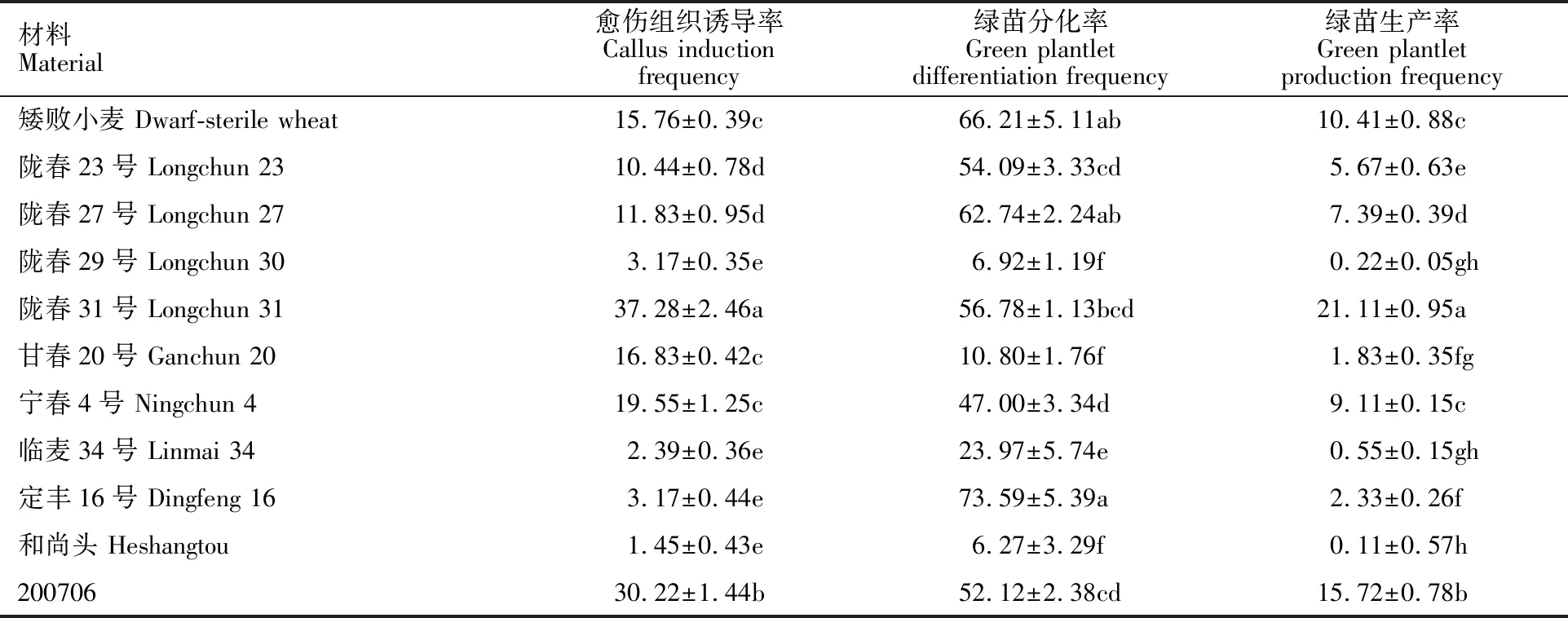
表1 引进矮败小麦群体及杂交父本的花药培养Table 1 Anther culture of introduced dwarf-sterile population and the hybrid male parents %
同列数据后不同字母表示材料间存在显著差异(P<0.05)。
Different letters following data in same column are significantly different among materials at 0.05 level.
2.2 麦谷蛋白亚基分子标记检测
由表2可知,矮败小麦含有Bx7、Dx5、Glu-A3ac、Glu-A3d基因;4份杂交父本材料含有5个优质麦谷蛋白亚基基因,分别为陇春29号、临麦34号、定丰16号与和尚头;供试的11份材料均含有Bx7,陇春27除外的其他10份材料均含有Dx5和Glu-A3d,而Bx14仅在临麦34号中检测到。
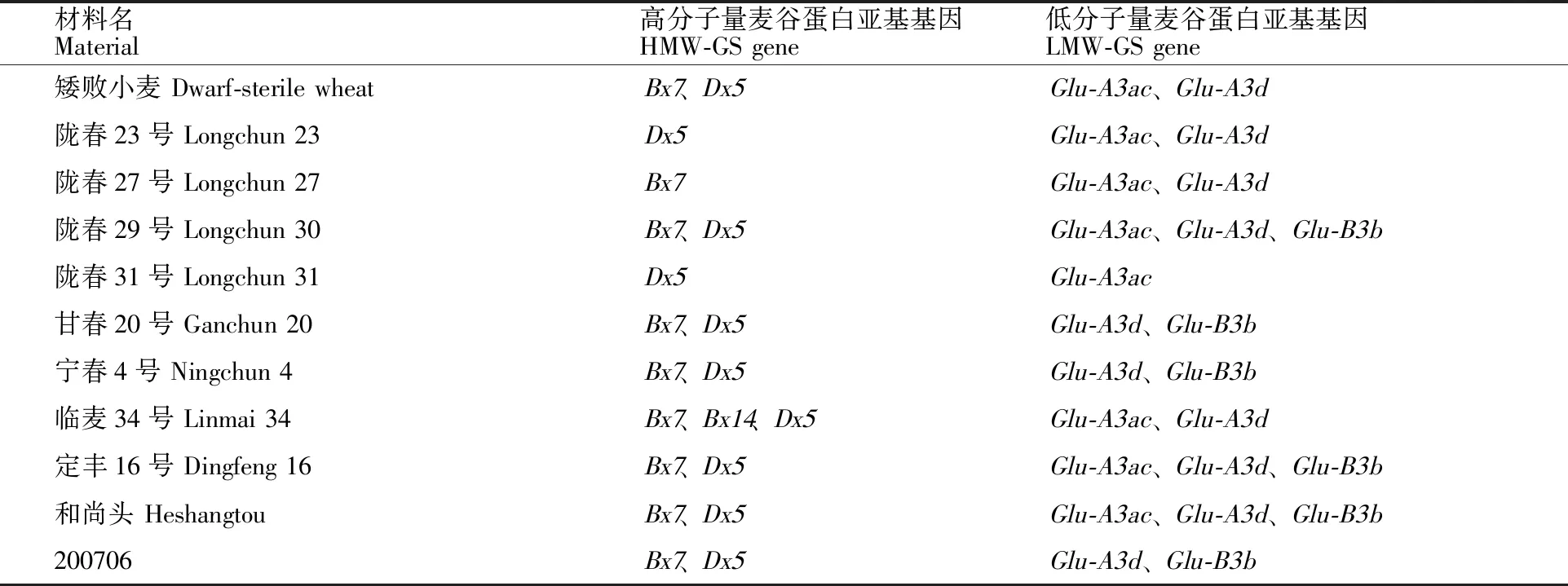
表2 引进矮败小麦群体及杂交父本的麦谷蛋白亚基分子标记检测Table 2 Molecular marker detection of glutenin subunits in introduced dwarf-sterile wheat population and the hybrid male parents
对所获得的115个花培后代株系进行分子标记检测的结果(表3)表明,Bx7的出现频率最高,为94.78%,这与其在杂交亲本中的频率高相关;其余依次为Glu-A3ac、Dx5、Bx14、Glu-A3d、Glu-B3b;稀有亚基基因Bx14在41份材料中检测到,频率达到35.65%。
为明确所检测的亚基基因在这些后代材料中的聚合情况,进一步对每份材料含有的优质亚基组合数进行了统计(表4),发现含有3种亚基组合的材料数最多,为45(39.13%)份,其余依次为4(32,27.83%)种、2(25,21.74%)种、5(10,8.70%)种、6(2,1.74%)和1(1,0.87%)种亚基组合;聚合有4个及以上优质麦谷蛋白亚基基因的材料共计44份,占供试材料总数的38.26%。

表3 麦谷蛋白亚基基因在115个小麦花培后代株系的分布频率Table 3 Frequency of glutenin subunit genes in 115 wheat anther-cultured plant lines

表4 麦谷蛋白亚基基因在115个花培后代株系的聚合Table 4 Composition of the determined glutenin subunit genes in 115 plant lines
2.3 小麦株系的田间农艺性状鉴定筛选
对聚合有4个以上优质亚基的44份花培株系在田间进行了连续2年的农艺性状鉴定,获得农艺性状优良的新品系3份(表5),这3份新品系生育期与对照相当,株高较对照有所增高,与产量相关的穗粒数、千粒重及单株粒重均较对照增加。
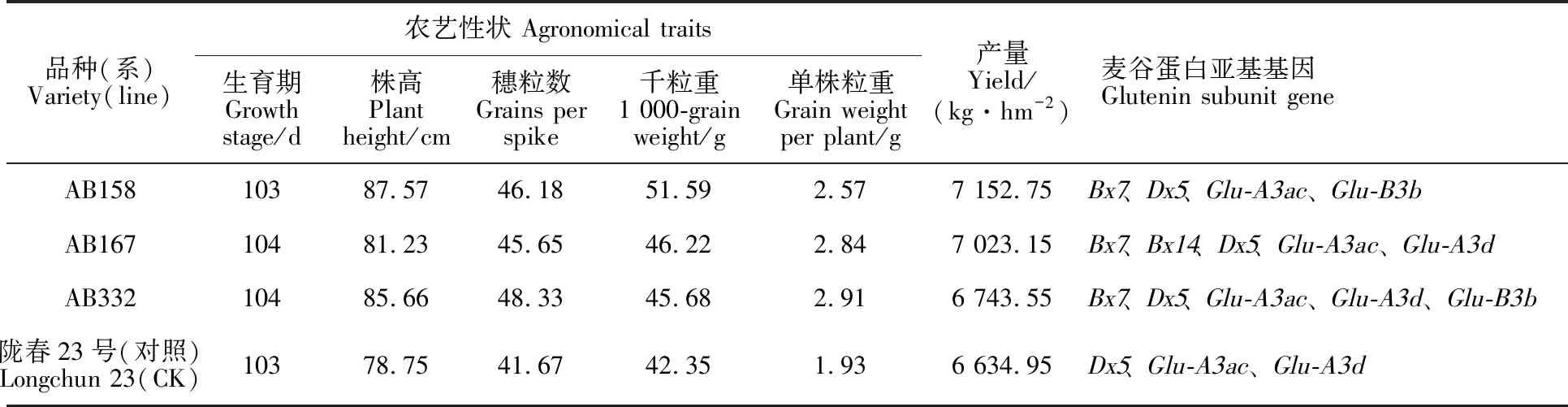
表5 花培小麦新品系的农艺性状及其含有的麦谷蛋白亚基基因Table 5 Agronomical traits and glutenin subunit genes of the anther-cultured new wheat lines
3 讨 论
3.1 小麦花培亲本选择及其花培特性鉴定
筛选具有高花药培养力的亲本材料是花培育种者长期性和基础性工作[13]。本研究对引进的矮败小麦群体及10份杂交父本进行了花培特性鉴定,参照赵林姝等[14]方法评价了小麦基因型是否具有高花药培养力(即愈伤组织诱导率≥12%、绿苗分化率≥21%、绿苗生产率≥8%),发现陇春31号、宁春4号和200706均达到这一标准,陇春27号也接近这一标准,这与我们前期的研究结果基本一致[7,13]。对3份亲本材料陇春29号、临麦34号与和尚头首次进行了花培特性的评价。引进的矮败小麦群体由于存在众多基因型,因此我们随机采穗进行了花药培养,总体其花培特性较好。按照花培亲本搭配的基本原则[12, 15-16],本研究所选取的亲本中既含有花药培养力较高的材料(宁春4号、陇春31号、陇春27号、200706),又有品质优良的材料(甘春20号、和尚头),也有综合农艺性状优异的材料(陇春23号、陇春29号、临麦34号、定丰16号),因而有利于育种工作的进一步开展。
3.2 小麦麦谷蛋白亚基的分子标记
麦谷蛋白亚基与小麦品质密切相关[17-20]。早期主要通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳法(SDS-PAGE)进行麦谷蛋白亚基检测,然而SDS-PAGE法在两个方面有所不足,一是需要以收获的籽粒为原料,在时间上滞后于大田表型的鉴定筛选[21];二是难以解决LMW-GS拷贝数高、与醇溶蛋白重叠的问题[22]。因此,以往大量的研究主要集中于HMW-GS的研究,然而LMW-GS约占全部麦谷蛋白的60%,决定面团的强度和粘度,对小麦的加工品质也起着相当重要的影响[1]。近年来HMW-GS和LMW-GS功能分子标记得到开发,为综合利用HMW-GS与LMW-GS进行品质育种奠定了基础[11, 23]。本研究采用已开发的3个HMW-GS和3个LMW-GS功能标记对杂交亲本材料及花药培养所获得的115个株系进行了检测,明确了陇春23号、临麦34号及和尚头等品种携带的部分亚基信息,同时获得了聚合有4个亚基以上的花培后代株系44份,通过农艺性状鉴定,筛选出了3份聚合4种以上优质亚基的新品系。进一步还需要对这3份材料进行多年多点的产量鉴定及品质检测,为HMW-GS与LMW-GS分子标记在小麦育种实践的应用提供支持。
3.3 高效育种技术体系的建立
自1970年代初开始,人们从事小麦花培育种研究已近半个世纪之久,国内外相关研究者通过不断优化花药培养技术体系,相继育成品种50多个,目前已成为小麦常规育种的重要补充[3, 24]。而与传统常规育种相比,花培品种偏少,花培育种技术所具有的缩短育种时间和提高育种效率的优势未能得到充分体现,这与人们最初对其期待有一定距离。分析个中缘由,主要与小麦花药培养的基因依赖性强、培养效率低,以及与其他育种技术结合不够密切相关[3]。因此,除了继续从影响花药培养的关键因子入手以提高花药培养效率之外,还需探索该技术与其他技术结合的可行性,扩大该技术应用的广度和深度,才能更好地发挥花药培养的优势[25]。近年来,矮败小麦育种技术在小麦新品种选育中获得巨大成功,而目前快速发展的分子标记辅助选择技术可有效克服传统常规育种中选择的盲目性。本研究将花培育种技术、矮败小麦育种技术与分子标记辅助选择技术进行有机结合,获得了3份农艺性状优良且至少聚合4种以上优质亚基的新品系,经进一步培育有望育成新品种在生产上应用,这为建立以“矮败小麦+花药培养+分子标记”三者有机结合的小麦高效育种技术体系提供了参考依据。

