添加剂对储能材料CaCl2·6H2 O+Ca(NO3)2·4H2 O相变温度和过冷温度的影响及其熔盐结构
周红霞,朱发岩,房文超,周永全,刘红艳,房春晖,房 艳
(1.青海大学机械工程学院,青海 西宁 810005;2.中国科学院青海盐湖研究所,青海 西宁 810008)
1 前 言
相变储能材料(PCM)是物质相变过程中,从环境吸收热(冷)量或向环境放出冷(热)量,从而达到能量储存和释放目的的一种新型材料。常见盐湖特色结晶水合盐相变储能材料主要有CaCl2·6H2O、Na2SO4·10H2O、Na2CO3·10 H2O、Ca(NO3)2·4 H2O、Mg(NO3)2·6H2O、MgCl2·6H2O 及 Na2B4O7·10H2O等,以及由其组成的多组分混合盐。它们具有导热系数大、储能密度大、相变体积变化小等优点。Butti等研制出用Na2SO4·10 H2O做储能芯料的太阳能建筑板,并进行了实验性应用研究[1-2]。Nagano等[3]针对建筑物采暖和制冷系统用相变材料,对硝酸盐、磷酸盐、氟化物和氯化钙等的热物性进行了研究。Ryu等[4]对水合无机盐普遍存在的盐水分离问题进行大量改性实验,得出高结晶水合盐(Na2SO4·10H2O、Na2HPO4·12H2O、Na2CO3·10H2O)的有效增稠剂是苯乙烯丙烯吸水树脂,低结晶水合盐(NaCH3COO·3 H2O、Na2S2O3·5H2O)的有效增稠剂是羧甲基纤维素(CMC)。EI-Seball等[5]根据当地的气温条件,对用于太阳灶烹调食物的水合盐储能材料进行了研究。此外,Kimura[6]研究了 CaCl2·6H2O 与其他盐,如Mg(NO3)2·6 H2O,NH4NO3和 KNO3的储能性能,得到这些混合物的熔点和相变焓等数据。Krichel[7]测定了一系列常见水合盐的熔化焓和比热容,为储能材料的制备和设计提供了基础数据。Farid[8]以CaCl2·6H2O为材芯,采用微胶囊封装技术制备了相变储能地板。张寅平[9]对储能材料的制备、热物性以及相变墙体应用做了大量基础性工作。阮德水教授等[10-11]对 Na2CO3·10 H2O,Na2SO4·10 H2O等典型无机水合盐的相图、热物性、成核作用、过冷问题等进行了系统研究。李元哲等[12]以Na2SO4·10H2O作为基底,研究了其在太阳房中的应用。近期,李刚、赵有景等[13-14]研究了 CaCl2·6H2O-MgCl2·6H2O、CaCl2-MgCl2-H2O混合盐体系的相变温度,并用量热法测量了混合盐组成、成核剂类型和添加量等因素对储能性能的影响。
尽管材料的宏观性能多种多样,但从本质上说,都是由其微观结构,即内部原子、分子的种类及聚集方式决定。目前,国内外研究者用各种实验和计算机模拟方法对钙盐溶液结构进行了大量研究,取得了一系列重要结论。Pham等[15]用X射线吸收和X射线衍射方法研究了CaCl2溶液中钙离子水合结构和离子对结构。Fulton等[16-17]用EXAFS方法研究了6.0mol/kg CaCl2溶液。研究表明,钙离子第一水合层水合数为7.2±1.2,水合距离为2.437±0.01Å,但没有发现溶液中存在接触离子对Ca2+-Cl-。Todorova[18]用CPMD方法研究浓度为1和2mol/kg的CaCl2溶液,研究得出钙离子第一水合层水合数为8,水合距离为2.39Å,并证明在2mol/kg溶液中存在接触离子对Ca2+-Cl-和分割离子对Ca2+-H2O-Cl-。Megyes等[19-20]用X射线衍射和从头算方法研究了氯化钙溶液结构。刘世林等[21]用拉曼光谱方法研究硝酸镁水溶液中存在的离子对类型,通过对比纯水和不同浓度溶液中-OH和NO-3伸缩振动频率变化,揭示在Mg(NO3)2水溶液浓度从稀到浓存在自由离子、溶剂分割离子对(SSIP)和接触离子对(CIP),自由离子相对含量随着浓度的增高而减少,CIP的相对含量随着浓度的升高而增多,并在研究浓度范围内观测到三种SSIP,且它们的含量和类型随浓度变化而变化。
由以上可知,目前对多组分结晶水合盐和室温相变材料的储能性能研究相对较少;研究者偏重于对水合盐储能材料性质及其普遍存在问题的改性研究,而对熔盐结构研究较少,尚不清楚微观结构与热物性之间的内在联系。因此,本实验选取CaCl2·6 H2O+7%Ca(NO3)2·4 H2O混合盐体系,对影响其储能性能的过冷问题和盐水分离问题通过添加成核剂和增稠剂进行改性研究,得到添加剂的最优配比;采用拉曼光谱和密度泛函理论研究熔盐结构,从微观结构角度对熔盐普遍存在的过冷和盐水分离问题进行初步探讨。
2 实验部分
2.1 实验材料
无水氯化钙(CaCl2)、四水硝酸钙(Ca(NO3)2·4H2O)、六水氯化锶(SrCl2·6H2O)、碳酸锶(SrCO3)和氯化钡(BaCl2)、硼酸(H3BO3)和氯化铵(NH4Cl)纯度都大于99%。
2.2 样品制备和分析
六水氯化钙由无水氯化钙在水中溶解再结晶的方法制得。水合晶体由X射线粉晶衍射仪鉴定。将质量分数为7%的四水硝酸钙加入六水氯化钙中,在50℃水浴中加热、搅拌至两种物质充分熔化得到CaCl2·6H2O-7%Ca(NO3)2·4H2O 的混合溶液。将液相转入玻璃试管中,插入自制温度探针,密封后放在温度可调的恒温水浴中测定步冷曲线。由自行设计的温度在线监测仪记录材料的温度和时间数据。为了验证自制温度探针的精度,将自制温度探针和经过校正的水银温度计(0~100℃)同时插入恒温水浴中进行对比实验,发现自制温度探针与水银温度计的温度差值为±0.5℃。因此在处理温度数据时,用扣除温度探针与水银温度计之间温度差值的方法进行温度校正。
2.3 拉曼光谱实验
一系列不同浓度氯化钙溶液、硝酸钙溶液及六水氯化钙和四水硝酸钙熔盐的拉曼光谱频率由HR800共聚焦激光拉曼光谱仪测得,频率的波数范围为100~5000cm-1。对拉曼谱图进行了背景校正。波长为633cm-1激光光源由半导体固体激光器产生。将激光先经格兰棱镜纯化偏振方向,然后由透镜聚焦于比色皿(1cm×1cm)中的溶液,激光功率到达样品时约为17 m W。由CCD检测器记录溶液中各物质的振动频率。利用晶体硅的标准线校准拉曼光谱位移。
2.4 密度泛函理论计算方法
熔盐CaCl2(H2O)6和Ca(NO3)2(H2O)4的微观结构由B3LYP泛函和6-311++G(d,p)基组水平计算获得[22]。首先用团簇结构搜索软件构建CaCl2(H2O)n=1-24和Ca(NO3)2(H2O)1-2的初始微观结构模型。然后用密度泛函理论优化各结构模型,并计算其光谱频率和能量数据。通过比较各异构体的能量大小确定能量较低结构。在上述能量较低结构的不同位置处添加水分子获得不同水合数的微观结构,并进行结构优化和光谱频率计算。然后将异构体进行能量对比得到稳定结构,并采用单点极化连续模型(PCM)在相同方法基组水平下进行结构优化计算[23-24]。将计算所得结构进一步在PCM条件下用ωB97XD和def2tzvp基组计算其单点能[25-27]。对计算得到的每一结构能量都进行零点能校正。上述计算在Gaussian09程序包中完成[28]。
3 结果与讨论
3.1 成核剂对CaCl2·6H2 O+7%Ca(NO3)2·4H2 O过冷问题的改性研究
根据差示量热扫描仪(DSC)实验给出该体系的相变焓约为140J/g,适宜在室内家装、温室大棚、太阳能利用、建筑材料等领域应用。图1为CaCl2·6 H2O+7%Ca(NO3)2·4H2O(缩写为Cl7N)的步冷曲线图。由图可知,它的相变温度约为23℃,过冷温度在14℃及以下,过冷度在9℃及以下。由此可见此材料虽然具有良好的储能性能,但其过冷和盐水分离问题严重影响了其储能性能,需对该材料进行改性。根据前期实验探索研究,选取 Sr Cl2·6H2O、Sr CO3、BaCl2、BaCO3、H3BO3、NH4Cl作为成核剂,将它们分别添加到混合熔盐 CaCl2·6 H2O+7%Ca(NO3)2·4 H2O 中研究成核剂的类型和添加量对该体系过冷性质的影响。所添加成核剂量分别占熔盐质量的质量分数为0.5%,1%,1.5%和2%。图2为添加成核剂后熔盐的步冷曲线图,由图可知除SrCO3外,添加成核剂对熔盐的过冷问题有不同程度的改善。
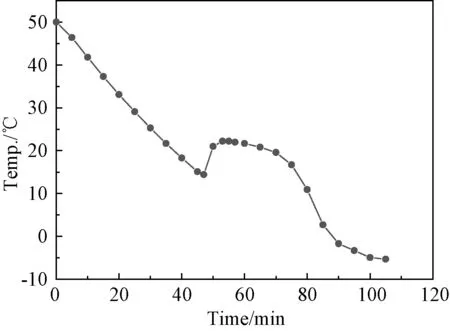
图1 混合熔盐CaCl2·6H 2 O+7wt%Ca(NO3)2·4H 2 O(Cl7N)的步冷曲线图Fig.1 Cooling curve of eutectic hydrate salts CaCl2·6H 2 O+7%Ca(NO3)2·4H 2 O
成核剂Sr Cl2·6 H2O对体系的过冷问题有明显的改善,当添加量为1%时改善效果最明显,其过冷度仅为1.6℃;之后随着成核剂添加量的增大其过冷度有所增大,添加量为2%时增大到2.3℃。相比之下,Sr CO3·6 H2O并没有改善该体系过冷问题,添加Sr CO3后混合熔盐的相变温度升高了约3℃,过冷度与纯混合熔盐的相比,增大了10℃左右。当BaCl2作为成核剂时熔盐的平均相变温度为24℃,因此平均过冷度为4℃;随着成核剂添加量的增加,过冷度逐渐减小,当成核剂量为2%时过冷度为3.3℃。将BaCO3作为该体系成核剂时,该4组体系平均相变温度为23.5℃,平均过冷度为2.6℃。H3BO3和NH4Cl作为成核剂时4组体系各自平均相变温度分别为23.8和22.6℃,平均过冷度为6.3和8.7℃,表明对过冷问题改善效果也不甚理想。由以上研究可知,所添加的成核剂除NH4Cl外都增高体系的相变温度,上述成核剂对该体系过冷问题改善效果的大小顺序为Sr Cl2·6 H2O>BaCO3>BaCl2>H3BO3>NH4Cl,而Sr CO3不仅没有减小该体系的过冷度,反而增大了其过冷度。
3.2 羧甲基纤维素钠对CaCl2·6H2 O+7%Ca(NO3)2·4H2 O盐水分离现象的改性研究
根据文献报道和我们前期对盐水分离现象研究得出对于低结晶水合物适宜的增稠剂为羧甲基纤维素钠(CMC)[13-14]。因此在本研究中将CMC作为该研究体系的增稠剂,并分别将不同质量分数的CMC(0.5~12%)与储能材料混合后测定其步冷曲线。如图3所示,随着CMC添加量的变化,储能材料的相变温度变化不大,熔盐结晶时均无盐水分离现象产生,但过冷温度在10℃及以下,加剧了熔盐的过冷现象。由此我们可以推断增稠剂CMC的加入只能改善熔盐的盐水分离问题,使储能材料有持久的储能效率,而没有改善其过冷问题。
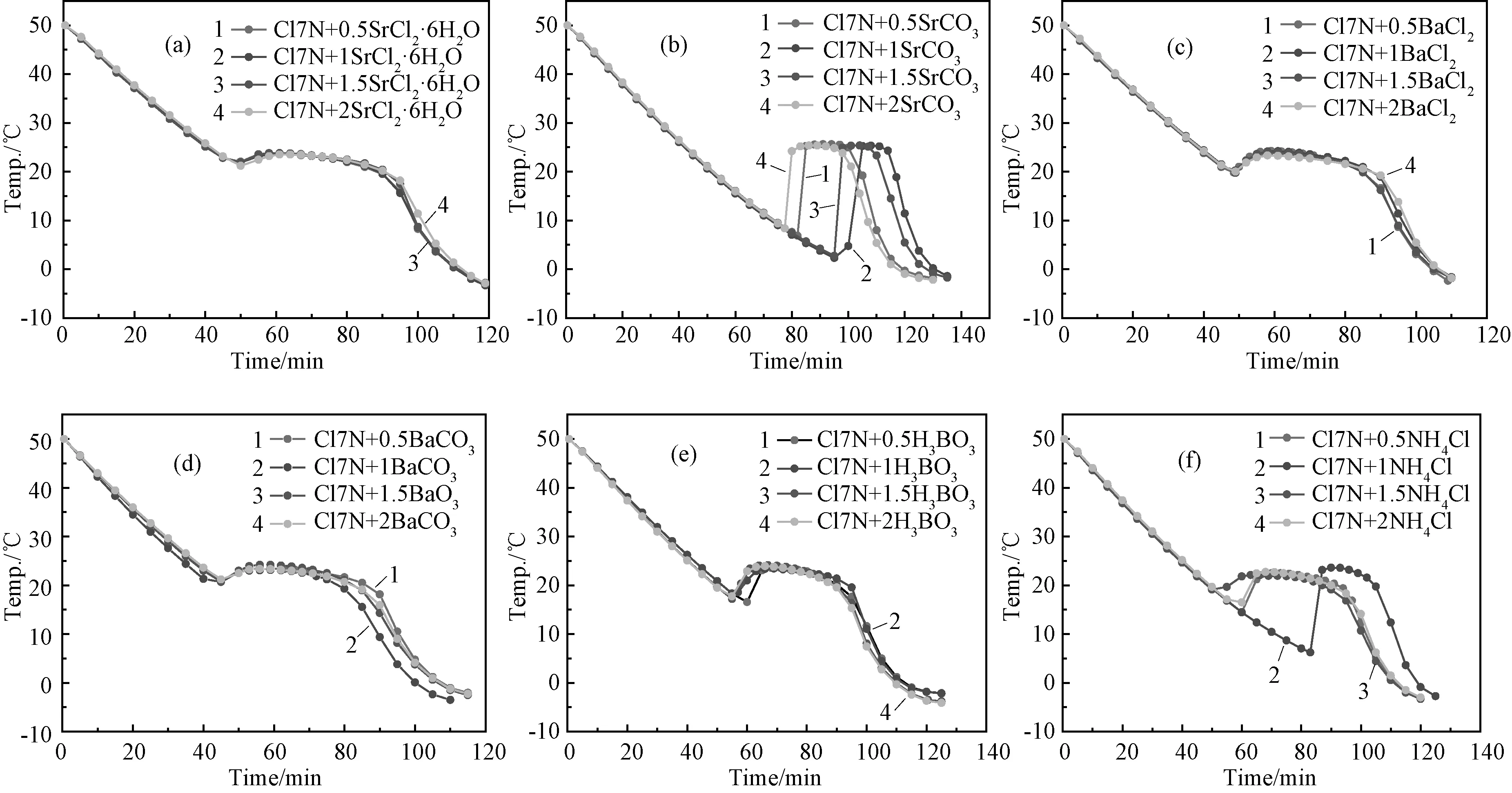
图2 混合熔盐CaCl2·6H 2 O+7%Ca(NO3)2·4H 2 O(Cl7N)中添加不同类型和比例成核剂后体系的步冷曲线图:(a)Cl7N+w%SrCl2·6H 2 O(w%:0.5;1;1.5;2);(b)Cl7N+w%SrCO3(w%:0.5;1;1.5;2);(c)Cl7N+w%BaCl2·6H 2 O(w%:0.5;1;1.5;2);(d)Cl7N+w%BaCO3(w%:0.5;1;1.5;2);(e)Cl7N+w%H 3 BO3(w%:0.5;1;1.5;2);(f)Cl7N+w%NH4 Cl(w%:0.5;1;1.5;2)Fig.2 Cooling curves of eutectic hydrate salts CaCl2·6H 2 O+7w%Ca(NO3)2·4H 2 O(Cl7N)with different nucleating agents
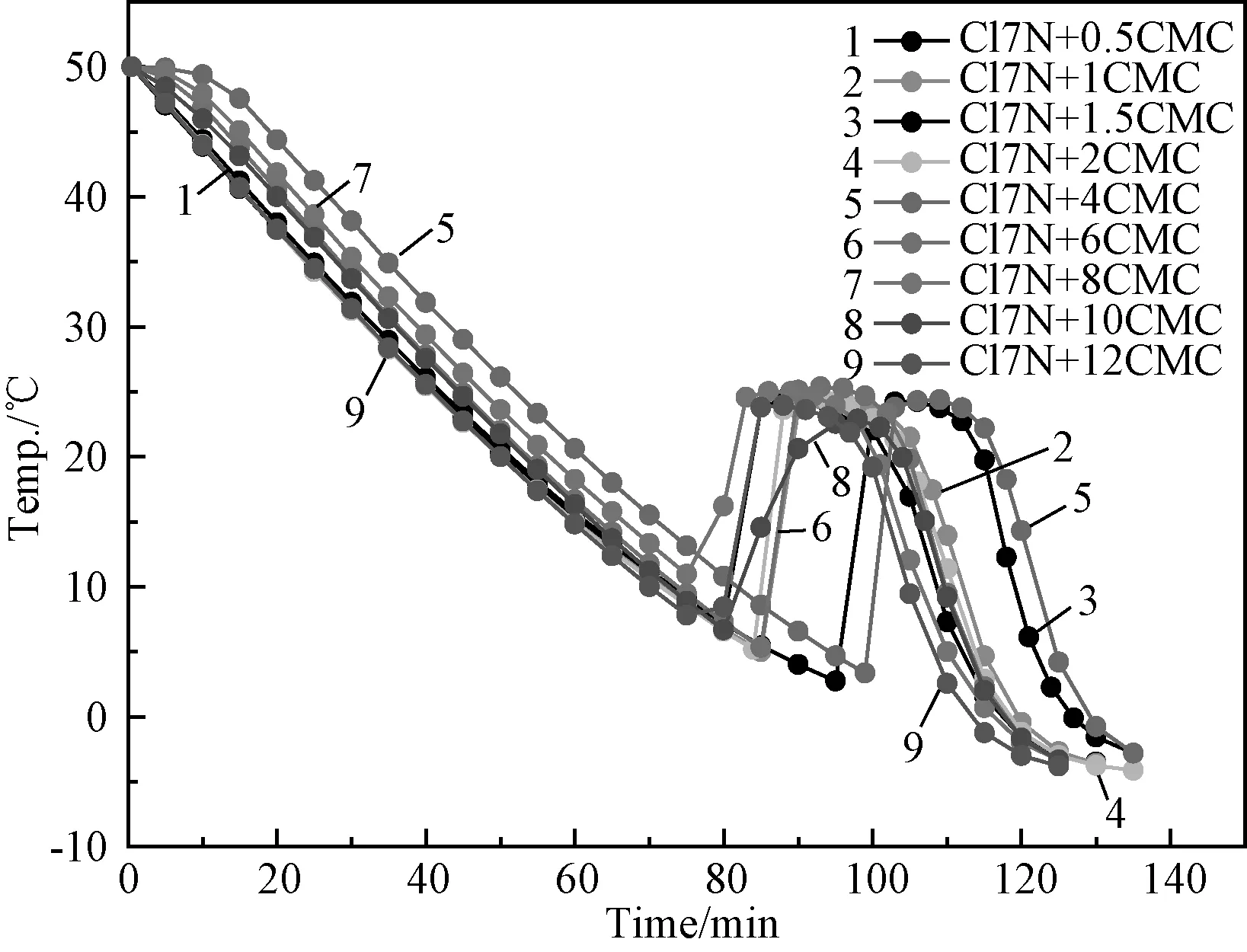
图3 混合熔盐 CaCl2·6H 2 O+7%Ca(NO3)2·4 H 2 O(Cl7N)中添加不同质量分数CMC后体系的步冷曲线图Fig.3 Cooling curves of eutectic hydrate salts CaCl2·6H 2 O+7%Ca(NO3)2·4 H 2 O(Cl7N)with different content of CMC
3.3 均匀实验及结果分析
为进一步分析成核剂和增稠剂对材料储能性能的影响,采用均匀实验法研究混合添加剂的添加量和熔盐过冷度之间的关系。依据单因素实验结果,选取Sr Cl2·6 H2O、BaCO3、BaCl2和CMC 4种因素和10组实验水平进行研究,即选用均匀设计实验表U10(108)进行实验设计。
表1是混合添加剂对过冷问题改性后的结果,图4是相应的步冷曲线。由上述结果可知,用均匀实验法设计出的混合添加剂对该体系的过冷问题有明显改善作用,使混合熔盐的相变温度基本保持在24.3℃左右,平均过冷温度在21.6℃左右,平均过冷度为2.7℃,最低过冷度为2.3℃,最高过冷度为3.4℃。以上研究中7组实验的熔盐过冷度在2.3~2.7℃,3组实验的过冷度接近于3℃。表明用上述4种添加剂对过冷问题进行改性是合理的。为了进一步分析混合添加剂中添加剂的类型和含量对材料储能性能的影响,采用二次项逐步回归分析法对上述不同组分熔盐的过冷度Y3进行分析,得到上述因素(X)与过冷度(Y3)间数学关系模型,如式(1)所示:
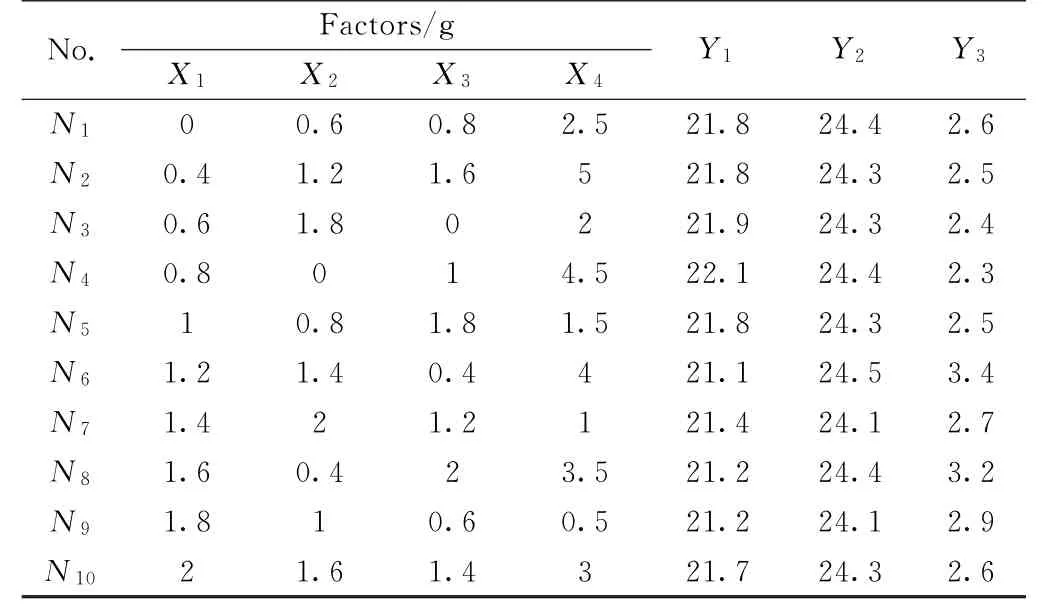
表1 均匀设计表及其实验结果Table 1 Design modification data through uniform experimental process
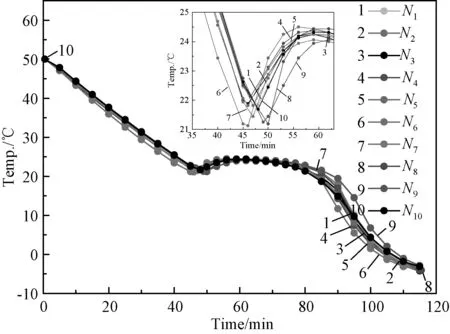
图4 均匀实验给出的混合熔盐CaCl2·6H 2 O+7%Ca(NO3)2·4H 2 O(Cl7N)的步冷曲线图Fig.4 Cooling curves of eutectic hydrate salts CaCl2·6H 2 O+7%Ca(NO3)2·4H 2 O(Cl7N)obtained by uniform experiment

此回归方程相关系数R=0.9999,调整后的相关系数Ra=0.9992,总体显著性检验值F=731.06,显著水平达到P=0.0288,说明该方程的可信度较高。根据表2中各因素显著性检验值t可推出混合添加剂中各因素对过冷度的影响大小顺序是X1>X1×X4>X1×X3>X1×X2>X1×X1。X3×X3和X2×X4项p值大于0.05,因此在本体系中可以剔除。BaCl2,BaCO3和CMC 3种添加剂共同存在可能增大熔盐过冷度。通过以上分析和单因素实验研究结论,在该体系中将Sr Cl2·6 H2O作为主成核剂,BaCl2为辅助成核剂,CMC为增稠剂,采用均匀实验表U5(53)将设计得到的混合添加剂添加到熔盐中测定其步冷曲线。
表3为用均匀实验设计得出的混合添加剂配比测得的实验结果。如表所示本实验中过冷温度Y1与表1中的过冷温度Y1相比变化不大,均在24℃附近,而过冷度比表1又有一定程度的改善。在该实验中最大过冷度为3.3℃,最小过冷度仅为1.7℃。在N1实验水平下3种添加剂的添加量分别为0、0.5和1.5%,其过冷度最大,表明在该体系中成核剂的添加量过少。在N3实验水平下3种添加剂的添加量分别为1、0和0.5%,其过冷度为2.9℃,其过冷度较大的原因也可归结为成核剂量过少,且增稠剂包围住成核剂使其失去改性的能力。随着成核剂量的增加如实验水平N2,N4,N5,熔盐的过冷度也随之降低。采用二次项逐步回归法分析给出成核剂添加量(X)和熔盐过冷度(Y3)之间的数学关系式,如式(2)所示:
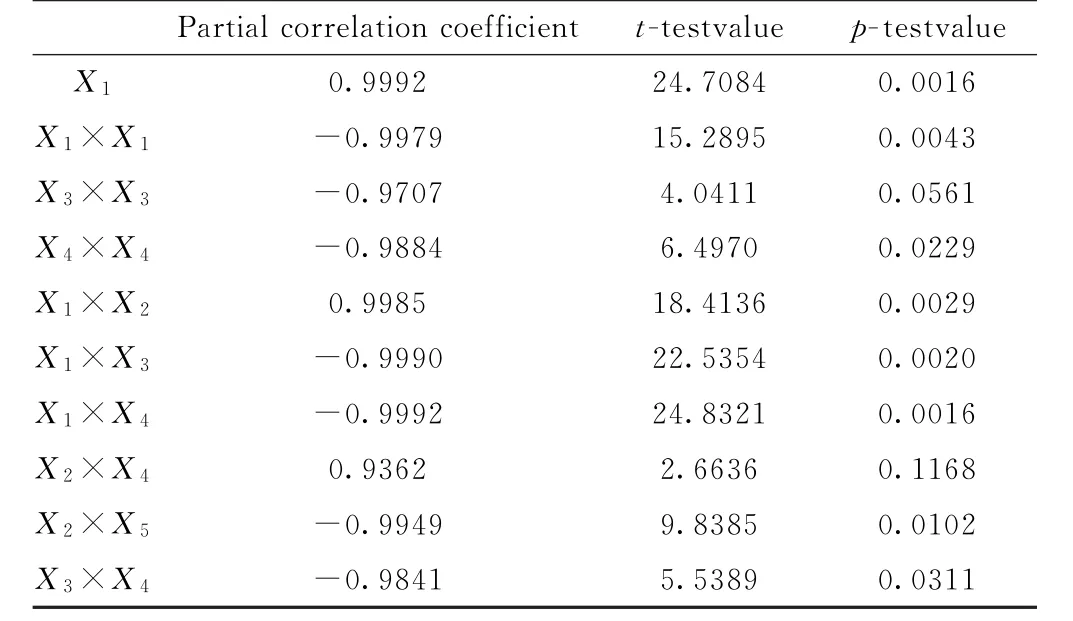
表2 二次项回归分析检验值Table 2 Test value obtained by quadratic term regression analysis

表3 由均匀设计表得到的实验结果Table 3 Design modification data through uniform experimental process

此回归方程相关系数R=1.0000,调整后的相关系数Ra=1.0000,总体显著性检验值F=26005,显著水平达到p=0.0046,因此该方程的可信度非常高。从上述方程可看出X1×X3项可增大熔盐的过冷度,X1×X2对降低熔盐过冷度有显著效果,因此在该体系中可适当减小增稠剂X3的量。二次项回归分析同时给出Y3最小值为1.28℃时,X1,X2,X3的最适宜添加量分别为2,1和0,考虑到在实际应用中盐水分离问题,故在该优化配比中加入0.5%的CMC增稠剂。图5给出该配方的混合熔盐在改性前后的步冷曲线,如图所示改性前后混合熔盐的相变温度几乎保持不变,而过冷度从纯混合熔盐的15℃减小到1.8℃,与理论计算获得的1.28℃相近。我们同时测量了改性前后储能材料的相变焓值,发现改性后相变焓值约为135J/g,比改性前减小了约5J/g。因此添加剂对该材料的相变焓值影响不大。由此可见,该储能材料是一种具有广泛应用前景的中低温储能材料。
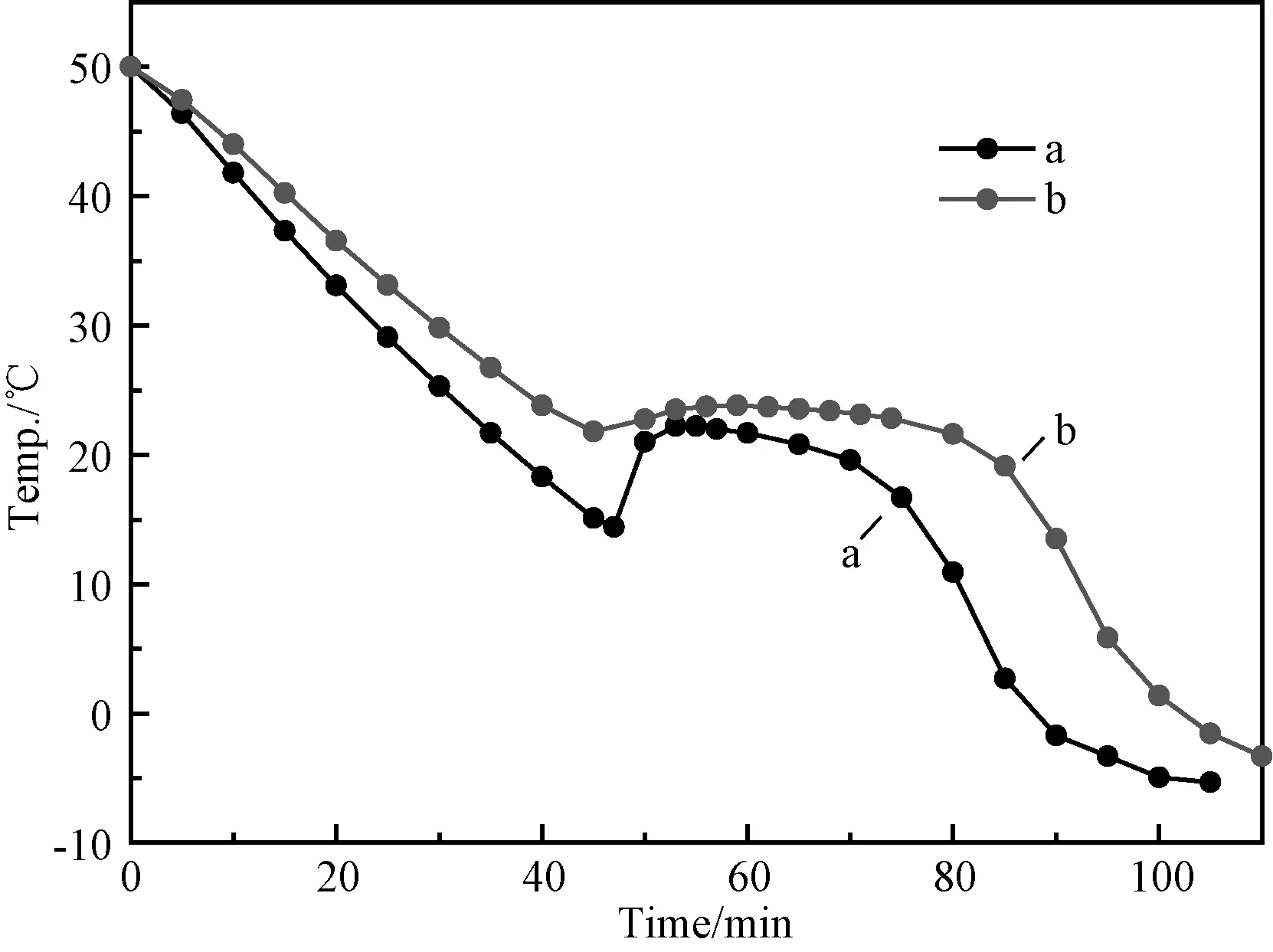
图5 添加混合成核剂前后熔盐CaCl2·6H 2 O-7%Ca(NO3)2·4H 2 O(Cl7N)的步冷曲线图 (a)纯CaCl2·6 H 2 O-7%Ca(NO3)2·4H 2 O;(b)Cl7N+2%SrCl2·6H 2 O+1%BaCl2+0.5%CMCFig.5 Cooling curve comparison between before and after adding the agents
3.4 熔盐结构研究
为了进一步研究水合盐结晶过程中发生过冷和盐水分离问题的熔盐结构原因,采用拉曼光谱法和密度泛函理论研究熔盐中存在的微观物种,从微观结构角度对上述现象进行解释。图6为一系列氯化钙、硝酸钙溶液中水的拉曼光谱图。
从图6可见当CaCl2溶液浓度在0~0.01mol/kg范围内时,溶液中水的谱图和纯水的几乎重合在一起。因此在该浓度范围内主要为自由离子和自由水分子。当溶液浓度达到1.6mol/kg时拉曼频率发生蓝移,3231cm-1处峰强度减小,而3386cm-1处峰强度增大,表明随着氯化钙含量增加,溶液中自由水的结构被破坏,生成新物种。当溶液浓度达到1.6mol/kg时溶液中自由水分子逐渐变成共享水分子。当溶液浓度增大到4mol/kg时3231cm-1处峰几乎变为平滑的曲线,而3386cm-1处峰蓝移约43cm-1,且该峰强度增强。在该浓度下低频率处峰和1.6mol/kg处相比发生明显变化,且高频率处峰也有一定的蓝移现象。因此当CaCl2浓度在4mol/kg时溶液中水分子类型发生了变化,溶液中氯离子和钙离子生成接触离子对,水分子直接水合,在钙离子第一水合层形成接触水分子。当溶液浓度为9.25mol/kg时,即融熔态六水氯化钙中水的拉曼峰位移几乎和4mol/kg时一样,但高频率处峰的强度明显增强,表明溶液中微观物种的类型变化很小,即为直接接触水分子,其量有所增大,说明当浓度进一步增大时少量的共享水分子转变为接触水分子。由此可确定六水氯化钙熔盐中微观物种为直接接触离子对。Ca(NO3)2溶液中水的拉曼谱图也有相似的变化趋势,但估计是随着溶液浓度增大,NO3-的对称伸缩振动频率强度逐渐增强,对水分子峰产生影响,因此在浓溶液中水的拉曼峰强度减小。当溶液浓度为0.031mol/kg时溶液中水分子主要为自由水分子,随着溶液浓度逐渐增大,水分子逐渐从自由水分子转化为共享水分子。因此可以推测在Ca(NO3)2浓度3.3~6.1mol/kg时溶液中水分子主要为共享水分子,当溶液浓度为17.2mol/kg时,水分子与钙离子水合,形成接触离子对,即在四水硝酸钙熔盐中存在的主要物种为直接接触离子对。
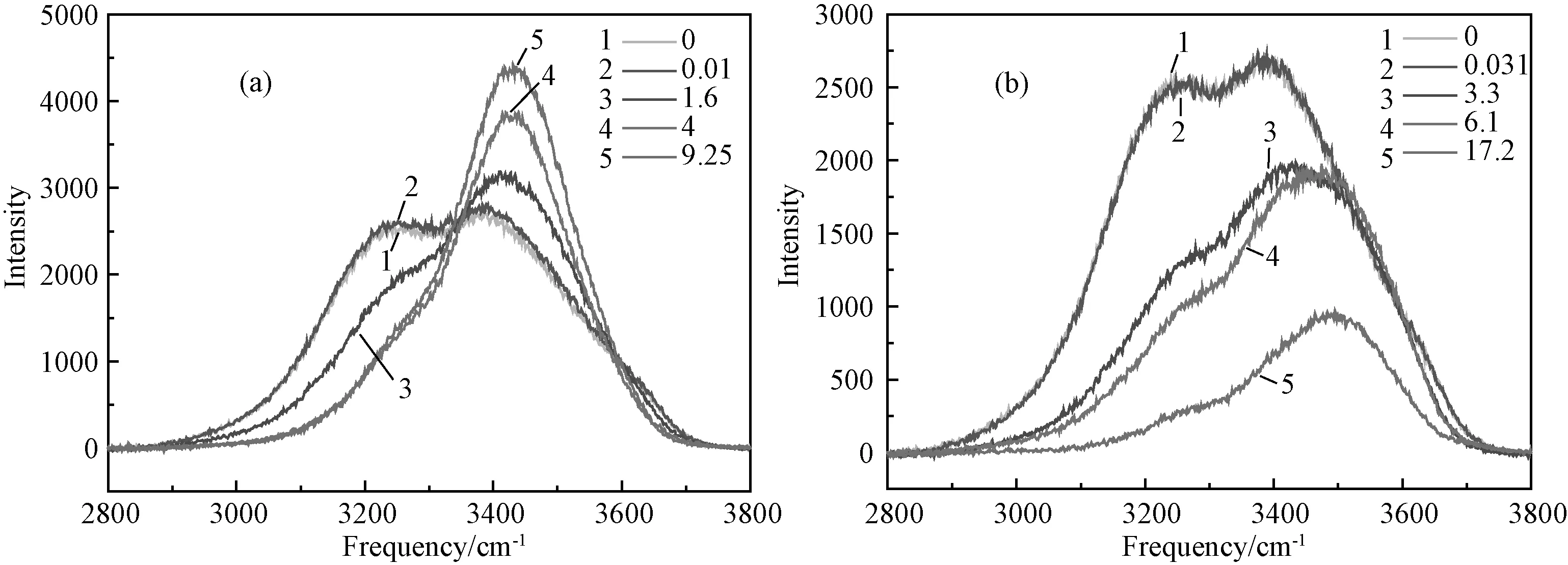
图6 不同浓度(mol/kg)的CaCl2(a)和Ca(NO3)2(b)溶液中水的拉曼光谱图Fig.6 Raman spectra of water in aqueous CaCl2(a)and Ca(NO3)2(b)solution at various concentrations
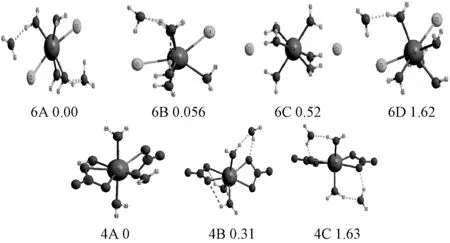
图7 CaCl2(H 2 O)n=6和Ca(NO3)2(H2 O)n=4的优化结构Fig.7 Optimized geometries of the typical low-lying isomers of CaCl2(H 2 O)n=6 and Ca(NO3)2(H 2 O)n=4
为了明确CaCl2·6H2O和Ca(NO3)2·4H2O熔盐中微观物种的结构细节,采用密度泛函理论对上述熔盐中存在微观结构进行结构优化和能量分析,给出能量最稳定结构的类型。如图7所示,CaCl2与6个H2O水合时能量最低结构为6A,4个水分子在钙离子第一水合层水合,新添加水分子和第一水合层水分子相互作用形成氢键,形成第二水合层。水分子和钙离子第一水合层水合距离(rCa-O(H2O)I)为2.41Å,Ca…Cl平均距离为2.7Å,水分子间形成氢键(H2O)O…O(H2O)距离为2.77Å,属于中等强度氢键[28]。在6B中5个水分子水合在第一水合层,另一水分子中氧原子与第一水合层2个水分子中的氢原子形成氢键,水合在第二水合层。6C中6个H2O全部与CaCl2形成第一水合层,2个氯离子发生解离,与钙离子形成溶剂共享离子对Ca(H2O)6Cl2,Ca…Cl距离为4.21Å。在6D中5个水分子水合在第一水合层,Ca-O(H2O)距离为2.47Å,另一水分子通过氢键水合在第二水合层。通过能量对比可知,6A和6B的能量只差0.056kcal/mol,在上述结构中它们为主要物种。6C,6D的能量与最稳定结构6A的能量差分别为0.52和1.62kcal/mol,为次要物种。由上述研究可知在六水氯化钙熔盐中钙离子和氯离子除6C中形成溶剂共享离子对外,主要以接触离子对形式存在。
如图7所示,当4个H2O与Ca(NO3)2发生水合时主要有3种稳定结构4A,4B,4C。在4A中4个水分子直接与Ca(NO3)2形成第一水合层,两个NO-3与Ca2+形成双齿配位,Ca2+和NO-3中氧原子间距离(rCa-O(NO-3))为2.47Å,rCa-O(H2O)I为2.44Å。在4B中3个水分子直接与Ca(NO3)2形成第一水合层,2个NO-3与 Ca2+形成双齿配位,rCa-O(NO-3)为2.43Å,rCa-O(H2O)I为2.41Å,另一水分子通过氢键水合在第二水合层。上述2种结构的能量相差0.31kcal/mol,表明4个H2O与Ca(NO3)2水合时4A和4B同时存在。4C中2个H2O与Ca2+形成第一水合层,另外2个H2O与第一水合层水分子通过氢键形成第二水合层,由于其能量与4A相差较大,且第一水合层水合未饱和,因此该结构存在可能性较小。通过以上研究可知,Ca(NO3)2(H2O)n=0-4中,2个NO-3与Ca2+形成双齿配位,水分子直接和钙离子在第一水合层发生水合,形成最稳定的水合异构体,新增水分子通过氢键方式与内层水分子发生水合,形成第二水合层。因此,我们采用密度泛函理论研究给出的熔盐中存在微观物种的结构与拉曼光谱研究结论一致。
通过以上研究得知,水合熔盐发生相变的主要因素是水分子间形成的氢键。氢键的形成和破坏导致熔盐发生相变。在熔盐中加入成核剂的主要目的是破坏熔盐中存在的介稳状态,迫使其发生相变。在熔盐中加入增稠剂改善盐水分离现象的原因可以从微观结构上解释为增稠剂将微观物种牢固地包围起来,增强了氢键强度,对外表现为阻止盐水分离现象的发生。
4 结 论
本文 选 用 成 核 剂 SrCl2·6H2O、SrCO3、BaCl2、BaCO3、H3BO3和NH4Cl来改善相变储能材料CaCl2·6H2O-7%Ca(NO3)2·4H2O的结晶过冷问题和盐水分离问题。通过单因素实验得出它们对过冷问题的改善效果大小顺序是SrCl2·6H2O>BaCO3>BaCl2>H3BO3>NH4Cl>Sr CO3,后两者对过冷问题基本没有改善作用。增稠剂CMC对熔盐的盐水分离问题有一定的改善。均匀实验和二次项逐步回归分析法研究给出由上述添加剂组成的混合成核剂的最优配比为Sr Cl2·6H2O(2%)、BaCl2(1%)和 CMC(0.5%)。和纯混合熔盐储能材料相比,添加混合成核剂后熔盐的过冷度由10℃及以下温度降低到1.8℃左右;相变焓变化不大,在140J/g范围内。对熔盐微观结构研究表明,熔盐CaCl2·6H2O中4个 H2O在Ca2+的第一水合层水合,另外2个H2O通过与内层水分子形成氢键在第二水合层水合,而在熔盐Ca(NO3)2·4H2O中4个H2O全部水合在Ca2+的第一水合层,水合水分子间形成氢键。水分子间氢键的形成或破坏是熔盐发生相变的关键因素。

