三种分子生物学方法检测结核分枝杆菌耐药性的效能分析
马进宝 杨翰 任斐 党丽云
作者单位:710100 西安市胸科医院
耐药结核病的发生给控制结核病带来了巨大挑战,及时、准确地获得患者耐药情况是治疗及控制耐药结核病的关键[1]。目前,表型药物敏感性试验(简称“表型药敏试验”)仍是诊断结核分枝杆菌(MTB)耐药性的主要方法。然而,表型药敏试验获取结果时间较长,如BACTEC MGIT 960系统培养,其取得结果时间平均为18 d[2]。这使得患者无法获得及时和有效的治疗,从而导致其痰菌载量增加,肺损伤加重及传染性持续[3]。分子生物学检测方法能够快速检测MTB耐药性,如GeneXpert MTB/RIF(简称“GeneXpert”)检测在2 h内便能获得利福平(RFP)耐药结果。《结核病病原学分子诊断专家共识》认为GeneXpert、基因芯片、实时荧光定量PCR熔解曲线法(简称“PCR熔解曲线法”)等技术检测MTB耐药性有较好的敏感度及特异度[4]。《WS 288—2017 肺结核诊断》标准已将分子生物学检查阳性作为肺结核病原学诊断依据[5],然而对于分子生物学检查能否作为MTB耐药性诊断依据仍存在一定的争议,且对于何种分子生物学检测方法更优亦无定论。笔者通过分析GeneXpert、基因芯片、PCR熔解曲线法检测MTB耐药性的效能,评价3种方法的临床应用价值。
资料和方法
1.研究对象:选取2017年1月至2018年1月西安市胸科医院有表型药敏试验结果的痰MTB培养阳性的774例肺结核患者作为研究对象,其中,男521例(67.3%),女253例(32.7%);年龄6~96岁,平均年龄(38.5±18.9)岁;初治637例(82.3%),复治137例(17.7%);异烟肼(INH)耐药210例(27.2%),RFP耐药142例(18.4%),耐多药133例(17.2%)。774例患者均有一、二线抗结核药物表型药敏试验结果,其中357例患者GeneXpert检测阳性,727例患者基因芯片检测阳性,201例患者PCR熔解曲线法检测阳性。
2.液体培养及药敏试验:采用BACTEC MGIT 960培养系统进行液体培养,参照《结核分枝杆菌药物敏感性试验标准化操作程序及质量保证手册》[6]操作。取处理好的痰标本0.5 ml加入MGIT液体培养管中,放入BACTEC MGIT 960培养系统中进行培养,培养阳性标本,进一步用MPB64单克隆抗体(杭州创新生物检控技术有限公司)进行测定,鉴定为MTB菌株进行表型药敏试验。一线抗结核药物INH和RFP耐药性应用BACTEC MGIT 960液体药敏试验检测,INH药物浓度为0.1 μg/ml,RFP药物浓度为1.0 μg/ml;二线抗结核药物耐药性应用比例法药敏试验检测,左氧氟沙星(Lfx)药物浓度为2 μg/ml,莫西沙星(Mfx)药物浓度为2 μg/ml,阿米卡星(Am)药物浓度为30 μg/ml,卷曲霉素(Cm)药物浓度为40 μg/ml。
3.GeneXpert检测:取1 ml痰标本放置在有螺旋盖的前处理管中,然后加入相当于痰标本2倍体积的检测样品试剂(SR),旋紧前处理管,在涡旋振荡器上振荡15~30 s,室温静置15 min,使痰标本充分液化。打开反应盒,使用试剂盒内提供的专用无菌吸管,取2 ml处理后样品由加样孔缓慢加入反应盒,然后将反应盒放置到检测模块,仪器开始自动化检测。接种后的痰标本消化液按照 GeneXpert(美国 Cepheid 公司)标准化操作手册步骤进行操作[7]。
4.基因芯片检测:基因芯片检测系统及配套试剂均由北京博奥生物有限公司生产,将消化液(10 ml 2.94%柠檬酸三钠、10 ml 4%氢氧化钠、0.1 g 乙酰半胱氨酸)预处理好的痰标本放入晶芯Extractor 核酸快速提取仪中提取核酸,将提取的核酸放入基因扩增仪中进行扩增,基因扩增产物经变性后加入到MTB 耐药检测试剂盒的芯片点阵中,然后放入晶芯BioMixer Ⅱ杂交仪进行芯片反应,再将完成杂交的芯片放入晶芯 Slide Washer芯片洗干仪中进行洗干,将洗干的芯片载入晶芯LuxScan10K-B微阵列芯片扫描仪中,自动进行结果判读。
5.PCR熔解曲线法:由厦门致善生物科技股份有限公司研发。取处理好痰标本1 ml加入有螺旋盖的前处理管中,加入相当于痰标本2倍体积的处理液,旋紧管口振荡15~30 s,室温静置15 min,打开反应盒,取2 ml处理好的标本由加样孔缓慢加入反应盒,然后将反应盒放在检测模块,仪器自动检测,反应结束后在窗口下直接观察结果。
6.统计学分析:使用SPSS 18.0软件进行分析,计算各检测方法检测效能:敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。两种方法检测结果一致性用Kappa值判定,Kappa值≥0.75说明一致性好,Kappa值<0.4说明一致性差,0.75>Kappa值≥0.4说明一致性一般。使用MedCalc 18.2.1软件分析受试者工作特征曲线(ROC曲线)下面积,曲线下面积差异性分析使用Z检验,检验水准α=0.05。
结 果
1. GeneXpert检测:357例GeneXpert检测阳性患者中有初治患者264例(74.0%),复治患者93例(26.0%)。其中,表型药敏试验检测RFP耐药91例(25%),GeneXpert检测RFP耐药104例(29%)例。以表型药敏试验结果为参照标准,GeneXpert检测MTB对RFP耐药性的敏感度为95.6%,特异度为93.6%,阳性预测值及阴性预测值分别为83.7%、98.4%,两种方法有较好的一致性。分别对初、复治患者进行检测,GeneXpert检测初治患者对RFP耐药性的阳性预测值较低,而检测复治患者对RFP耐药性的阳性预测值为95.1%,见表1。
2.基因芯片检测:727例基因芯片检测阳性患者中有初治患者616例(84.7%),复治患者111例(15.3%);其中,表型药敏试验检出RFP耐药97例(13.3%),INH耐药165例(22.7%);基因芯片检出RFP耐药110例(15.1%),INH耐药135例(18.6%)。以表型药敏试验结果为参照标准,基因芯片法检测MTB对RFP耐药性的敏感度和特异度分别为92.8%和96.8%;分别检测初、复治患者,基因芯片检测初治患者对RFP耐药性的阳性预测值较低(71.9%);检测初、复治患者对RFP耐药性的阴性预测值均大于94%。两种检测方法检测MTB对RFP耐药性有较好的一致性,见表2。以表型药敏试验结果为参照标准,基因芯片法检测MTB对INH耐药性的敏感度和特异度分别为78.8%和99.1%,阳性预测值及阴性预测值分别为96.3%和96.1%,两种方法检测MTB对INH耐药性的一致性较好,见表3。
3. PCR熔解曲线法:201例患者PCR熔解曲线法检测阳性,以表型药敏试验结果为参照标准,PCR熔解曲线法检测MTB对一线抗结核药物、氟喹诺酮类药物及二线注射类抗结核药物耐药性的效能见表4。PCR熔解曲线法检测MTB对RFP及INH耐药性的阳性预测值及阴性预测值均较高,与表型药敏试验一致性较好;检测MTB对二线药物Lfx和Am耐药性的效能与表型药敏试验一致性较好;但检测MTB对Mfx、Cm耐药性的效能与表型药敏试验一致性一般。

表1 GeneXpert检测以表型药敏试验结果为标准检测MTB对利福平耐药性的效能
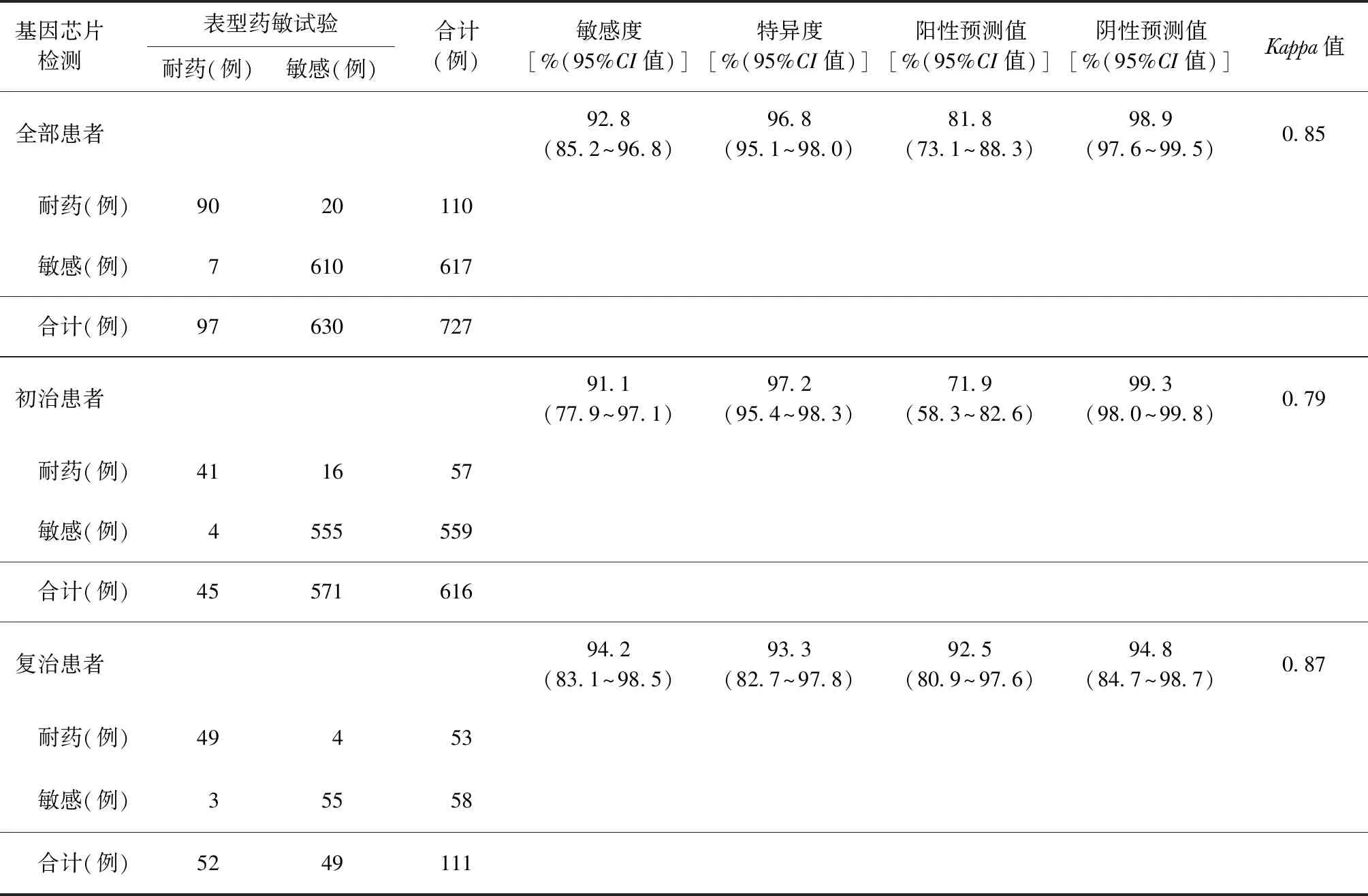
表2 基因芯片法以表型药敏结果为参考标准检测MTB对利福平耐药性的效能
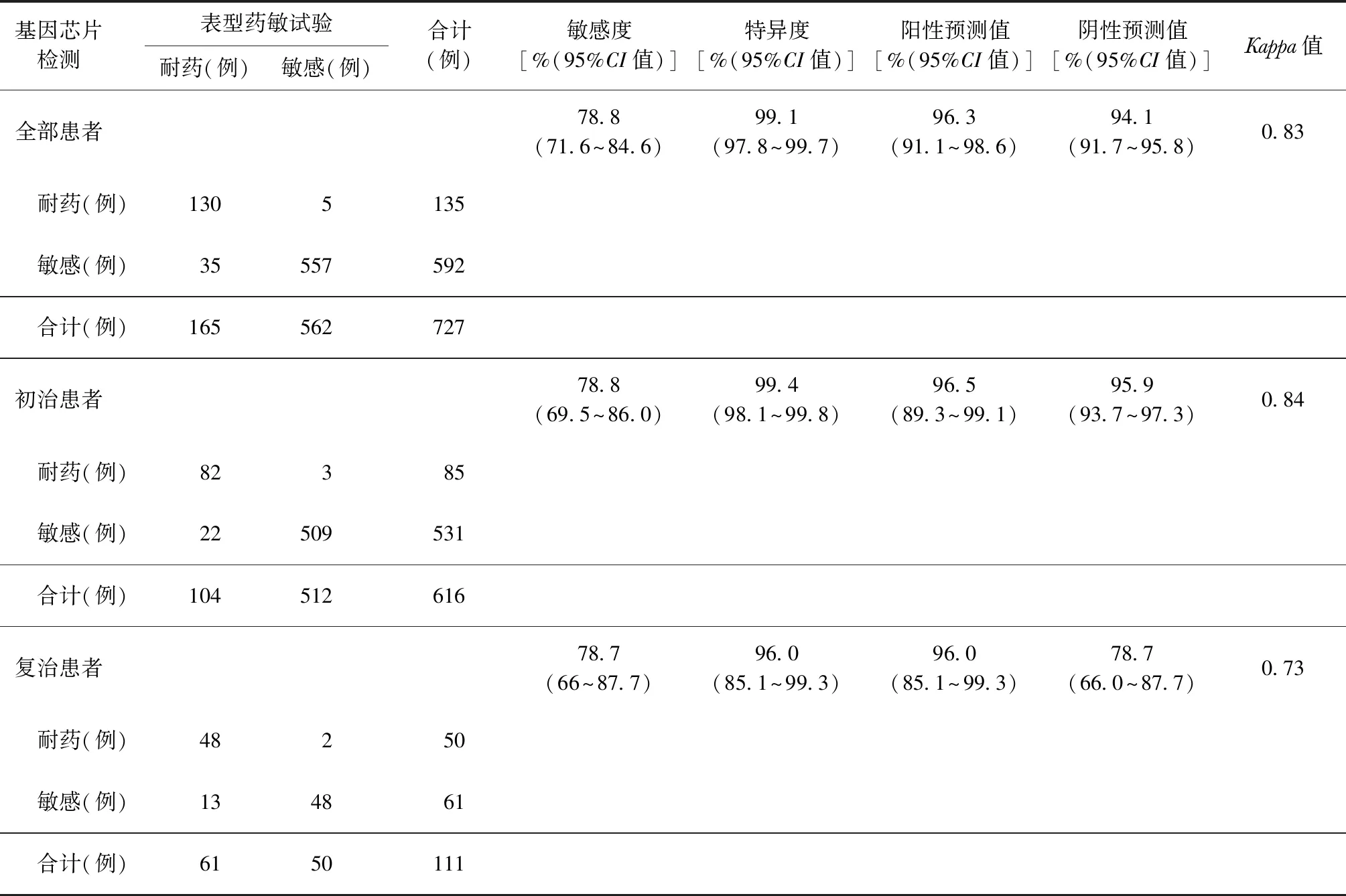
表3 基因芯片法以表型药敏结果为参考标准检测MTB对异烟肼耐药性的效能
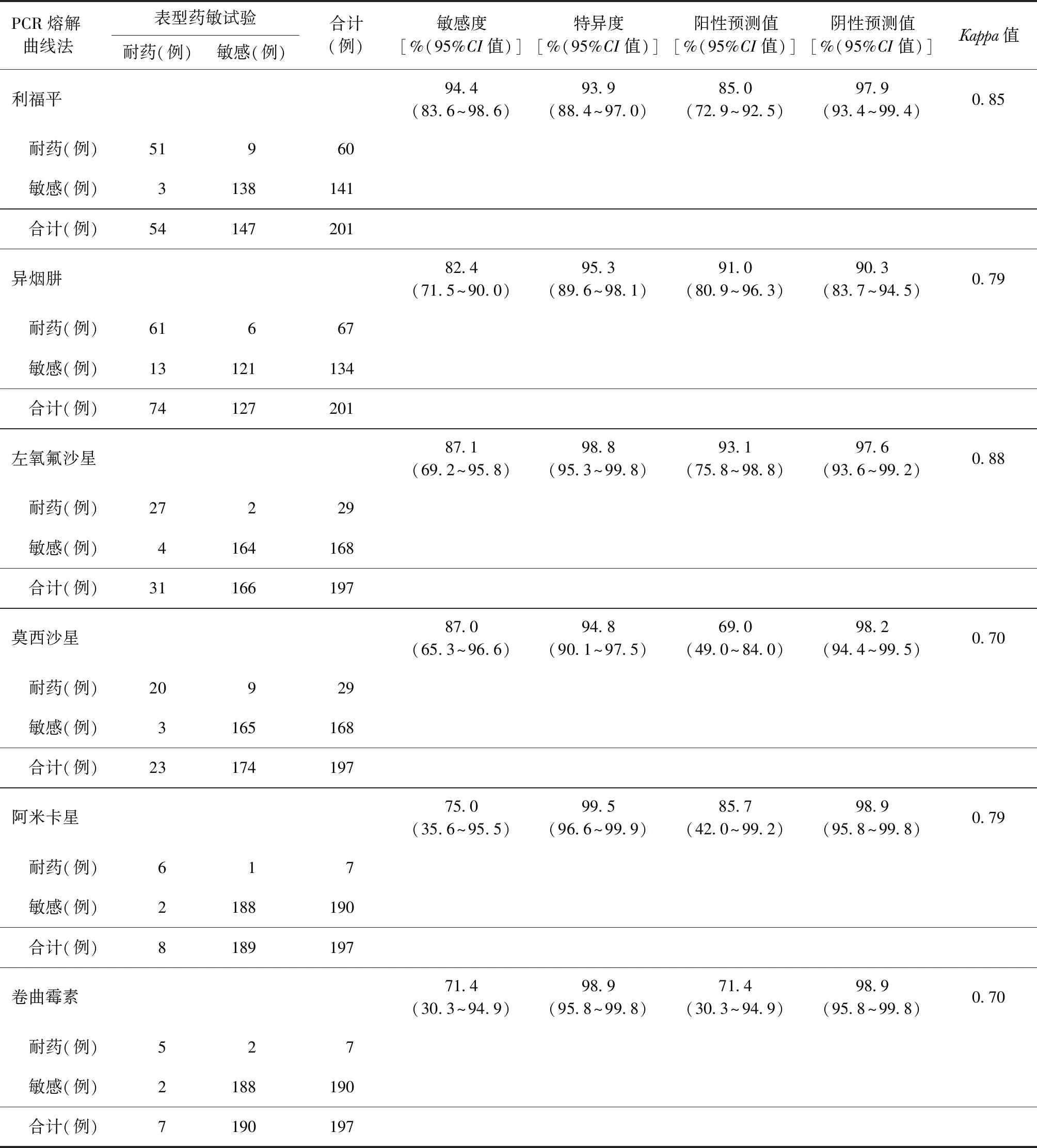
表4 PCR熔解曲线法以表型药敏试验结果为标准检测结核分枝杆菌耐药性的效能
4. ROC曲线分析:以表型药敏试验结果为参照标准,绘制3种分子生物学检测方法检测MTB对RFP耐药性ROC曲线,GeneXpert法ROC曲线下面积大于基因芯片及PCR熔解曲线法ROC曲线下面积,GeneXpert法ROC曲线下面积为0.95±0.02,基因芯片法和PCR熔解曲线法ROC曲线下面积均为0.93±0.03,三种方法曲线下面积差异无统计学意义(Z=0.87,P=0.387)(图1)。
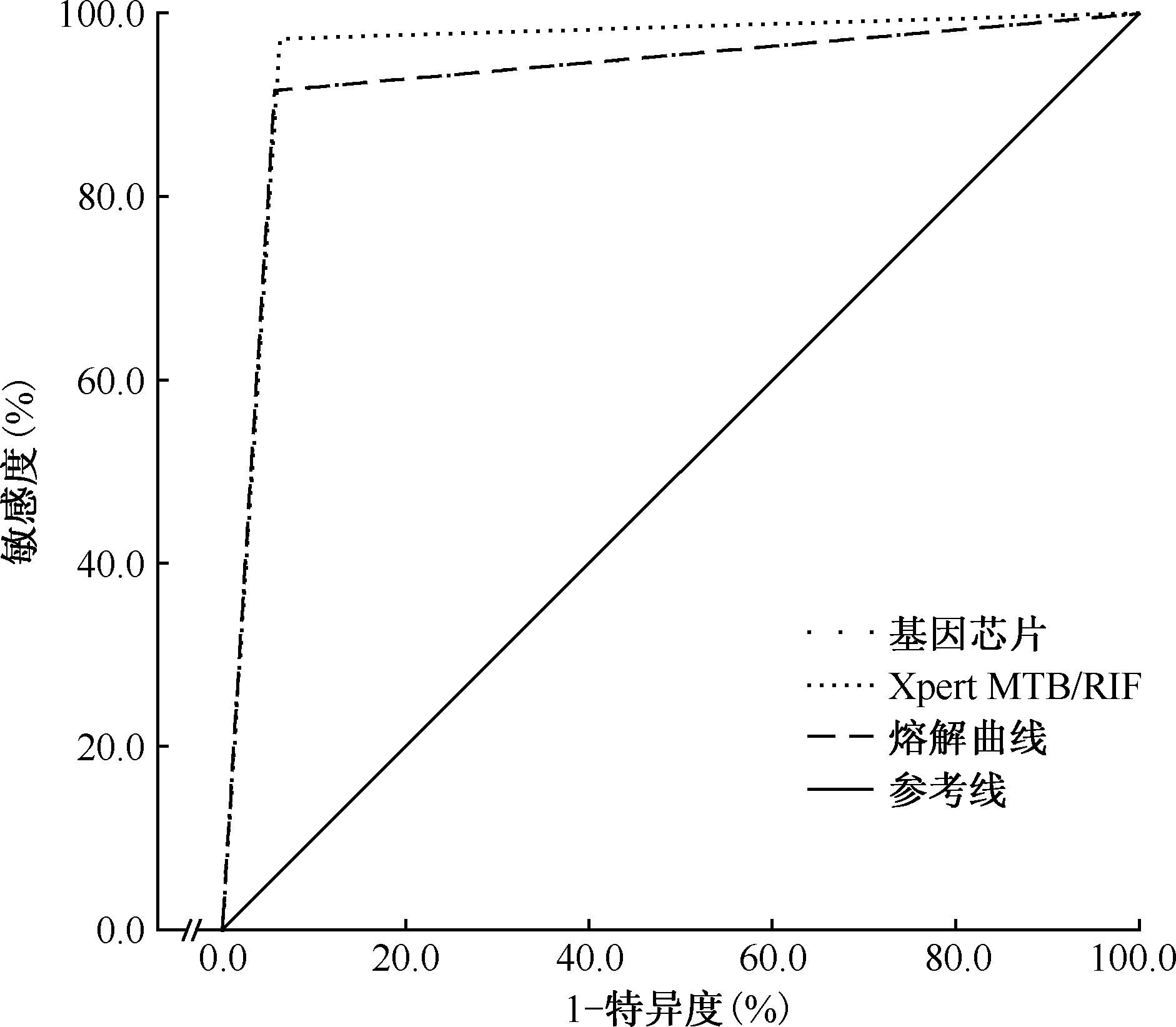
基因芯片与PCR熔解曲线法ROC曲线完全重合图1 以表型药敏试验结果为标准,3种分子生物学方法检测MTB对RFP耐药性的ROC曲线
讨 论
本研究结果显示,3种分子生物学方法检测MTB对RFP耐药性均比较可靠(Kappa值均大于0.75),考虑是因为GeneXpert、基因芯片法及PCR熔解曲线法均通过测定MTB的rpoB基因突变检测RFP耐药。并且,RFP耐药MTB的rpoB基因突变率为95%[8]。本次研究中,GeneXpert检测MTB对RFP耐药性的敏感度和特异度分别为95.6%和93.6%,与国内文献报道一致[9-10],比较ROC曲线下面积发现GeneXpert的曲线下面积大于其他两种方法,这可能与GeneXpert是集痰标本处理、DNA提取、核酸扩增、MTB特异核酸检测、RFP耐药基因rpoB突变检测于一体的方法有关[11]。
另外,本次研究发现GeneXpert及基因芯片检测MTB对RFP耐药性的阳性预测值在复治患者中高于初治患者,提示这两种方法在复治患者中检出RFP耐药更可靠,考虑是因为在复治患者中RFP耐药发生率较初治患者高有关[12]。根据WHO估计,中国RFP耐药在初、复治患者中发生率分别为12%、69%[13],复治患者中RFP耐药率是初治患者中的5倍。复治患者中GeneXpert及基因芯片检测MTB对RFP耐药性阳性预测值为95.1%和92.5%,与表型药敏试验一致性较好,结果支持《结核病病原学分子诊断专家共识》[4]中提出当分子生物学方法测出RFP耐药时当患者为耐药高危人群时,应同时进行传统的药敏试验,并采用二线抗结核药物治疗的观点。
氟喹诺酮类药物在耐药结核病治疗中至关重要,世界卫生组织(WHO)2016年及2018年耐药结核病治疗指南中氟喹诺酮类药物均在A组药物当中[3,14]。由于近10余年来,氟喹诺酮类药物在临床上的广泛应用,尤其是在我国呼吸和结核病领域的滥用,其耐药率呈逐年上升趋势[15]。因此,在制定耐药患者药物治疗方案时获得氟喹诺酮类药物耐药情况尤为重要,WHO也建议对于RFP耐药结核病患者使用分子生物学方法进行氟喹诺酮类药物药敏试验[16]。本次研究发现,PCR熔解曲线法检测MTB对Lfx及Am耐药性敏感度为87.1%和75.0%,特异度为98.8%和99.5%,且与表型药敏试验有较好的一致性,与Pang等[17]报道一致。因此,笔者认为在获得表型药敏试验结果之前制定耐药结核病患者药物治疗方案时,可根据PCR熔解曲线法检测结果选择Lfx和Am。
本次研究显示,以表型药敏试验结果为参照标准,基因芯片检测INH耐药性敏感度和特异度分别为78.8%和99.1%,与林明冠等[18]报道一致,但阳性及阴性预测值与该文献报道结果有异,可能与所选研究对象INH耐药率不同及对照方法不同有关。另外,笔者发现基因芯片法检测INH耐药性的阴性预测值在复治患者中低于初治患者,与Zhu等[19]研究结果基本一致,其阴性预测值均小于90%,说明在复治患者中基因芯片法检出INH敏感时,可信度较差。
PCR熔解曲线法检测MTB对INH耐药性突变基因包括KatG、inhA、ahPc[20]。本次研究显示,PCR熔解曲线法检测MTB对INH耐药性的敏感度和特异度分别为82.4%和95.3%,与Pang等[17]和王晓艳等[21]报道一致,且敏感度均高于本次研究基因芯片法,亦高于林明冠等[18]和Zhang等[22]报道的基因芯片法检测敏感度。这可能与PCR熔解曲线法增加了ahPc位点检测有关,说明随着耐药基因检测位点的完善,分子生物学方法检测效能会增加。
综上所述,本次研究分析了3种分子生物学方法检测MTB耐药性的效能,结果显示3种方法均有较高的敏感度和特异度;分析了在初、复治患者中GeneXpert及基因芯片法检测效能差异,结果显示在不同类型患者中其阳性及阴性预测值不同,提示在临床工作中除了考虑检测方法敏感度与特异度外,需结合患者情况具体分析其临床意义。本次研究不足为INH和RFP表型药敏试验应用BACTEC MGIT 960液体药敏试验,虽然该方法与比例法药敏试验有较好的一致性[11],但仍可能导致结果差异,可能影响对3种分子生物学方法检测效能的判断。另外,本次研究为回顾性分析,且研究对象例数较多,可能导致收集的患者信息(包括年龄、初复治、耐药结果等)存在偏倚。临床应用中比较检测方法优劣时应同时考虑经济因素,但本研究未对该方面问题进行分析。

