腰骶段结核术后复治的原因分析与应对策略
姚黎明 贾晨光 李卓 董昭良 王连波 刘丰胜
作者单位:050041 石家庄,河北省胸科医院骨科
据世界卫生组织报道,全球每年新发结核病患者约900万例,骨关节结核占结核病患者总例数的1%~5%[1]。脊柱结核所占比例居全身骨关节结核的首位,约占50%[2]。腰骶段(通常指腰4~骶2椎体)是脊柱结核的好发部位之一,约占脊柱结核的10%[3]。由于特殊的解剖关系及腰骶段结核的破坏特点,决定了腰骶段结核术后复治方案的制定与实施相对困难[4]。笔者搜集河北省胸科医院骨科收治的腰骶段结核患者,旨在分析腰骶段结核术后复发的影响因素,为降低复治发生率提供参考与指导,同时总结和分析腰骶段结核术后复发患者的治疗方案及临床疗效。
资料和方法
一、研究对象
1. 研究对象的选择:搜集2013年6月至2016年6月河北省胸科医院骨科收治且完成随访的84例腰骶段结核患者。所有患者中,男50例,女34例;年龄16~82岁,平均(42.0±18.3)岁;术后复治患者15例。
2. 纳入标准:诊断明确、具备手术指征并行手术治疗的术后患者,术后标本均经病理诊断证实为结核;术中病灶中的脓液、干酪样坏死组织均于我院行结核分枝杆菌培养及药物敏感性试验(简称“药敏试验”)检查。腰骶段结核术后复治的诊断标准:手术治疗后椎体破坏仍有持续进展;腰大肌脓肿再次形成且经穿刺抽液治疗后仍顽固存在;持续窦道;临床治愈后病灶复发。
3. 复治腰骶段结核的再次手术适应证:(1)临床症状及体征提示有脊髓神经压迫症状,MRI或CT扫描显示有明确肉芽组织、死骨或脓液压迫椎管;(2)存在脊柱失稳或伴有畸形,MRI或CT扫描显示病变侵及植入物界面、植骨复合体移位吸收,内固定物松动失效;(3)残留窦道经3~6个月换药后仍迁延不愈,MRI或CT复查显示窦道与病灶相通;(4)术后病灶部位残留脓肿及死骨,经术后穿刺抽液注药或置管引流治疗后脓肿持续存在。
4. 分组情况:将84例腰骶段结核患者按照是否为术后复治分为两组,15例复治患者作为观察组,69例术后愈合良好未复发的患者作为对照组。观察组中,男10例,女5例;年龄21~68岁,平均(43.0±17.2)岁。对照组中,男40例,女29例;年龄16~82岁,平均(42.0±18.5)岁。两组患者性别(χ2=0.39,P=0.530)和年龄(t=0.07,P=0.950)的比较,差异均无统计学意义,具有可比性。
二、复治患者临床相关资料
术前血红细胞沉降率为26~97 mm/1 h,平均(57.87±23.98) mm/1 h;血红蛋白为80~141 g/L,平均(114.13±20.27) g/L;白蛋白为26.40~44.50 g/L,平均(35.56±6.04) g/L。术前并发其他部位结核9例,其中肺结核5例,结核性胸膜炎2例,结核性脑膜炎1例,骶髂关节结核1例,髂骨结核1例;术前并发糖尿病1例,并发肝损伤1例。初次手术方式为:一期前路手术9例,一期后路手术3例,一期后路内固定联合前路病灶清除植骨融合3例。15例患者培养阳性7例,均为结核分枝杆菌感染;2例对所有抗结核药物敏感,5例耐药,其中多耐药2例,且均为利福平耐药,耐多药3例,其中广泛耐药1例。
复治患者再次就诊原因为出现窦道6例,出现腰大肌局限性脓肿4例,出现腰骶部疼痛不适3例,切口下冷脓肿积聚2例;复治距初次手术时间为1~24个月,病灶累及范围为2个椎体7例、3个椎体及以上8例(表1)。
三、复治患者的手术治疗
1. 术前准备:15例复治患者中6例不合理化疗患者行异烟肼、利福平、吡嗪酰胺、乙胺丁醇、左氧氟沙星联合治疗2周后手术;5例经初次手术送检结核分枝杆菌培养报告耐药的患者术前均依据药敏试验结果采用个体化治疗方案:停用相应的耐药药物,酌情加用1~2种二线抗结核药物,如对氨基水杨酸异烟肼、左氧氟沙星、莫西沙星、阿米卡星、卷曲霉素、丙硫异烟胺,组成包含4~5种有效药物和吡嗪酰胺的化疗方案;4例并发低蛋白血症患者行营养支持治疗2~6周后手术;对并发窦道患者行局部窦道换药,取分泌物送检普通菌及结核分枝杆菌培养和药敏试验检测。
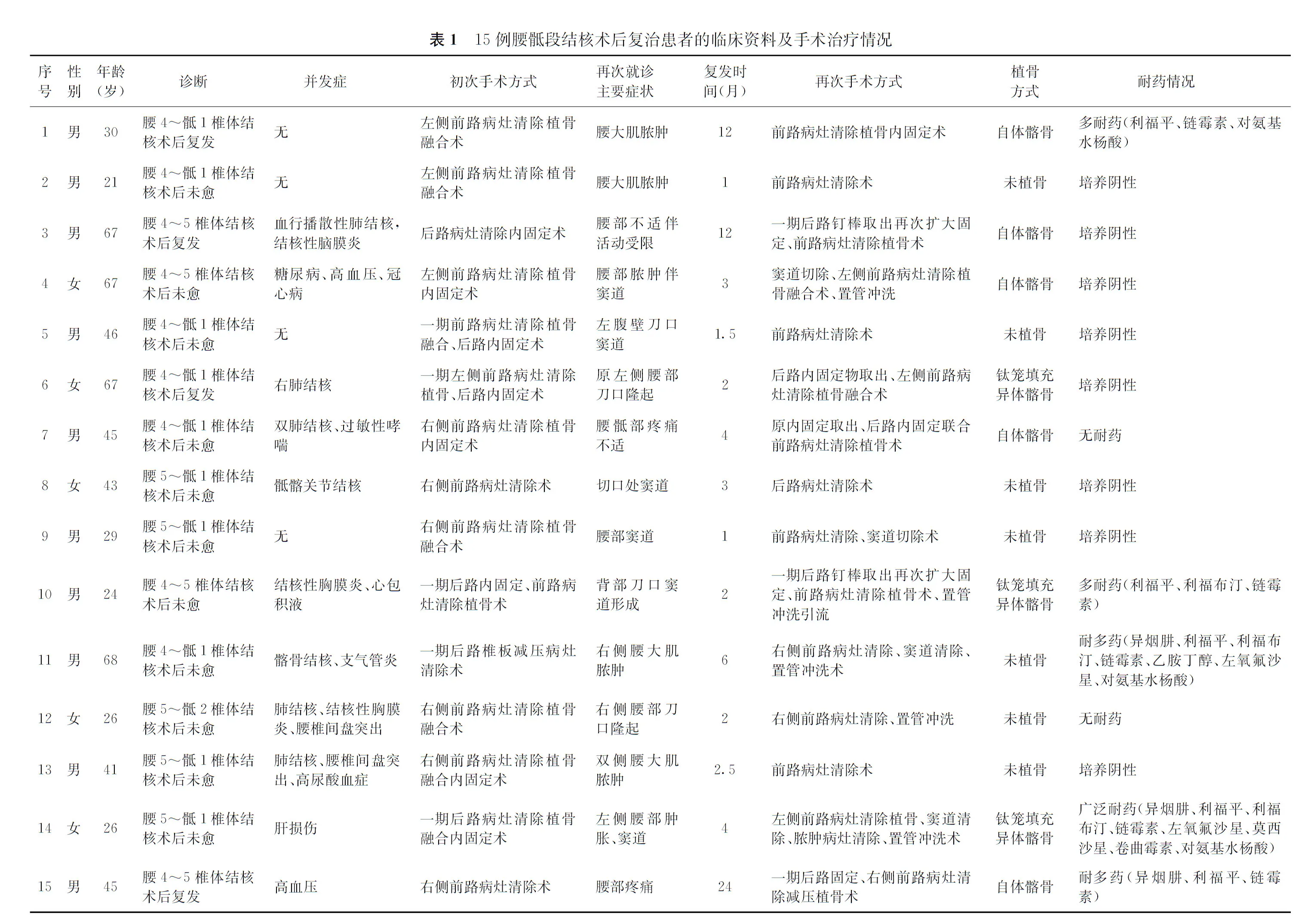
2. 手术治疗方案:(1)手术入路:13例患者取原手术切口入路(其中3例附加前方入路),2例另取椎体破坏严重侧的前方入路。(2)再次手术方式:单纯病灶清除、窦道切除术6例,病灶清除植骨融合术3例,病灶清除植骨融合内固定2例,病灶清除植骨融合原内固定物取出1例,病灶清除植骨融合原内固定物取出再次行内固定3例。
5例并发椎旁或腰大肌顽固性积液者采用脓腔内留置闭式冲洗引流管,持续应用硫酸阿米卡星灌洗引流治疗2周。植骨材料采用自体髂骨块5例、钛笼联合异体髂骨块3例。15例患者术中均取坏死组织和脓液行普通菌、结核分枝杆菌培养和药敏试验(表1)。
3. 术后处理:术后加强全身支持治疗,根据监测白蛋白及血红蛋白变化情况,给予肠外或肠内营养支持,补充蛋白质及维生素,必要时行输血治疗。未行内固定手术的患者术后卧床4周,4周后在支具保护下离床活动;行内固定手术的患者术后卧床2周后佩戴腰部支具逐步下地活动,3个月内宜多卧床,少活动。支具佩戴时间为至少6个月。如无耐药情况,常规给予强化抗结核药物治疗(异烟肼、利福平、乙胺丁醇、吡嗪酰胺),再加用1种氟喹诺酮类药物治疗至术后4周,如腰大肌及骶前无明显积液、体温正常、饮食良好,则可停用。术后2周复查彩色超声,若有积液则在彩色超声的引导下穿刺抽液,并局部注射异烟肼0.2 g和阿米卡星0.4 g;联合应用抗结核药物(2H-R-E-Z-Lfx/7H-R-E-Z/9~15H-R-Z)治疗18~24个月;如结核分枝杆菌培养及药敏试验结果提示为耐药结核病,则参考药敏试验结果及既往抗结核药物治疗史调整化疗方案。
四、随访及疗效评价
通过定期随访,动态观察低热、盗汗和纳差等全身结核中毒症状改善情况;实验室检查包括血红细胞沉降率、血红蛋白、白蛋白、肝肾功能等指标的动态变化;术后定期进行超声检查,判断有无残腔积液或脓肿复发,综合评估复治疗效。临床治愈标准参考文献[5]。
定期随访时行X线摄片观察植骨融合情况。骨愈合采用Bridwell标准[6]:I级为骨块融合重塑完全,骨小梁存在;Ⅱ级为骨块完整,骨块重塑不完全,无透亮区;Ⅲ级为骨块完整,上方或下方出现透亮区;Ⅳ级为骨块塌陷、吸收;术后6、9、12个月行CT或MR检查,判断病灶愈合情况。
五、腰骶段结核术后复发的危险因素分析
查阅病历,记录并统计各项观察指标。包括病变受累节段[1~2个椎体、多椎体(≥3个椎体或跳跃性分布)]、手术时机(术前抗结核药物治疗时间,术前白蛋白、血红蛋白和血红细胞沉降率水平)、手术治疗因素(包括病灶清除彻底程度、术中是否行植骨融合和是否应用内固定)、是否存在结核分枝杆菌耐药菌株、术后是否规范应用抗结核药物、其他部位是否并发结核。
六、统计学处理

结 果
一、腰骶段结核术后复发的原因分析
单因素分析结果表明,两组病变受累节段数量、术前血红细胞沉降率、血红蛋白水平、术前应用抗结核药物治疗时间、手术入路比率、术中应用内固定比率的比较,差异均无统计学意义(P值均>0.05);观察组术前白蛋白水平、植骨融合比率、术后规范抗结核药物治疗比率、手术彻底清除病灶的比率均低于对照组,结核分枝杆菌耐药和其他部位并发结核病的发生率高于对照组,差异均有统计学意义(P值均<0.05)。具体见表2。
将上述单因素分析中差异有统计学意义的变量引入logistic多因素回归分析,变量赋值见表3。结果表明,术前白蛋白水平<35 g/L、手术病灶清除不彻底、未行植骨融合、术后应用抗结核药物不规范、结核分枝杆菌耐药、并发其他部位结核均是脊柱结核术后复发的危险因素。见表4。
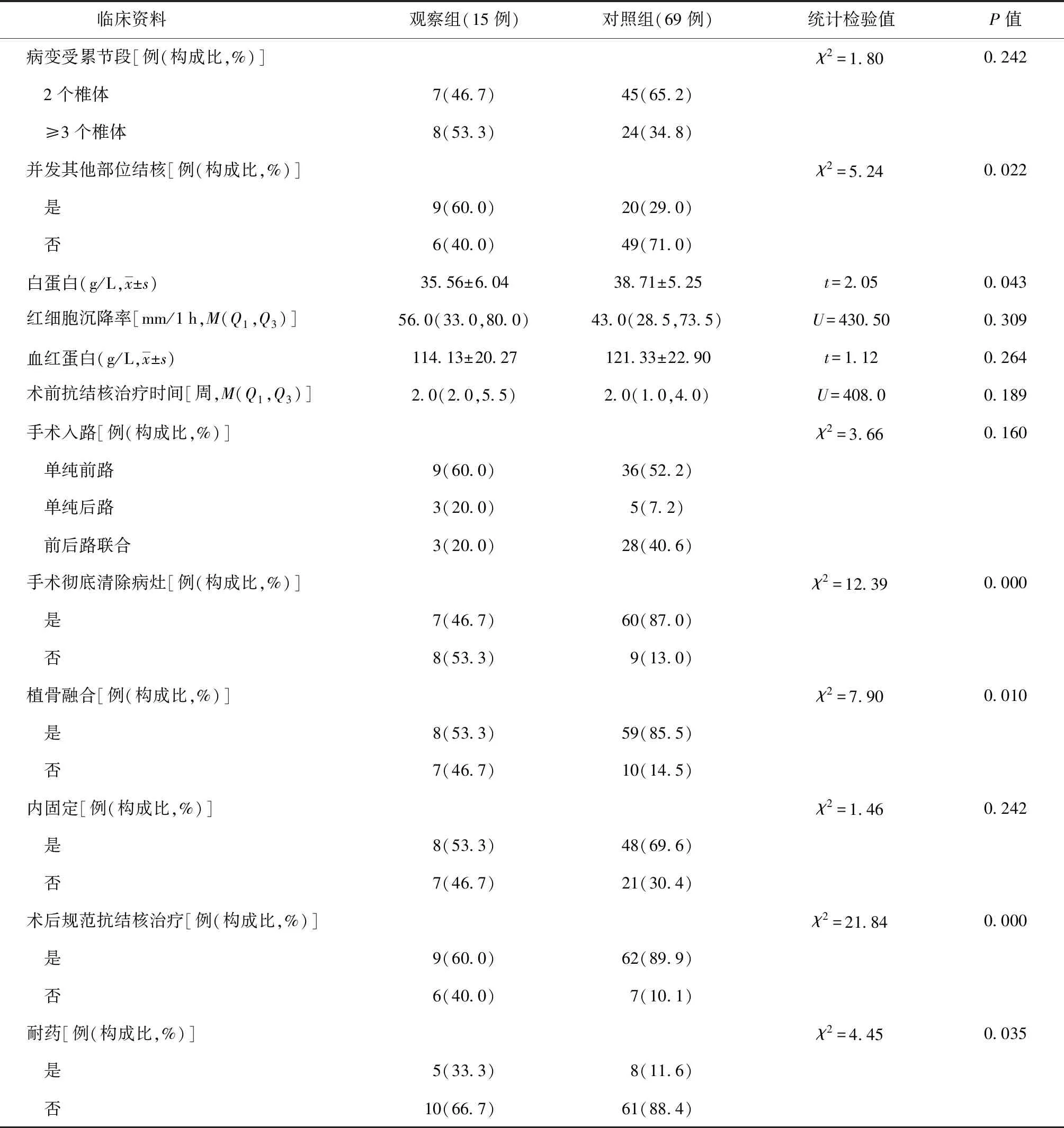
表2 两组患者临床资料的比较

表3 腰骶段结核术后复发的可能危险因素及量化赋值
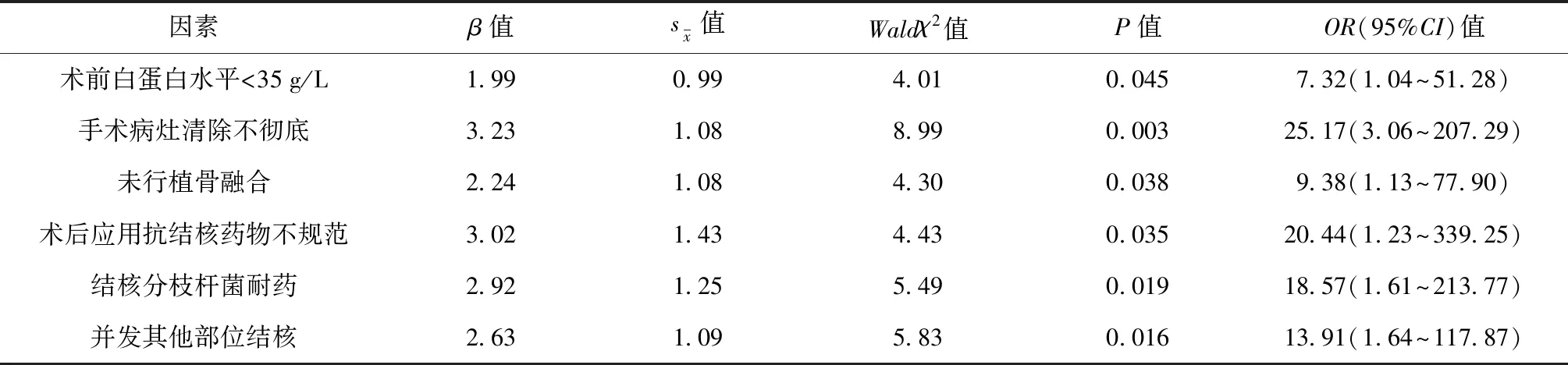
表4 影响腰骶段结核术后复发的多因素logistic回归分析
二、复治患者的手术治疗情况及临床愈合、影像学评价
围手术期间无死亡患者。手术时间40~240 min,M(Q1,Q2)为80.00(60.00,200.00) min;出血量100~1200 ml,M(Q1,Q2)为400.00(200.00,800.00) ml。未出现大血管、神经、输尿管损伤。
15例患者术后2周切口愈合拆线。在经过化疗及再次手术治疗4周后,低热、盗汗、乏力等结核中毒症状均有不同程度的改善。1例患者分别于术后5周及20周2次出现腹壁切口下包块、窦道,先后给予病灶清除及窦道搔刮术,经持续换药后愈合;2例患者术后3周再次出现腰大肌积液,经间断穿刺抽液注药后消失;其余患者结核病灶顺利治愈,无复发。
84例患者均得到定期随访,随访时间28~62个月,平均随访(36.5±11.2)个月。15例植骨患者均至少在术后9个月时行X线摄片,显示病椎与植骨复合体界面模糊消失,CT检查显示骨桥形成和融合稳定,判断为植骨愈合,达到Bridwell标准Ⅰ级12例,Ⅱ级3例。单节段植骨融合时间M(Q1,Q2)为3.8(3.1,6.9)个月,双节段植骨融合时间M(Q1,Q2)为8.0(4.0,9.0)个月。术后6个月行MR检查显示感染信号消退,术后12个月CT和MR检查显示病灶愈合。典型患者见例1(图1~12)和例2(图13~20)。
讨 论
一、腰骶段结核术后复发的危险因素分析
本研究结果表明,影响腰骶段结核疗效的因素有多种,在术前主要有:(1)应充分积极改善结核病患者的营养状态。治疗结核病的基础是营养支持,白蛋白是患者营养状态的重要指标,直接影响着手术后组织修复。在临床工作中,凡在围手术期间白蛋白<35 g/L的患者均应纠正低蛋白状态,需针对不同状态患者分别采用肠内、肠外营养支持甚至静脉滴注白蛋白,确保患者围手术期营养状态良好[7]。(2)需重视对并发其他部位结核的系统评估及积极纠正。本研究中观察组并发其他部位或器官结核感染的发生率高达60.0%(9/15),且涉及部位广泛,提示因机体免疫力低下,结核分枝杆菌可由淋巴或血液系统传播感染其他器官。目前在临床工作中存在的弊端是骨科医生片面重视手术治疗,忽视诊治其他系统、器官结核。应从整体角度来看待结核感染状态[8],需要进行全面系统问诊、体检及辅助检查来评估术前状态并除外并发其他部位器官的结核感染[9];应对多部位、多系统的结核病引入多学科协同诊治的新理念。
二、腰骶段结核的规范化药物治疗及耐药结核分枝杆菌感染的应对措施
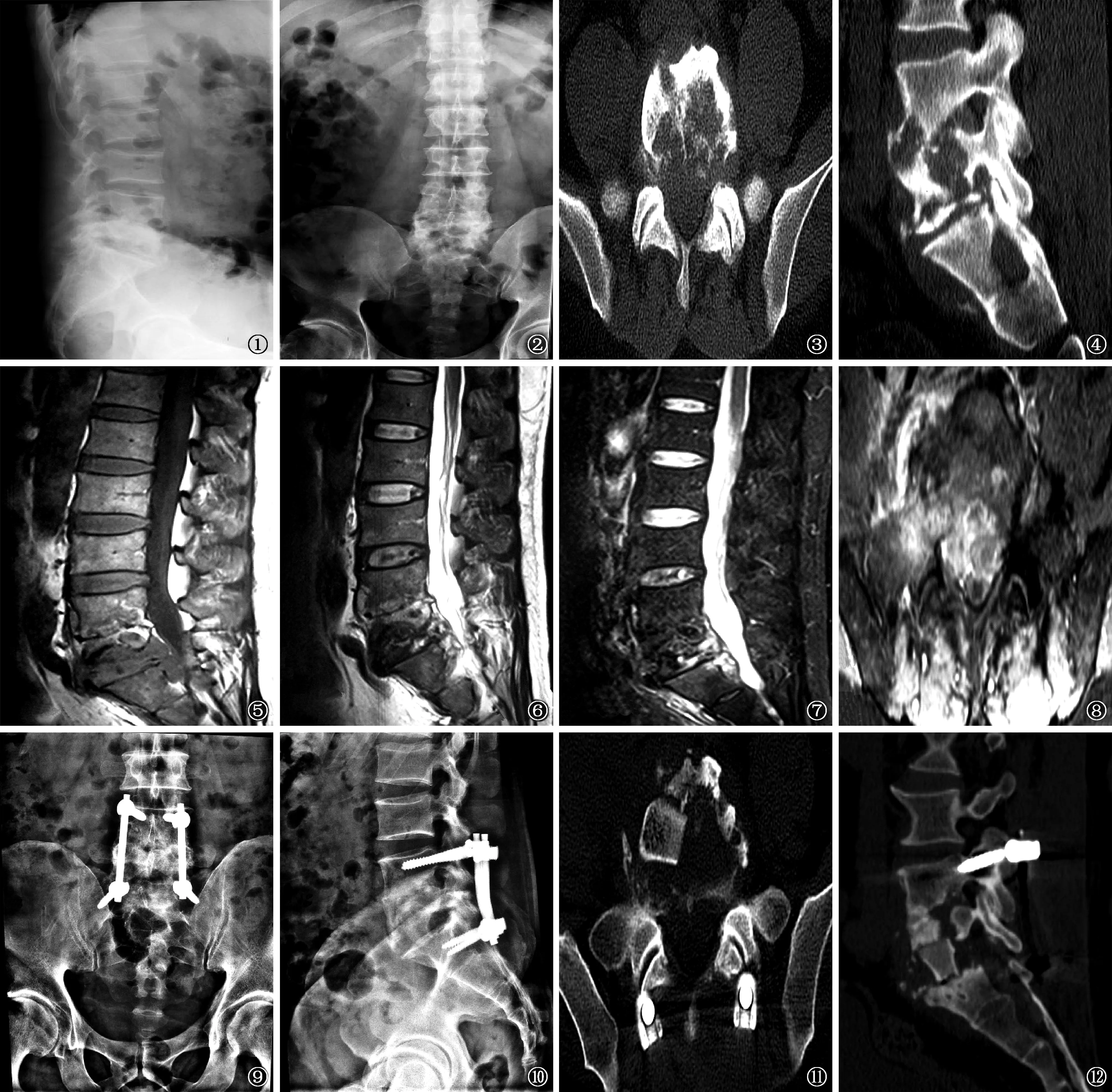
例1 患者,男,45岁。图1,2 为术前数字X线摄影,显示腰骶椎生理曲度变直,腰5骶1椎间隙狭窄 图3,4 为术前CT检查(初次前路病灶清除术后2年),显示腰5骶1椎体骨质破坏 图5~8 为术前腰骶椎MRI,显示腰5骶1椎体异常信号,压迫相应椎管硬膜囊图9,10 为术后数字X线摄影(行一期后路固定联合前路病灶清除减压植骨融合术),显示内固定位置良好,腰骶角较前有所恢复图11,12 为术后CT复查,显示腰5骶1椎体病灶已充分清除,植骨位置良好
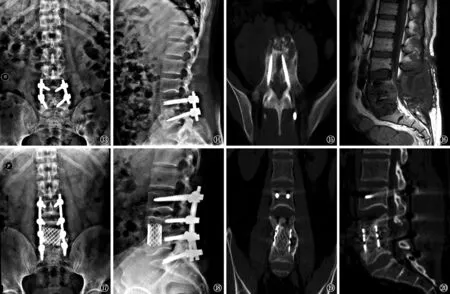
例2 患者,男,24岁。图13,14 为术前数字X线摄影(初次后路病灶清除内固定术后2个月),显示腰椎不稳,腰4椎体滑脱 图15,16 为术前CT及MR检查,CT显示椎弓根螺钉在骨病灶内,且椎体骨质破坏伴椎旁脓肿、死骨形成;MRI显示脓肿压迫相应椎管硬膜囊并沿钉道向后侵袭,在背部皮下形成脓肿 图17,18 为术后数字X线摄影,显示行一期原后路钉棒取出、再次扩大固定联合前路病灶清除减压植骨融合术成功 图19,20 为术后8个月CT复查,显示腰4、5椎间植骨(钛笼内填充异体髂骨块)融合良好
遵循“早期、规律、联合、适量、全程”原则的规范化药物治疗是抗结核治疗的基础[10],应贯彻于治疗始终。分析腰骶段结核术后复治患者的初次药物治疗方案,总结问题如下:(1)最主要原因是化疗方案错误,表现为效价不足、同类药物的重复使用、假联合用药等;(2)术前、术后化疗时间不足;(3)随意联合用药。这些不规范的行为将直接导致耐药性的产生和化疗的失败[11]。因此,除了作为骨科医生应加强对规范化疗的认知,还应在患者入院后及出院前反复向患者及家属宣传坚持抗结核药物治疗及定期门诊复查的重要性,从而杜绝不规范的初次药物治疗的发生。此外,本研究还表明耐药结核分枝杆菌感染与术后复发有关。以往曾报道过耐药结核分枝杆菌感染对脊柱结核疗效有明显影响[12-13]。本研究中观察组耐药结核分枝杆菌的发生率高达33.3%(5/15)。近年来,耐药结核分枝杆菌的出现及增多是防止结核病传播的重要议题[14]。我们应进一步规范应对耐药菌株感染的诊治意识:(1)注意术中提取病灶脓液或干酪组织行结核分枝杆菌培养及药敏试验,应用分子学诊断技术GeneXpert MTB/RIF等进行快速检测耐药情况并尽早指导用药[15];(2)术后追踪试验结果并对利福平耐药和耐多药结核病患者遵循2016年WHO耐药结核病治疗指南推荐的分组顺序甄选药物以便及时调整化疗方案[16];(3)推荐长疗程治疗方案来巩固远期疗效(疗程18~24个月),降低术后不愈及复发的发生率。
三、腰骶段结核规范化手术治疗的意义
腰骶段是脊柱结核的常见部位,手术是其治疗的重要手段。但局部病灶显露困难,稳定性差,在临床手术操作中对植骨及内固定的要求较高。腰骶段手术治疗的目的是在彻底清除病灶的基础上尽可能恢复椎间高度及腰骶角等正常生理结构,通过椎间牢固的植骨融合对抗局部剪切及轴向应力,重建并维持脊柱稳定性。规范化的手术治疗是影响病灶愈合的基本因素,包括彻底的病灶清除及适当的植骨方案。彻底的病灶清除应包括清除脓肿、死骨、肉芽、去除坏死的椎间盘、纤维环,清除椎体内包裹的病灶并凿除周围硬化骨质[17-18]。因此,术前认真研读影像学检查中X线片、CT、MRI等异常表现,判定病灶清除范围及部位,直视下施行手术以确保不遗漏病灶,均是彻底清除病灶的关键。另外,植骨融合是重建并维持脊柱稳定性的重要措施。通过长期的随访观察,对病灶清除后并发明显骨质缺损区,在植骨材料方面笔者推荐髂骨块或钛笼内填充髂骨块复合植骨;其优点在于既提高了植骨支撑稳定性,又促进了植骨早期愈合,还可有效防止椎间隙高度及腰骶角的丢失,从而降低了复发的风险。
四、复治腰骶段结核手术治疗方案的制定
通过分析本研究观察组的临床资料,总结初次手术治疗的欠缺主要体现在2个方面:(1)病灶清除不彻底(7例),具体表现在病灶内残留死骨;遗留椎旁、腰大肌或骶前脓肿;保留病灶旁硬化骨壁及骨桥。(2)术式选择不当(5例),其中3例术前CT或MR检查显示并发骶前大量脓肿,仅行后路病灶搔刮术,术后出现刀口下积脓破溃并发窦道形成;2例后路内固定螺钉放置在病椎内,术后病灶持续破坏产脓致脓液顺钉道方向侵袭蔓延,导致局部积脓、内固定松动。
再次手术时应根据窦道、脓肿及死骨的位置来选择手术入路。对于窦道、脓肿和死骨都位于初次手术入路侧,则再次手术入路时选择同侧;如上述病变情况不在一侧,则应附加对侧入路清除明显的脓肿及死骨。制定再次植骨及内固定方案应参考的因素有初次术后病灶愈合情况、脓肿位置和范围、植骨与内固定是否受侵松动及腰骶段局部稳定性。如初次术后出现腰大肌或骶前明显脓肿,建议取出前路内固定,并行后路椎弓根钉棒系统内固定;如初次手术为后路内固定,病变侵袭致内固定松动,则应取出后路原内固定物,重新固定并延长固定节段,若骶椎破坏严重,必要时可联合髂骨螺钉固定[19-20]。
复治腰骶段结核的手术治疗方案的制定需在分析总结初次手术不足的基础上进行。结合临床工作体会,制定手术方案的要点在于:(1)辨明椎体受累的部位、节段、程度,依据病灶清除的范围选择合适的手术入路,以利于彻底清除病灶;(2)条件许可的情况下尽可能行可靠的植骨与坚强内固定以恢复并维持正常腰骶角及椎间高度,从而避免出现顽固性下腰部疼痛;(3)仔细斟酌原内固定物的取舍,如判断内植物有松动、移位的情况,要准备好病灶清除后重建脊柱稳定性的内固定预案;(4)考虑难以吸收、顽固存在的脓肿,病灶或脓腔内可置管行持续闭式药物灌洗引流。
综上所述,腰骶段结核术后复发疗效的影响因素有多种,涵盖了临床诊疗过程的始终。本研究局限性在于目前纳入并随访的复治患者例数较少,可能会影响统计结论的准确性,未来尚需继续积累腰骶段结核患者数量以扩充样本量,并完善相关临床资料的整理分析。通过分析归纳每例复治患者既往诊治中的不足、系统全面地评估术前状态、依据既往治疗措施制定规范个体化的药物及手术治疗方案,才能有效提高腰骶段结核的复治疗效。

