不同性状痰标本的前处理液沉渣对MGIT 960液体培养法污染率的影响
孔成成 贾红兵 段惠娟 梁倩 马异峰 尚媛媛 孙照刚
作者单位:101149 首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所转化医学研究室(孔成成、贾红兵、段惠娟、孙照刚),国家结核病临床实验室(梁倩、马异峰、尚媛媛)
结核分枝杆菌(Mycobacteriumtuberculosis, MTB)培养并进行菌种鉴定是结核病病原学诊断的金标准。但由于MTB生长缓慢,培养时间长,痰标本前处理过程多且复杂,因而易受痰标本本身和外界细菌的污染,尤其是液体分枝杆菌培养管(Mycobacterium growth indicator tube, MGIT)培养法,污染率较改良罗氏培养基L-J法高[1]。笔者统计国内文献记载的MGIT 960液体培养法培养痰标本的平均污染率为4.13%(2.5%~6.57%)[2-11]。造成MGIT 960液体培养法污染率高的因素很多,如痰标本的储存时间长[12]、痰标本的消化去污不彻底[13]、患者感染菌株对前处理剂耐受[14],等等。关于痰处理液沉渣对MGIT 960液体培养法发生污染率的影响尚未报道。本研究通过分析不同性状的痰处理液沉渣质量差异及其对痰培养结果的影响,并对培养污染标本用测序方法进行菌种鉴定,分析污染菌种分布特点,以期能更好地降低污染率,提高临床诊断率。
材料和方法
一、标本采集
收集2018年1—2月于北京胸科医院门诊就诊疑似肺结核患者痰标本。共入组患者162例,每例患者收集痰标本1份,共162份,其中干酪痰和血痰标本各20份,黏液痰标本122份。
二、标本分类
根据研究要求,由于唾液以透明或半透明水样口腔分泌物为主,经痰处理液消化处理后无沉渣,所以不对其进行研究。参考《分枝杆菌分离培养标准化操作程序及质量保证手册》[14],痰标本评价标准按照痰标本性状将其分为以下3类:(1)干酪痰:标本外观以黄色(或奶酪色)、脓样、团块状的肺部分泌物为主;(2)黏液痰:标本外观以白色、黏稠度较高的肺部和支气管分泌物为主;(3)血痰:黏液痰或干酪痰标本中混有血液,颜色为褐色或深褐色、鲜红色或伴有血丝。
三、试剂仪器
BACTEC MGIT 960全自动分枝杆菌快速培养仪,其配套试剂包括分枝杆菌液体培养管(MGIT培养管)、生长添加剂、杂菌抑制剂(PANTA)(BD公司,美国),显微镜(Leica,德国),电子天平(Sartorius,德国),离心机(Sigma,美国),标本前处理液为3%N-乙酰-L半胱氨酸-NaOH消化液(3% NaOH-NALC)、pH 6.8的磷酸盐缓冲液(自配),抗酸染液(珠海贝索生物技术有限公司)。
四、研究方法
1.痰前处理液消化时间:根据《分枝杆菌分离培养标准化操作程序及质量保证手册》[14]及文献[15-18]推荐的痰消化处理最佳时间≤20 min的标准,结合国家结核病临床重点实验室MGIT 960液体培养法操作流程,本研究中采用痰前处理液消化处理15 min对收集的162份痰标本进行消化处理。
2.痰标本的MGIT 960液体培养:采用BACTEC MGIT 960全自动分枝杆菌快速培养仪液体培养痰标本中的MTB。(1)将收集到的162份痰标本每份吸取10 ml分装于2个50 ml的无菌离心管中,每管5 ml痰,两份痰标本均经痰前处理液消化处理15 min。(2)痰标本消化处理后,1份记录沉渣质量,1份取0.5 ml上清及0.5 ml沉渣分别接种于MGIT 960液体培养管中进行培养,其中接种上清液到管内即为上清接种组,接种沉渣到管内即为沉渣接种组,MGIT 960培养管置于仪器中培养,仪器培养时间最长为42 d报告结果。(3)已报告培养结果的MGIT 960液体培养管,均经涂片抗酸染色再次进行确认。若涂片结果显示分枝杆菌,则最终结果判定为“真阳性”;若涂片鉴定未发现分枝杆菌及其他微生物,则为“真阴性”;若涂片结果显示仅为分枝杆菌之外的其他微生物,则判定为“污染”。
3.污染标本的菌种鉴定方法:(1)吸取污染标本7 ml于50 ml无菌离心管中,3000×g离心15 min,去上清。(2)加20 μg/ml溶菌酶200 μl,37 ℃孵育过夜。(3)80 ℃金属浴2 h,离心半径8 cm,12 000 r/min 离心10 min,留取上清。(4)设计引物对16S rDNA进行扩增、产物测序。上游引物序列5′-AGAGTTTGATCATGGCTCAG-3′,下游引物序列5′-TAGGGTTACCTTGTTACGACTT-3′,扩增产物大小为1487 bp,以上扩增产物均送睿博兴科公司测序,测序结果使用BLAST进行序列比对分析。
五、统计学处理

结 果
一、不同性状的痰标本前处理液沉渣质量之间的对比结果
采用方差分析法对全部162份痰标本进行统计,分析5 ml不同性状的痰标本经前处理液消化处理15 min后所得沉渣质量差异,结果显示,干酪痰标本所得沉渣质量[(0.17±0.14) g]高于黏液痰标本[(0.09±0.07) g]和血痰标本[(0.10±0.07) g],差异均具有统计学意义(F值分别为14.56、4.29,P值分别为0.00、0.01),血痰标本所得沉渣质量略高于黏液痰,但差异无统计学意义(F=0.09,P=0.80)(表1)。
二、上清接种组与沉渣接种组的检测结果
162份痰标本鉴定结果中,上清接种组与沉渣接种组中共同符合“真阳性”标准的痰标本有76份,共同符合“真阴性”标准的痰标本有53份。痰标本沉渣接种组经MGIT 960检测报阳标本共108份,报阴标本共54份,报阳标本经涂片抗酸染色检测,涂片阳性结果82份,涂片阴性结果26份,即沉渣接种组符合“污染”标准的痰标本有26份。上清接种组经MGIT 960检测报阳标本共82份,报阴标本共80份,报阳标本经涂片抗酸染色检测,涂片结果均为阳性,无涂片阴性结果,即上清接种组无符合“污染”标准的痰标本。6例患者痰标本在上清接种组诊断结果为真阴性而在沉渣接种组诊断结果为真阳性,1例患者痰标本在上清接种组诊断结果为真阳性,而在沉渣接种组诊断结果为真阴性。痰处理液上清接种组与沉渣接种组培养结果K值为0.65(<0.75),说明两组培养结果的一致性一般。沉渣接种组污染率(16.05%,26/162)高于上清接种组(0.00%,0/162),采取Fisher精确检验,结果显示P=0.00,差异具有统计学意义(表2)。

表1 3种性状的痰处理液沉渣质量比较
注a:采用方差分析比较干酪痰与黏液痰所得的F值和P值;b:采用方差分析比较干酪痰与血痰所得的F值和P值;c:采用方差分析比较黏液痰与血痰前处理液沉渣差异所得的F值和P值

表2 痰处理液上清接种组和沉渣接种组的检测结果
注A+:为MGIT 960液体培养方法阳性结果;A-:为MGIT 960液体培养方法阴性结果;B+:为抗酸染色鉴定结果为分枝杆菌,即涂片阳性;B-:为抗酸染色鉴定无分枝杆菌,即涂片阴性;(+):表示“真阳性”结果;(-):表示“真阴性”结果

表3 沉渣接种组不同性状的痰标本污染检测结果
注a:采用χ2检验比较干酪痰与黏液痰所得的χ2值和P值;b:采用χ2检验比较干酪痰与血痰所得的χ2值和P值;c:采用χ2检验比较黏液痰与血痰污染率差异所得的χ2值和P值
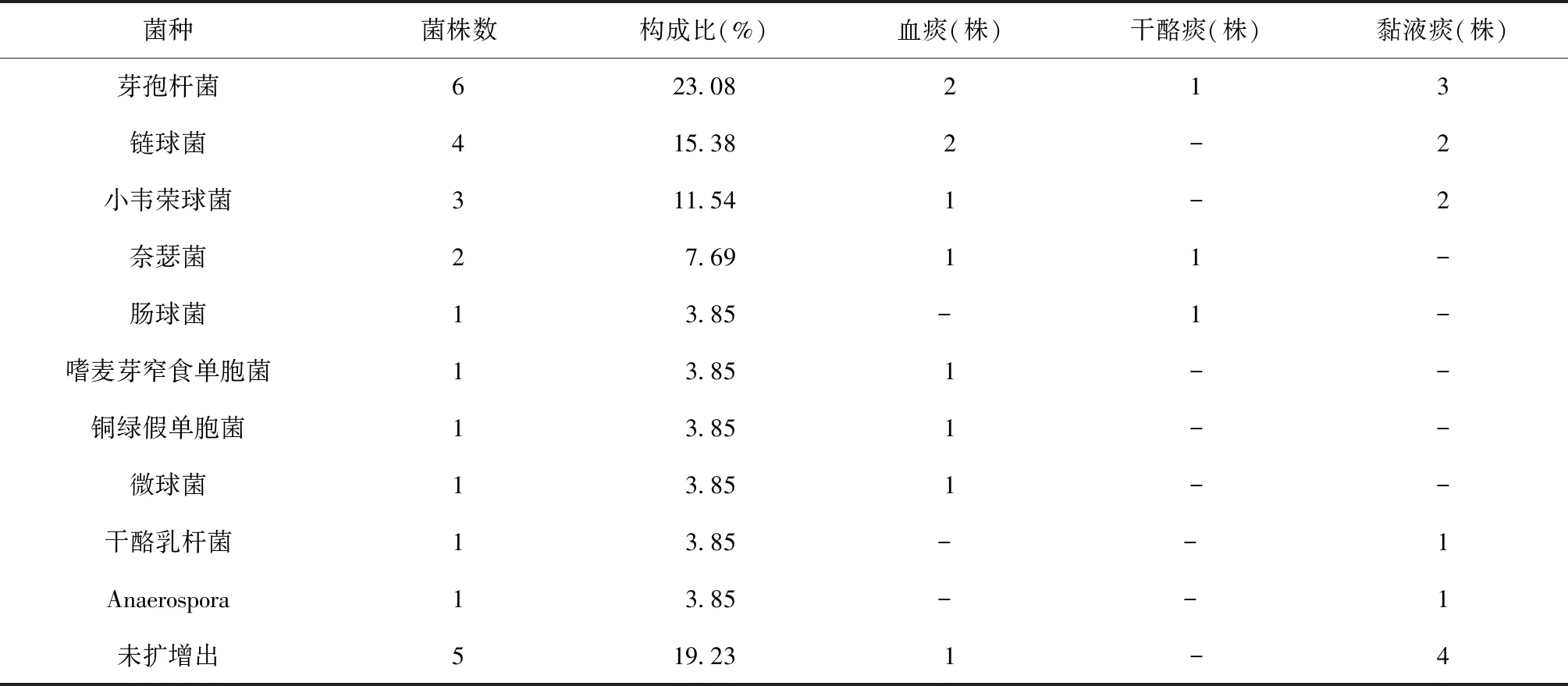
表4 26例污染标本菌种鉴定结果及在不同性质的痰标本中的分布情况
注“-”为未检测出相应菌株
沉渣接种组中,血痰标本、干酪痰标本和黏液痰标本的污染率存在差异,且差异具有统计学意义(χ2=15.61,P=0.00),其中血痰标本污染率最高,为50.00%(10/20),其次为干酪痰标本(15.00%,3/20),黏液痰标本最低(10.66%,13/122)。血痰标本污染率分别与黏液痰标本和干酪痰标本相比,差异有统计学意义(χ2值分别为19.60、4.10,P值分别为0.00、0.04)。而干酪痰标本和黏液痰标本污染率差异无统计学意义(χ2=0.04,P=0.70)(表3)。
三、26例污染标本的菌种鉴定结果
26例患者的污染标本中有21例有测序结果,其余5例患者的标本未扩增出基因组DNA。 有明确测序结果的污染标本中,芽孢杆菌和链球菌较为突出,分别占23.08%(6/26)和15.38%(4/26)。其次,小韦荣球菌和奈瑟菌分别占11.54%(3/26)和7.69%(2/26)。其中黏液痰污染菌种主要集中在芽孢杆菌、链球菌和小韦荣球菌,而血痰和干酪痰污染菌种分布不集中(表4)。
讨 论
MTB培养阳性并进行菌种鉴定是实验室诊断结核病的金标准,MGIT 960液体培养法对MTB培养具有操作简单、报告阳性时间比固体L-J培养法短等优点,广泛用于临床检测,但培养过程中污染率高也对诊疗带来极为不利的后果,是最突出的缺点。包括痰处理液组成[19]、培养管抑菌剂[20]等造成污染的原因已有报道,本研究进一步探讨痰标本前处理液处理后的沉渣对MGIT 960液体培养污染率的影响。
一、痰标本前处理液沉渣对MGIT 960液体培养法诊断结果的影响分析
162份痰标本处理液中,沉渣接种组标本污染率为16.05%(26/162),高于上清接种组(0.00%,0/162),且差异具有统计学意义,沉渣接种组污染率高,说明沉渣接种是造成MGIT 960培养阳性结果过高的主要原因之一。分析沉渣接种造成污染的原因主要有以下3点:(1)痰处理液沉渣中含有的杂菌数量较多[13];(2)痰处理液对沉渣中的杂菌影响较小[13];(3)培养过程中,沉渣中的杂菌对抗生素不敏感[13]。因此建议接种前预先静置前处理液,接种时尽量避免接种前处理液的沉渣。
沉渣接种组26例患者的污染标本中,不同性状的痰标本培养污染率不同,虽然血痰的痰处理液沉渣少于干酪痰,但血痰的MGIT 960液体培养污染率最高,干酪痰次之,黏液痰污染率最低。分析原因可能为血痰污染标本患者并发肺部感染者较高50.00%(10/20),这与白大鹏[21]报道相一致。干酪痰患者肺部感染率最低,3份污染标本患者中有1例并发肺部感染,培养结果受感染菌株影响小。黏液痰患者虽然肺部感染较多(38.46%,5/13),但黏液痰消化去污相对容易,沉渣少,致使培养污染率最低。根据《分枝杆菌分离培养标准化操作程序及质量保证手册》[14]要求MGIT 960液体培养污染率应不超过5%,本研究沉渣接种组的污染率达到16.05%(26/162),其原因除前述分析中提到的3点主要原因外,与收集到的标本类型也具有一定相关性,本研究标本中血痰标本(12.35%,20/162)和干酪痰标本(12.35%,20/162)所占比率较高。
二、沉渣接种组26份污染标本的菌种鉴定结果分析
在鉴定造成MGIT 960液体培养污染的菌种时有5份污染标本未扩增出DNA,分析其原因可能为标本由多种细菌混合污染,导致DNA测序失败。剩余21份MGIT 960液体培养污染标本经菌种鉴定,发现造成MGIT 960液体培养污染的菌种以芽孢杆菌、链球菌、小韦荣球菌和奈瑟菌为主,还包括肠球菌、铜绿假单胞菌、干酪乳杆菌和Anaerospora,提示培养污染率高与患者肺部感染[22]和口腔细菌有关。本研究中革兰阳性菌属占污染菌种的61.9%(13/21),是造成污染的主要组成部分,与吴龙章等[14]报道相符,但造成污染的主要菌种不相符,分析原因为检测方法不同,造成与报道之间存在一定差别。
三、本研究的不足
(1)本研究标本量相对较少,且标本全部来源于门诊患者,所得结果可能存在偏差。有待进一步增加标本量以及丰富标本来源进行深入探讨,以更好地找出MGIT 960液体培养污染的来源,从而降低污染率,为临床痰培养工作提供一定的参考。(2)本研究痰处理液沉渣通过无菌吸管吸出全部上清后获得,所获结果会存在偏差,有待进一步完善和改进试验方法。
综上所述,痰标本前处理液沉渣是MGIT 960液体培养污染率高的主要原因之一,因此应尽量避免沉渣的接种。同时应注意肺部感染的患者,痰标本培养污染率也会增加,因此对伴有呼吸道感染的患者应加强肺部抗炎治疗,待感染控制后再送标本进行分枝杆菌培养。另外,建议以生理盐水加3%双氧水漱口后取痰标本,以此减少口腔细菌污染[23]。
志谢首都医科大学附属北京胸科医院流行病学研究室康万里研究员对论文数据处理提供了多方面的帮助与指导。

