SGB对蛛网膜下腔出血患者脑血流动力学、术后脑血管痉挛发生率的影响
肖伟仁 戴学军
(福建医科大学附属漳州市医院,福建漳州363000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)多由动脉瘤破裂出血引起,多发于脑底动脉环大动脉分支处,可引发多种脑膜刺激征反应(恶心、剧烈疼痛、呕吐、Kenig氏征、颈强直等),严重者可导致偏瘫、昏迷等,危及生命安全[1-2]。血管介入栓塞术为治疗SAH常用手段,可有效闭塞动脉瘤,使再出血风险显著降低,但术后脑血管痉挛发生率较高,可引起局部脑水肿、脑缺血等,影响疗效[3]。临床研究证实,星状神经节阻滞(SGB)具有改善脑血流、脑保护等作用[4]。本研究选取我院SAH介入治疗患者82例,探究SGB对脑血流动力学、术后脑血管痉挛发生率的影响,现报道如下。
1 资料与方法
1.1 一般资料
经我院伦理委员会同意批准,选取2017年10月至2019年3月SAH患者82例,根据麻醉方案不同分组,各41例。对照组女15例,男26例,年龄24-73岁,平均年龄(47.53±10.25)岁,美国麻醉医师协会(ASA)分级:Ⅰ级27例,Ⅱ级14例,体质量指数(BMI)18.2-32.3kg/cm2,平均(24.10±2.19)kg/cm2,Hunt-Hess分级:Ⅰ级6例,Ⅱ级21例,Ⅲ级14例;观察组女16例,男25例,年龄23-74岁,平均年龄(48.12±10.58)岁,ASA分级:Ⅰ级26例,Ⅱ级15例,体质量指数(BMI)18.1-32.4kg/cm2,平均(24.16±2.23)kg/cm2,Hunt-Hess分级:Ⅰ级 6例,Ⅱ级 20例,Ⅲ级15例。两组基线资料(年龄、性别、BMI、ASA分级、Hunt-Hess分级等)均衡可比(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准 (1)均经全脑血管造影、CT血管造影(CTA)确诊为aSAH;(2)均择期行介入术治疗;(3)患者及家属知情并签署承诺书;(4)Hunt-Hess分级:Ⅰ~Ⅲ级;(5)ASA 分级:Ⅰ级~Ⅱ级。
1.2.2 排除标准 (1)恶性肿瘤;(2)精神障碍史;(3)心肺、肝肾功能障碍。
1.3 方 法
两组均行血管介入栓塞术,局麻后气管内插管全麻,股动脉穿刺插管,行全脑血管造影对动脉瘤位置进行定位,将引导管(6F/8F)置入椎动脉或颈动脉,通过调整导管使导管尖进入瘤腔,选择合适型号的弹簧圈进行栓塞,术后6h将导管鞘拔除,对穿刺点进行加压包扎。观察组麻醉后行SGB,患者取仰卧位,头偏向健侧,一手以食、中指分开气管和颈总动脉,稍用力可触及第七颈椎横突引导进针,另一手持套管针和注射器,负压斜行进针,触及骨质后稍退少许,将针芯拔除,回抽若无出血症状,注入0.25%罗哌卡因6~8mL,连接镇痛泵,维持2mL/h,持续3d。5-10min后观察阻滞侧有无霍纳综合症表现(瞳孔缩小、结膜充血等),作为SGB成功标志。
术前、术后3d以经颅超声多普勒(TCD)对两组椎动脉(VA)、大脑后动脉(PCA)、大脑中动脉(MCA)、大脑前动脉(ACA)、平均血流速度(Vm)、搏动指数(PI)进行检测。术前、术后3d空腹抽取静脉血3mL,离心,取血清,β内啡肽(β-EP)以酶联免疫吸附法检测,胰岛素(Ins)以放射免疫发检测,生长激素(GH)以电化学发光免疫测定。
1.4 观察指标
(1)对比两组脑血流动力学变化。(2)对比两组脑血管痉挛发生率。术后 24h、48h以TCD测量MCA,若 MCA>120cm/s,且存在频谱异常,可判断发生脑血管痉挛。(3)对比两组应激反应变化。
1.5 统计学分析
运用SPSS21.0分析,计量资料以χ±s表示,t检验,计数资料以 n(%)表示,χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 脑血流动力学变化
术前两组 VA、PCA、MCA、ACA的平均血流速度及搏动指数无显著差异(P>0.05);术后3d观察组VA、PCA、MCA、ACA的平均血流速度及搏动指数较对照组低(P<0.05)。见表 1、2。
2.2 脑血管痉挛发生率
观察组术后发生脑血管痉挛发生3例,发生率7.32%(3/41);对照组术后发生脑血管痉挛发生12例,发生率29.27%(12/41)。观察组脑血管痉挛发生率较对照组低(χ2=6.609,P=0.010)。
表1 两组VA、PCA、MCA、ACA平均血流速度对比(±s)
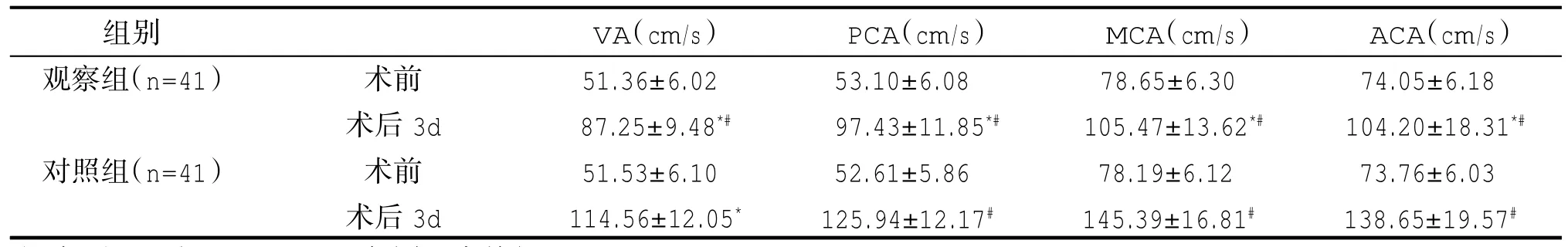
表1 两组VA、PCA、MCA、ACA平均血流速度对比(±s)
注:与对照组相比,*P<0.05;与同组术前相比,#P<0.05。
组别观察组(n=41)对照组(n=41)术前术后3d术前术后3d VA(cm/s)51.36±6.02 87.25±9.48*#51.53±6.10 114.56±12.05*PCA(cm/s)53.10±6.08 97.43±11.85*#52.61±5.86 125.94±12.17#MCA(cm/s)78.65±6.30 105.47±13.62*#78.19±6.12 145.39±16.81#ACA(cm/s)74.05±6.18 104.20±18.31*#73.76±6.03 138.65±19.57#images/BZ_15_592_2125_594_2127.png
表2 两组 VA、PCA、MCA、ACA搏动指数对比(±s)

表2 两组 VA、PCA、MCA、ACA搏动指数对比(±s)
注:与对照组相比,*P<0.05;与同组术前相比,#P<0.05。
组别观察组(n=41)对照组(n=41)术前术后3d术前术后3d VA 0.96±0.10 1.03±0.12*#0.95±0.09 1.20±0.13#PCA 0.91±0.10 0.97±0.12*#0.90±0.11 1.14±0.14#MCA 1.03±0.18 1.07±0.20#1.04±0.20 1.28±0.22#ACA 0.97±0.10 1.03±0.09*#0.99±0.11 1.22±0.14#
表3 两组应激反应变化对比(±s)

表3 两组应激反应变化对比(±s)
注:与对照组相比,*P<0.05;与同组术前相比,#P<0.05。
组别观察组(n=41)对照组(n=41)术前术后3d术前术后3d β-EP(pg/mL)43.25±8.16 64.35±10.37*#42.87±8.03 75.28±13.24#Ins(μU/mL)23.17±3.05 26.85±4.19*#23.02±2.94 33.06±7.27#GH(ng/mL)2.68±0.36 3.75±0.61*#2.73±0.39 4.82±0.69#
2.3 应激反应变化
术前两组血清β-EP、Ins、GH水平无显著差异(P>0.05);术后 3d 观察组血清 β-EP、Ins、GH 水平较对照组低(P<0.05)。见表 3。
3 讨论
现阶段,介入治疗应用于SAH患者,虽可起到理想的动脉瘤封堵效果,有效减少动脉瘤破裂、脑出血等发生,但术后脑血管痉挛发生率居高不下,严重威胁患者生命安全[5]。故探寻有效措施,预防SAH介入治疗术后脑血管痉挛具有重要意义。
星状神经节位于颈下段,由C6、C7、T1神经节构成,对头、颈、上臂、上胸等部位进行支配,对全身神经具有调节作用[6]。神经兴奋可引起星状神经节持续活化,增加交感神经张力,引起脑血管收缩,导致脑血流动力学紊乱,诱发脑血管痉挛。SGB可对交感神经干活性起到抑制作用,扩张脑血管,抑制脑血管痉挛发生,并可增加脑血管流量,保护神经,同时,可上调一氧化氮(NO)合成酶活性,提高NO含量,扩张脑血管,减少脑血管痉挛发生。此外,有研究指出,蛋白激酶C通路、丝裂原活化蛋白激酶(MAPK)通路与脑血管痉挛发生具有密切关系[7]。SGB可抗血管内皮细胞氧化,抑制自由基生成,阻断蛋白激酶C通路、MAPK通路,进而抑制脑血管痉挛发生。本研究结果显示,术后3d观察组VA、PCA、MCA、ACA、Vm、PI较对照组低,观察组脑血管痉挛发生率较对照组低(P<0.05)。表明SGB应用于SAH介入治疗患者,可稳定脑血流动力学,降低术后脑血管痉挛发生率。本研究结果还显示,术后3d观察组血清β-EP、Ins、GH 水平较对照组低(P<0.05)。表明SGB应用于SAH介入治疗患者,可缓解应激反应,减少应激反应对患者的损伤。
本研究中,术后3d两组血清应激反应相关指标(β-EP、Ins、GH)水平均升高,但观察组升高程度明显低于对照组(P<0.05),与王士强等[8]研究一致。提示SGB应用于SAH介入治疗患者,可能通过调控β-EP、Ins、GH 等因子水平,缓解应激反应,进而抑制脑血管痉挛的发生。
综上可知,SGB应用于SAH介入治疗患者,可稳定脑血流动力学,缓解应激反应,降低术后脑血管痉挛发生率,较常规全身麻醉下介入手术更安全有效,值得推广和应用,但其减轻脑血管痉挛发生的机制可能是多方面的有待进一步研究。

