不同光质对苦荞芽生长及品质的影响
谭茂玲, 曹亚楠,万 燕,时小东,王明珠, 向达兵
(1.成都大学 农业农村部杂粮加工重点实验室,四川 成都 610106;2.成都大学 药学与生物工程学院,四川 成都 610106)
0 引 言
苦荞,属蓼科荞麦属,是一种药食同源的双子叶植物,含大量的蛋白质、维生素、甾类和黄酮类等物质,营养和药用价值都很高[1-4].光是植物生长发育所需的重要元素之一,其对植物的生殖生长、形态性状以及理化性质等方面发挥着不容忽视的作用[5-8].目前,科研人员在光对植物生长方面做了较多的研究[9-12],但针对苦荞的研究还比较欠缺.对此,本研究分析了在不同的光质条件下,苦荞芽的生长和品质所产生的不同变化,旨在寻找最适宜苦荞芽生长的光质条件,为下一步苦荞芽的大规模生产提供试验依据和技术支撑.
1 材料与方法
1.1 材 料
试验所用材料包括:西荞I号种子,于2017年11月采收于成都大学试验田;芦丁对照品(批号,150622,纯度≥98%)、槲皮素对照品(批号,150419,纯度≥98%),由中国食品药品检定研究院提供;甲醇为色谱纯,水为纯化水,其余试剂均为分析纯.
1.2 仪 器
试验所用仪器包括:FD-2型真空冷冻干燥机(北京博医康试验仪器有限公司);UV-3200S型紫外可见分光光度计(上海美谱达仪器有限公司);AP-01P型真空泵(天津奥特赛恩斯仪器有限公司);LC-20A型高效液相色谱仪(岛津公司);KQ-5200DE型数控超声波清洗器(昆山超声波仪器有限公司);TL-2020型高通量组织研磨仪(北京鼎昊源科技有限公司);ESJ120-4B型电子天平(沈阳龙腾电子有限公司).
1.3 苦荞发芽条件
分别称取30 g左右大小均匀的西荞I号苦荞种子12份,在0.1%的高锰酸钾溶液中浸泡15 min后,用蒸馏水洗净,再均匀铺洒于12个已经铺有2/3细沙的发芽盘(20 cm×15 cm)中,最后再盖上一层细沙.暗光催芽3 d后放置于光照培养架上,分别采用1.5 RED/FAR、0.5 RED/FAR、红光(RED)、蓝光(BLUE)以及LED 5种不同光质的光分别进行处理.光处理条件为:光照强度,5 600 lx;光照时长,昼/夜,10 h/14 h;温度,25 ℃.同时,并设置CK组,采用暗光(DARK)生长.发芽后第4 d开始取样,每次取样面积4 cm×15 cm,每2 d取一次样,第14 d收获,冷冻干燥后用于理化性质的测定.
1.4 供试品溶液制备
称取0.1 g样品于10 mL比色管中,用80%甲醇定容至10 mL,然后超声30 min.超声条件为:温度20 ℃,频率40 kHz,功率80 W.最后用0.45 μm的微孔过滤膜过滤,制得供试品溶液.
1.5 苦荞芽生物学性状测定
1.5.1 鲜 重.
从每种光质条件下取出100株植株,去除根和壳,用滤纸吸干水分,用电子天平测量其重量,记录数据.
1.5.2 茎长和茎粗.
从取样的植株中挑选10株具有代表性的植株,去除根和壳,用直尺测量其茎长,用游标卡尺测量其茎粗,记录数据.
1.6 苦荞芽抗氧化活性测定
苦荞芽抗氧化活性的测定采用文献[13]中的相关方法,并做相关改进.
1.6.1 DPPH自由基清除率的测定.
精密称取0.011 8 g DPPH粉末,用甲醇配制成0.3 mmol/L的DPPH储备液,于4 ℃避光保存备用.于10 mL比色管中加入1 mL不同浓度的样品或参比溶液(无水甲醇),再加入4 mL的DPPH甲醇溶液,振荡摇匀后于室温下避光静置30 min,在波长517 nm处测定吸光度值,记为AS和A0.DPPH自由基清除率/%=(1-AS/A0)×100%.
1.6.2 ABTS自由基清除率的测定.
精密称取0.274 3 g ABTS粉末,用pH值为7.4的PBS溶液配制成5 mmol/L的ABTS储备液,再与MnO2反应,于室温下,放置过夜.最后再用PBS溶液稀释,使其在波长734 nm处吸光度值为0.70±0.02,于-20 ℃保存备用.于10 mL比色管中加入200 μL不同浓度的样品或参比溶液(无水甲醇),再加入3 mL ABTS溶液,振荡摇匀后于室温下避光静置1 min,在波长734 nm处测定吸光度值,记为AS和A0.ABTS自由基清除率/%=(1-AS/A0)×100%.
1.7 苦荞芽总黄酮测定
苦荞芽总黄酮的测定采用文献[14]中的方法,并做相关改进.
精密称取5.0 mg芦丁对照品于10 mL量瓶中,定容至刻度,摇匀,制得浓度为0.5 mg/mL的芦丁对照品溶液.精密量取对照品溶液0.6、0.7、0.8、0.9、1.0 mL于10 mL量瓶中,分别加入2 mL 0.1 mol/L AlCl3溶液,3 mL 1 mol/L醋酸钾溶液,再用80%甲醇定容,得到对照品溶液的浓度分别为0.030 mg/mL、0.035 mg/mL、0.040 mg/mL、0.045 mg/mL、0.050 mg/mL,于室温放置30 min,在波长420 nm处测定吸光度值.以对照品溶液浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,得到回归方程为,Y=61.54X-0.547,R2=0.997.
精密移取500 μL样品溶液,2 mL 0.1 mol/L AlCl3溶液,3 mL 1 mol/L醋酸钾溶液于10 mL比色管中,用80%甲醇定容,在波长420 nm处测定吸光度,代入回归方程,计算总黄酮的含量.
1.8 苦荞芽芦丁和槲皮素测定
苦荞芽芦丁和槲皮素的测定采用文献[15]中的方法,并做相关改进.
测定的色谱条件为:波长360 nm;柱温30 ℃;流速1.0 mL/min;进样量20 μL;流动相,甲醇—0.1%冰乙酸(50∶50).
分别精密称取芦丁对照品5 mg和槲皮素对照品1.5 mg于10 mL量瓶中,用80%甲醇定容至刻度,制得芦丁、槲皮素混合对照品储备溶液.取对照品储备液5 mL用80%甲醇稀释到10 mL,再依次等倍稀释5次,芦丁对照品溶液的浓度分别为0.250 mg/mL、0.125 mg/mL、0.062 mg/mL、0.031 mg/mL、0.016 mg/mL,槲皮素对照品溶液的浓度分别为0.075 mg/mL、0.037 mg/mL、0.019 mg/mL、0.009 mg/mL、0.005 mg/mL.用0.45 μm微孔过滤膜过滤后,得到标准工作曲线溶液,进样.以对照品浓度为纵坐标,峰面积为横坐标,绘制标准曲线,得到芦丁的回归方程为,Y=9×106X+62 646,R2=0.999,槲皮素的回归方程为,Y=2×107X-95 084,R2=0.998.
根据供试品的峰面积,代入回归方程,计算出各供试品芦丁和槲皮素的含量.
2 结果与分析
2.1 苦荞发芽过程中生物学性状的变化
2.1.1 苦荞发芽过程中鲜重的变化.
苦荞种子发芽过程中鲜重的变化如图1所示.

图1苦荞芽鲜重的变化趋势
由图1可知,苦荞种子在发芽过程中,以1.5 RED/FAR、BLUE和对照处理的鲜重都呈升高的变化趋势,以RED、0.5 RED/FAR和LED处理的鲜重在第12 d以后趋于平缓.第6 d和第10 d RED处理的鲜重最高,比同时间下对照处理的分别增加了0.09 g和0.41 g.第14 d 1.5 RED/FAR处理的鲜重最高,比对照处理的增加了0.16 g,但与对照处理的差异不明显.其余时间均以对照处理的鲜重最大.对照处理的鲜重在第8 d比LED和0.5RED/FAR处理增加了2.44 g,在第12 d比BLUE处理高出了2.12 g.
2.1.2 苦荞发芽过程中茎长的变化.
苦荞种子发芽过程中茎长的变化如图2所示.

图2苦荞芽茎长的变化趋势
由图2可知,苦荞种子在发芽过程中,以0.5 RED/FAR、BLUE和对照处理的苦荞芽茎长呈升高的变化趋势.以1.5 RED/FAR处理的在第10~12 d呈平缓趋势.以RED和LED处理的在12 d以后趋于平缓.在第6~14 d,0.5 RED/FAR处理的茎长始终最小.第8 d,LED处理的茎长最大,比对照处理的高出了0.87 cm,比0.5 RED/FAR处理的高出了3.81 cm.除第8 d外,其余时间均以对照处理的茎长最大,分别比0.5 RED/FAR处理的高出了1.31 cm、4.37 cm、4.51 cm、5.01 cm.由此可以看出,黑暗条件能够促进苦荞芽茎的伸长.在第14 d,1.5 RED/FAR处理的芽长仅低于对照处理,比其余光照处理(RED、BLUE、0.5 RED/FAR、LED)分别高出了0.39 cm、2.10 cm、2.33 cm、1.40 cm.
2.1.3 苦荞发芽过程中茎粗的变化.
苦荞种子在发芽过程中茎粗的变化如图3所示.
由图3可知,苦荞种子在发芽过程中,以RED、1.5 RED/FAR、BLUE处理的苦荞芽茎粗呈升高的变化趋势.对照处理的在第10~12 d呈平缓趋势.以0.5 RED/FAR和LED处理的在第12 d以后趋于平缓.第6~10 d,对照处理的苦荞芽直径最大,分别比同时间BLUE、1.5 RED/FAR、RED处理的增加了0.11 mm、 0.10 mm、0.06 mm.
第12 d LED处理的苦荞芽直径最大,比对照处理的增加了0.04 mm,比1.5 RED/FAR处理的增加了0.06 mm.第14 d RED、1.5 RED/FAR、DARK和LED处理的苦荞芽直径都达到了最大值1.00 mm,比0.5 RED/FAR处理的高出了0.07 mm.由此可以看出,黑暗条件能促进苦荞芽直径的增加.

图3苦荞芽茎粗的变化趋势
2.2 苦荞发芽过程中抗氧化活性的变化
2.2.1 苦荞芽中DPPH自由基清除能力的变化.
在播种后第10 d,苦荞芽对DPPH自由基清除能力的变化如图4所示.

图4苦荞芽对DPPH自由基清除能力的变化(播种后第10 d)
由图4可知,在播种后第10 d,以1.5 RED/FAR处理的苦荞芽对DPPH自由基的清除率最高,为90.9%.以RED处理的苦荞芽对DPPH自由基的清除率最低,为84.5%.对照处理的苦荞芽对DPPH自由基的清除率为90.3%.与对照处理的相比,1.5 RED/FAR处理的苦荞芽对DPPH自由基的清除率提高了0.6%.与其余光照处理的(RED、BLUE、0.5 RED/FAR、LED)相比,1.5 RED/FAR处理的苦荞芽对DPPH自由基的清除率分别提高了0.6%、0.8%、1.4%、0.9%.
2.2.2 苦荞芽中ABTS自由基清除能力的变化.
在播种后第10 d,苦荞芽对ABTS自由基清除能力的变化如图5所示.
由图5可知,在播种后第10 d,以1.5 RED/FAR处理的苦荞芽对ABTS自由基的清除率最高,为71.0%.LED处理的苦荞芽对ABTS自由基的清除率最低,为64.4%.对照处理的苦荞芽对ABTS自由基的清除能力为68.3%.与对照处理的相比,RED和1.5 RED/FAR处理的苦荞芽对ABTS自由基的清除率显著提高,分别提高了2.6%和3.9%.1.5 RED/FAR处理的苦荞芽对ABTS的清除率比RED处理提高了1.3%.0.5RED/FAR和LED处理下的苦荞芽对ABTS自由基的清除率与对照相比都降低,分别降低了2.7%和6.0%.

图5苦荞芽对ABTS自由基清除能力的变化(播种后第10 d)
2.3 苦荞芽中总黄酮含量的变化
苦荞芽中总黄酮含量的变化如图6所示.

图6苦荞芽中总黄酮含量的变化趋势
由图6可知,苦荞种子在发芽过程中,每种光质处理下的总黄酮含量变化趋势都不同.以1.5 RED/FAR和0.5 RED/FAR处理的在整个发芽过程中总黄酮含量都比对照处理的高.第6 d、第8 d和第14 d都以对照处理的总黄酮含量最低,分别为40.36 mg/g、43.90 mg/g和53.24 mg/g.第6 d和第14 d LED处理的总黄酮含量最高,与同时间下对照处理的相比提高了7.2%和17.1%.以0.5 RED/FAR处理的总黄酮含量在第8 d比对照处理的提高了15.1%,在第10 d比对照处理的提高了22.8%,比RED处理的提高了29.5%.0.5 RED/FAR处理的总黄酮含量在第12 d比对照处理的提高了9.3%,比LED处理的提高了16.9%.在第14 d,所有光照处理的总黄酮含量都比对照处理的高.
2.4 苦荞芽中芦丁含量的变化
在播种后第10 d,苦荞芽中芦丁含量的变化如图7所示.

图7苦荞芽中芦丁含量的变化(播种后第10 d)
由图7可知,在播种后第10 d,每种光质处理的苦荞芽中的芦丁含量存在明显差异.以0.5 RED/FAR处理的苦荞芽中芦丁含量最高,为24.70 mg/g,远高于其他光照处理.BLUE处理的苦荞芽中芦丁含量最低,为17.89 mg/g.对照处理的苦荞芽中芦丁含量为20.23 mg/g.与对照处理的相比,以1.5 RED/FAR和0.5 RED/FAR处理的增加了苦荞芽中芦丁含量,分别提高了2.9%、23.9%.其余光照处理的(RED、BLUE、LED)则降低了苦荞芽中芦丁含量,分别降低了9.3%、2.0%、13.1%、7.3%.
2.5 苦荞芽中槲皮素含量的变化
在播种后第10 d,苦荞芽中槲皮素含量的变化如图8所示.
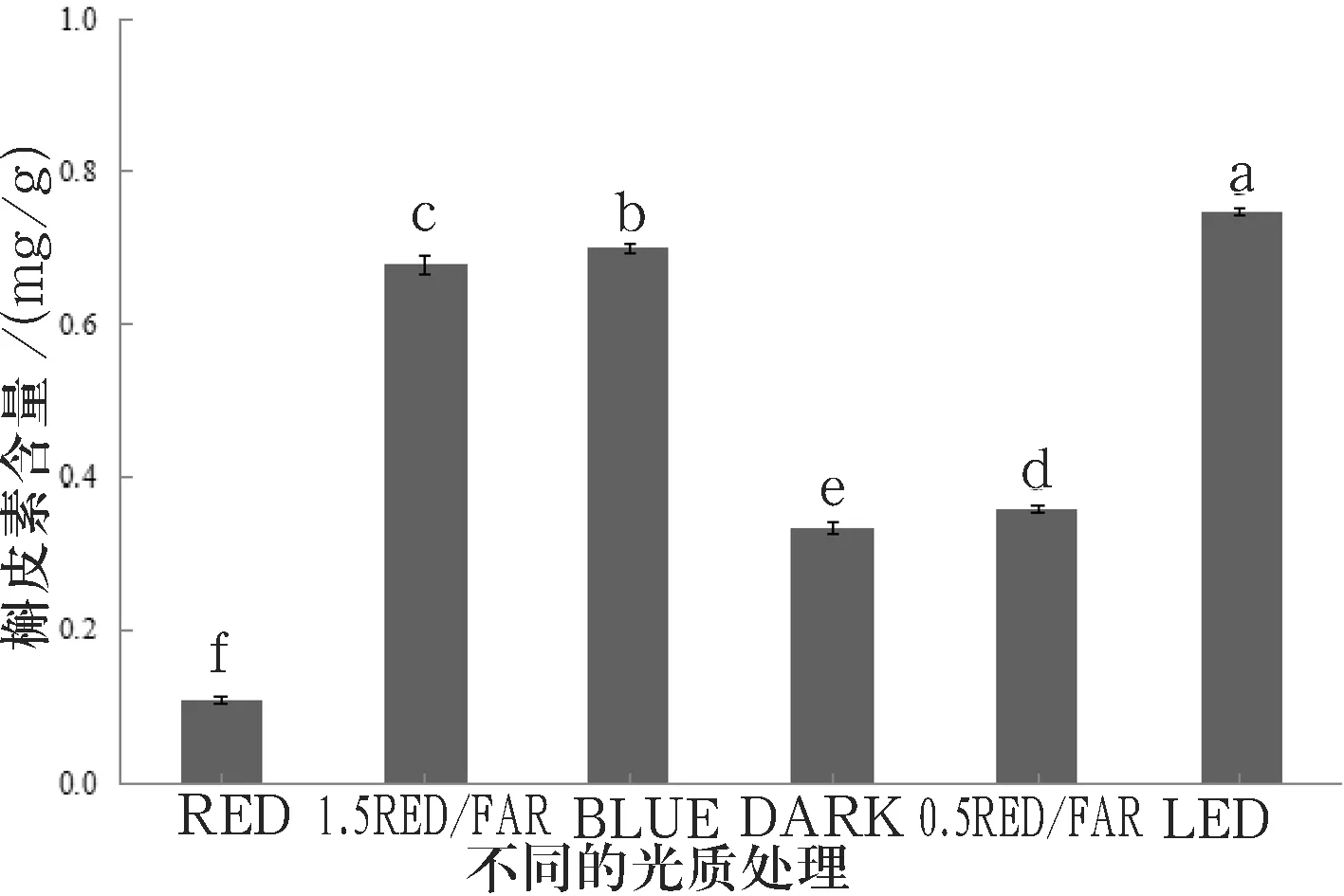
图8苦荞芽中槲皮素含量的变化(播种后第10 d)
由图8可知,在播种后第10 d,每种光质处理的苦荞芽中槲皮素含量存在明显差异.LED处理的苦荞芽中槲皮素含量最高,为0.75 mg/g,RED处理的苦荞芽中槲皮素含量最低,为0.11 mg/g.对照处理的苦荞芽中槲皮素含量为0.33 mg/g.与对照处理的相比,光照处理的(1.5 RED/FAR、BLUE、0.5 RED/FAR、LED)增加了苦荞芽中槲皮素含量,分别提高了50.8%、52.3%、7.0%、55.3%,其中1.5 RED/FAR、BLUE和LED最为显著,分别比0.5 RED/FAR处理的提高了47.1%、48.7%、52.0%.RED处理的则显著降低了苦荞芽中槲皮素含量,降低了67.7%.
3 讨 论
试验结果表明,以0.5 RED/FAR处理的苦荞芽茎长和茎粗最小,对照处理(黑暗)的最大.第10 d、第14 d,以RED处理和1.5 RED/FAR处理的苦荞芽鲜重最大,其余时间以对照处理(黑暗)的最大.BLUE处理也能抑制苦荞芽茎的伸长,这与文献[16]的研究结果相同.由于蓝光能提高吲哚乙酸(IAA)氧化酶的活性,使IAA含量降低,进而抑制植物的伸长.因此相较于光照条件,黑暗条件更有利于苦荞芽直径的伸长和粗度的增加.
在本试验中,除以1.5 RED/FAR处理的外,其余光照条件下苦荞芽对DPPH自由基的清除能力都有所降低,这与文献[17]的试验结果不同.分析其原因可能是由于光照强度和光照时间的不同所引起的.光照条件下(RED、1.5 RED/FAR)苦荞芽对ABTS自由基的清除能力显著提高,其余光照条件则降低.
试验还发现,以1.5 RED/FAR和0.5 RED/FAR的处理增加了苦荞芽中总黄酮的含量,其中0.5 RED/FAR处理的增加效果最显著.LED处理的总黄酮含量在第6 d和第14 d达到最高值.黑暗处理的总黄酮含量在第6、8、14 d都达到了最小值.与黑暗条件相比,光照能提高苦荞芽中总黄酮含量,原因是由于黄酮为次生代谢产物,光照对苦荞芽产生刺激,从而使苦荞芽的代谢增快,增加次生代谢产物的累积.1.5 RED/FAR和0.5 RED/FAR处理的增加了苦荞芽中芦丁的含量,表明这两种光处理有利于苦荞芽中芦丁的累积.光照处理(1.5 RED/FAR、BLUE、0.5 RED/FAR、LED)显著提高了苦荞芽中槲皮素的含量,表明这几种光有利于苦荞芽中槲皮素的累积.
综上可知,不同光质处理下苦荞芽的鲜重、茎长和茎粗随着时间的增加都呈逐步上升的趋势.1.5 RED/FAR处理的鲜重和茎粗在第14 d都达到最大值,并且与对照处理相比差异不显著.除0.5 RED/FAR处理的外,其余处理的芽茎粗在第14 d差异也不显著.1.5 RED/FAR处理的能够显著提高苦荞芽对DPPH和ABTS自由基的清除能力.1.5 RED/FAR、0.5 RED/FAR处理的都能提高苦荞芽中总黄酮和芦丁的含量,其中0.5 RED/FAR处理的对芦丁含量的增加效果最显著.1.5 RED/FAR、BLUE、0.5 RED/FAR和LED处理的能显著增加苦荞芽中槲皮素的含量.由此可知,光照能够提高苦荞芽中黄酮类物质的含量以及自由基的清除率,在苦荞芽的栽培中可以适当通过改变光照条件来提高苦荞芽的品质.

