青蒿素对胃癌SGC-7901侧群细胞裸鼠移植瘤生长的影响
刘元,钱军*,郭晨旭,朱超,刘先富,承泽农
(1.安徽省蚌埠医学院第一附属医院肿瘤外科,安徽 蚌埠 233000;2.病理科)
从2015年的中国癌症统计数据中发现,胃癌在恶性肿瘤中的发病率、患者的死亡率仍居于癌症的前列[1],其治疗主要是手术与化疗的结合,预后不理想。近些年,在基础研究中发现,很多肿瘤细胞中含有一种具有肿瘤干细胞特性的细胞亚群,即侧群(side population,SP)细胞,其具有高分化、自我复制及在体内高成瘤等特性[2-3]。研究发现,SP细胞在肿瘤细胞的耐药、复发方面起着重要的作用,从而导致肿瘤的治疗效果不理想[4-5]。青蒿素是屠呦呦于1971年从黄花蒿中提取,并且对鼠疟原虫的控制效果较好[6],屠呦呦也因此获得2015年诺贝尔奖。近年来,随着对青蒿素的研究,发现青蒿素具有较强的抗肿瘤活性[7-8]。目前就青蒿素对胃癌SGC-7901 SP细胞裸鼠移植瘤生长的影响报道较少,本实验拟探究SP细胞的高致瘤性及青蒿素对各组移植瘤生长及凋亡蛋白表达的影响。
1 材料与方法
1.1 实验动物 SPF级BALB∕c-nu裸鼠购于北京维通利华实验动物技术有限公司,4周龄,体重(16.6±0.92)g,实验动物许可证号:SCXK(京)2012-0001,均为雌性。
1.2 实验试剂及药材 RPMI-1640不完全培养液、磷酸盐缓冲液(PBS)、青蒿素购于杭州四季青公司,Hocehst 33342染料购于美国Sigma公司,维拉帕米购于上海医药集团有限公司,免疫组化试剂盒购自英国Abcam公司,SGC-7901胃癌细胞株购自南京凯基生物科技发展有限公司。1.3 细胞培养 将胃癌SGC-7901细胞培养在37℃、5%CO2、95%湿度恒温箱中。定期换液、传代。
1.4 胃癌SGC-7901细胞株SP细胞及NSP细胞的分选 取处于对数生长期的细胞,消化、离心后弃上清液,用含2%胎牛血清(FBS)的PBS将细胞数调整为1×106∕ml。取其中2只离心管作为拮抗组,细胞悬液中加入维拉帕米 10 μl∕ml,余下的离心管作为实验组,在每个离心管的细胞悬液中加入 Hoechst 33342 5 μl∕ml,移入培养箱中孵育90 min,15 min振荡一次。孵育后离心5 min,弃上清液,用含2%FBS的PBS将细胞数重悬至1×106∕ml。移至灭菌流式管中,流式细胞仪检测分选,Hoechst 33342在350 nm条件被激发,获得荧光呈双重波长:蓝光402~446 nm;红光650~670 nm,分别收集SP细胞及NSP细胞。
1.5 裸鼠接种细胞悬液的制备 取对数生长期的SP细胞和NSP细胞,消化、离心后弃上清液;用PBS重悬细胞,血球计数板记数活细胞,当活细胞比率>95%,稀释细胞浓度至5×106∕ml。
1.6 实验分组 取裸鼠20只,随机分为SP细胞组和NSP细胞组,每组10只,取相应的细胞悬液0.2 ml,接种在裸鼠右腋部偏后方皮下,SP细胞组和NSP细胞组再随机分为生理盐水(NS)组、青蒿素(将青蒿素纯品溶解于少量DMSO,再用生理盐水稀释到所需浓度)组。
1.7 裸鼠移植瘤实验 裸鼠接种细胞24 h后,青蒿素组予青蒿素悬液200 mg∕kg灌胃,对照组予0.5 ml NS灌胃,每天1次,连续给药32 d。移植瘤体积有差异后每3 d测量一次移植瘤的长∕短径(a∕b),计算瘤体体积V,V=a×b2∕2。第32天处死裸鼠,剥离瘤体,称取重量,计算抑瘤率,抑瘤率=(对照组相对重量-实验组相对重量)∕对照组相对重量×100%。
1.8 免疫组化检测 Bcl、Bax、Caspase-3、Caspase-9蛋白的表达 将瘤组织固定、脱水、透明、包埋,连续切片;切片脱蜡水化后,作抗原修复,用FBS代替一抗做阴性对照;每张切片加1滴3%H2O2溶液,常温下孵育,PBS冲洗;每张切片滴加1滴相应一抗,常温下孵育,PBS冲洗;每张切片滴加1滴聚合物增强剂(试剂A),室温下孵育,PBS冲洗;每张切片滴加1滴酶标抗鼠∕兔聚合物(试剂B),室温下孵育,PBS冲洗;每张切片滴加1滴新配置的DAB液,显微镜下控制发色,自来水冲洗终止显色,复染、脱水透明、封片。结果判断:(1)阳性细胞百分比(PP):在400倍的显微镜下,取5个不同视野,每个视野计数3遍,取其平均值,为阳性细胞数,阳性细胞数与该视野中细胞总数的比为阳性细胞百分比。然后取平均值,作为该张切片的PP。无阳性细胞记为0分,PP<10%记1分;11%~50%记2分;51~75%记3分;>75%记4分。(2)染色强度(SI):0分为无色,淡黄色为1分;棕黄色为2分;棕褐色为3分。每张切片的PP×SI为免疫组化评分(IRS)[9]。
1.9 统计学方法 采用 SPSS 20.0软件进行统计学分析,实验结果数据以均数±标准差表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SP细胞的分选 通过流式细胞术,检测出胃癌SGC-7901细胞中SP细胞所占比为1.53%±0.47%,经维拉帕米拮抗后SP细胞所占比为0.1%。
2.2 青蒿素对移植瘤的影响 移植瘤见于接种细胞后第3天。于第5天移植瘤体积出现差异,差异有统计学意义。SP细胞及NSP细胞青蒿素组移植瘤体积均小于NS组(P<0.05);NSP细胞NS组移植瘤体积小于SP细胞NS组(P<0.05),见表1。SP细胞与NSP细胞青蒿素组的抑瘤率分别为55.02%和47.09%,见表2。
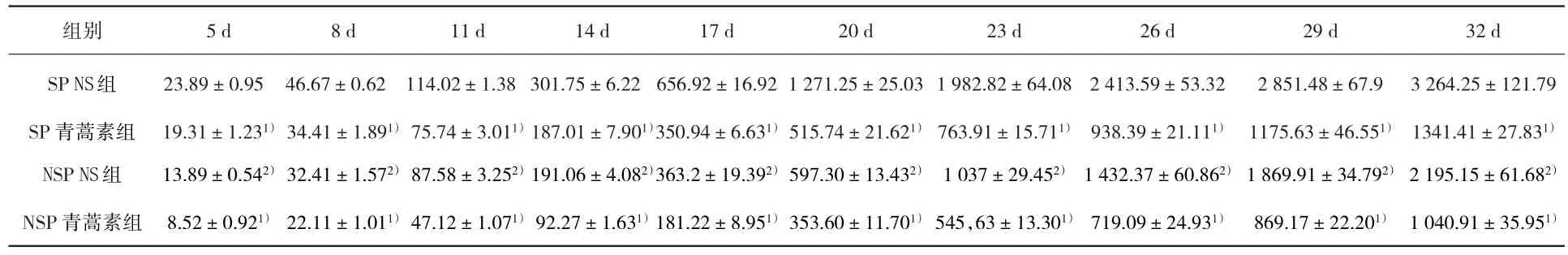
表1 裸鼠移植瘤体积比较(n=5,mm3)
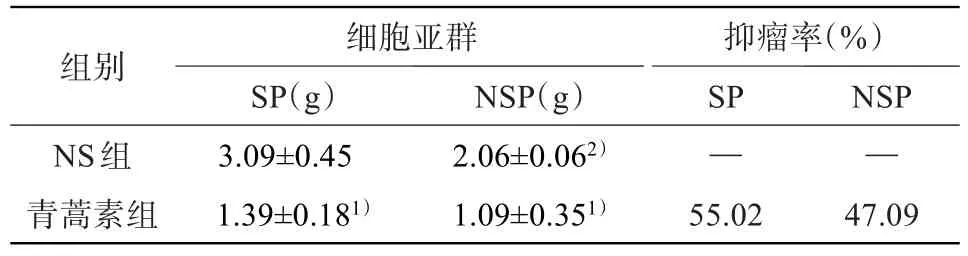
表2 裸鼠移植瘤重量及抑瘤率
2.3 免疫组化检测瘤体中相关蛋白的表达Bcl-2在SP细胞、NSP细胞青蒿素组的表达低于相应NS组;在NSP细胞NS组中的表达低于SP细胞NS组(P<0.05);NS组中Caspase-9、Caspase-3、Bax的表达低于相应青蒿素组,在NSP细胞NS组的表达高于SP细胞NS组(P<0.05),见图1、表3。
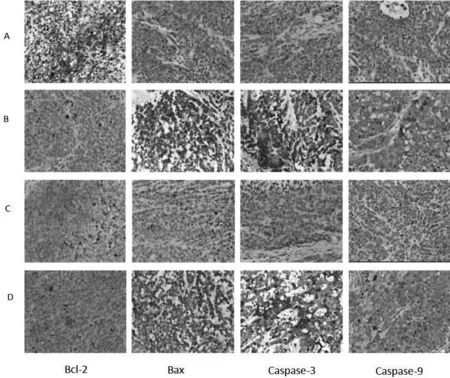
图1 凋亡相关蛋白的免疫组化图(SP×400)
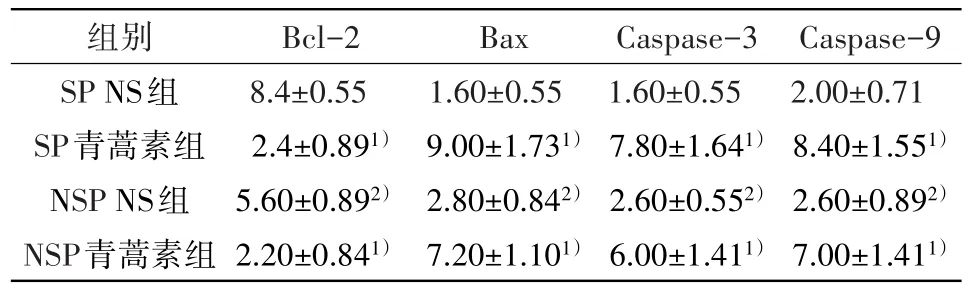
表3 凋亡相关蛋白的免疫组化结果(IRS平均分值)
3 讨论
肿瘤细胞对西药的治疗逐渐出现耐药,而这种耐药却很难逆转,对于肿瘤的治疗,也开始转向中药辅助治疗,且中药对肿瘤的治疗有效、副作用低等优势,对肿瘤细胞的抑制作用也得到进一步的了解,通过作用细胞溶酶体、诱导细胞凋亡以及激活机体免疫系统而间接地抑制肿瘤生长[10-13]。
在本次实验中,再次验证了胃癌SGC7901细胞中是含有SP细胞,量较少,结合移植瘤的体积及重量,验证了同等量SP细胞成瘤能力强于NSP细胞。在细胞的线粒体凋亡通路中,蛋白Bcl-2、Bax、Caspase-3和Caspase-9扮演着重要的角色,Bcl-2蛋白家族增加细胞线粒体膜通透性,释放细胞色素C,诱导Caspase-3和Caspase-9发生级联反应,诱导凋亡信号传导,促进细胞凋亡[14-15]。Bcl-2蛋白家族成员包括抗凋亡蛋白Bcl-2和促凋亡蛋白Bax,在细胞中两者的比例决定着细胞的 凋 亡 与 否[12]。 Caspase-9、Caspase-3 蛋 白 为Caspase家族中的成员,分别为起始和效应Caspase,Caspase-9、Caspase-3蛋白的激活,为细胞凋亡的一个重要特征,当Caspase蛋白高表达时,预示细胞处于一种凋亡状态,从而抑制肿瘤生长[16-17]。所以当移植瘤组织中低表达Bcl-2,高表达Bax、Caspase蛋白时,细胞是处于一种高凋亡状态,肿瘤生长较慢,相反,则利于肿瘤生长。在本实验NS组中,相对于NSP细胞组,SP细胞瘤体组织中高表达Bcl-2,低表达Bax、Caspase-3、Caspase-9蛋白,处于一种低凋亡的状态,利于肿瘤的生长。SP细胞NS组瘤体的体积大于NSP细胞NS组,SP细胞的成瘤强于NSP细胞,与SP细胞处于一种低凋亡状态有关。在SP及NSP细胞组中,青蒿素组的瘤体较NS组小,与瘤体组织中低表达Bcl-2,高表达Bax、Caspase-3、Caspase-9蛋白相关,青蒿素处理后可以逆转细胞的凋亡状态,是细胞由低凋亡状态向高凋亡状态转变,从而抑制肿瘤的生长。
经过本组基础实验发现,胃癌SGC-7901细胞中是含有极少量的SP细胞,而SP细胞具有高成瘤能力,高成瘤的特性与SP细胞处于一种低凋亡的状态有关,青蒿素对SP、NSP细胞裸鼠成瘤具有一定的抑制作用,其机制与通过改变细胞凋亡状态,使细胞处于一种高凋亡的状态有一定的相关性,从而抑制肿瘤的生长。由于目前对于青蒿素的研究尚处于基础实验阶段,确切机制尚待探讨,望不久可以应用于肿瘤临床的治疗。
——青蒿素

