黑曲霉发酵液改善上部烟叶风味品质的研究
全铭沁,董惠忠,沙云菲,陈 磊*,陈玙捷,张薄博,许赣荣
(1.江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2.上海烟草集团有限责任公司,上海 200082)
烟草是一种重要的经济作物,是国家税收的重要来源。烟叶按采收部位分为上部叶、中部叶、下部叶,其中中部叶品质优良,在烟草工业中大量使用。而上部叶和下部叶与优等的中部叶相比,由于化学成分协调性差,因此使用率很低,被视为低次烟叶。上部烟叶包括上二棚叶和顶叶,共6~7片,占整株烟叶总量的30%~40%[1]。上部烟叶叶片较厚,结构较为致密,成熟度不够,而且蛋白质等大分子及烟碱含量过高,还原糖含量及糖碱比过低,因而化学成分协调性较差,导致燃烧后存在烟气浓度和劲头偏大、刺激性大、杂气重等缺点[2-4],这些因素导致上部烟叶的利用率大大降低,造成烟叶资源的严重浪费。
近年来用于改善低次烟叶燃吸品质的方法主要有化学添加法、生物酶法和微生物发酵法[5-7]。微生物发酵法是在烟叶上人工接种微生物,对烟叶进行发酵[8],是实现烟叶增香增质的有效途径之一,烟叶的发酵通常分为自然发酵和人工发酵两种[9]。自然发酵是将烟叶处理过后经过一段时间的自然陈化的发酵方法,虽然操作简单,但发酵耗时较长,占用空间大,经济性较差。因此,近年来采用人为的控制外在条件进行,接种相关的细菌或真菌促进烟叶尽快发酵的研究日渐增多。李宁等[10-11]分别利用蜡样芽孢杆菌(Bacillus cereus)和短小芽孢杆菌(Bacillus pumilus)Van35处理烟叶后,发现烟叶的烟碱、蛋白质等明显降低,同时可显著增加烟香、降低刺激性、醇和烟气,改善卷烟吸味。陈雨峰等[12]发现,用不同浓度芽孢杆菌液处理上部烟叶后,均可促进烟叶淀粉降解,提高糖含量、糖碱比、氮碱比和香气量。邹晓等[13]比较多株食用菌对烟叶品质改善的效果后,发现平菇(Pleurotus ostrea)的一株菌有较好的醇化效果对烟叶品质改善显著,能有效提升烟叶香气量和丰富性。余玉莎等[14]以米根霉(Rhizopus oryzae)TZK-1对烟叶进行发酵,结果表明,米根霉TZK-1发酵烟末能使烟叶中18种致香成分含量增加。与自然发酵相比,人工发酵时间较短,但发酵工艺较为复杂,吸食品质比自然发酵稍差[15]。在此基础上,有学者结合生物酶法和微生物发酵法的优势,利用酶制剂和微生物处理烟叶碎片废弃物制备天然烟用香料,使烟用香料在香气和口感上比对照有明显的提高,增香效果明显[16]。与目前常用的三种烟叶品质改善方法相比,生物酶法和微生物发酵法结合的方法既可以弥补发酵液本身酶活不足的缺陷,又能将发酵液中所含烟草本身的风味成分添加到烟草中,在有效降低低次烟叶中淀粉、蛋白质等大分子成分含量的同时,使烟草的香气质和香气量得到显著提高。
本研究为降低上部烟叶中的淀粉和蛋白质含量,提高燃吸品质,分别采用不同产地及类别的上部烟叶作为培养液基质采用黑曲霉(Aspergillus niger)进行发酵,以发酵液中淀粉酶和蛋白酶活为综合指标,对烟叶添加量、接种量、初始pH、发酵温度和发酵时间等条件进行优化,得到最佳发酵条件。并将发酵液与复合生物酶(含淀粉酶、蛋白酶、果胶酶和纤维素酶等)共同作用于上部烟叶,测定作用后烟叶中淀粉和蛋白的降解率,并对燃吸效果进行感官评吸。以期效缓解优质烟叶不足的状况,节约资源,降低成本。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和烟叶
黑曲霉(Aspergillus niger):中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC),菌株编号分别为3.6942、3.3927、3.4309、3.7059,为方便使用,实验室将其分别记为h1、h4、h5、v。福建B1F上部青烟叶、河南B1F上部烟叶、湖南B1F上部烟叶、贵州B1F上部烟叶、河南B2F上部烟叶、湖南B2F上部烟叶、贵州B2F上部烟叶:上海烟草集团有限责任公司。
1.1.2 化学试剂
盐酸、氢氧化钠、无水乙醇、浓硫酸、酪蛋白、可溶性淀粉(均为分析纯):国药集团化学试剂有限公司;低温α-淀粉酶(酶活2 000 U/g)、中性蛋白酶(酶活2×105U/g)、果胶酶(酶活1×105U/g)、纤维素酶(酶活5×104U/g):江苏锐阳生物科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸出粉6 g/L,葡萄糖20 g/L,琼脂20 g/L,121℃高压灭菌20 min。
烟叶液态发酵培养基:不同产地及等级的上部烟叶粉末(过40目筛)5~50 g/L(具体添加量由实验优化),添加蒸馏水分散均匀,121℃高压灭菌20 min。
1.2 仪器与设备
H2-2型电热恒温振荡水浴箱:上海精宏实验设备有限公司;HYL-C3型组合式摇床培养箱:太仓市强乐实验设备有限公司;AA3型连续流动化学分析仪:德国SEAL公司;TGL-16M型台式高速离心机:湖南赛特湘仪离心机仪器有限公司;Enspire 2300型酶标仪:美国PerkinElmer公司;UV3000型紫外-可见光分光光度计:日本Hitachi公司;MB45红外水分测定仪:美国OHAUS仪器有限公司;FAl004型电子天平:上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 菌种活化
将保存的菌种黑曲霉(Aspergillus niger)菌株 h1、h4、h5和v分别接种于PDA斜面培养基,28℃条件下恒温培养1 d,进行活化。
1.3.2 种子液制备
将供试烟叶磨碎成烟末,过40目筛,按照1%的烟叶添加量,称取2 g烟末加入500 mL三角瓶中,加水200 mL,121℃灭菌20min,冷却。用移液枪向斜面试管中加入10mL无菌水,反复吹吸使黑曲霉孢子分散在无菌水中,吸取一定量的孢子悬液接种到种子培养基中,使初始孢子浓度达到109个/mL,160 r/min、30 ℃摇瓶发酵3 d,用于发酵瓶中的培养。
1.3.3 菌种筛选
按5%的烟叶添加量,称取粉碎后(过40目筛)的10 g上部烟叶加入500 mL三角瓶中,加水200 mL,在121℃的条件下灭菌20 min,待充分冷却后,接入上述4种黑曲霉种子液,160 r/min、30℃摇瓶培养6 d,过滤掉培养基中固体成分后,离心获得黑曲霉发酵液,测定其中淀粉酶、蛋白酶的活力。选定综合活性最高的菌株,进行发酵优化。
1.3.4 分析检测
酶活测定方法:淀粉酶活性测定参照文献中对大曲液化力的检测方法[17],以1 h液化可溶性淀粉1 g为1个酶活力单位(1 U);蛋白酶活性测定依照GB/T 23527—2009《蛋白酶制剂》方法进行[18],以1 min水解酪蛋白产生1 μg酪氨酸为1个酶活力单位(1 U)。
淀粉含量的测定参照文献[19];蛋白含量测定参照GB 5009.5—2016《食品中蛋白质的测定》方法[20]。
1.3.5 发酵条件的优化
烟叶添加量:按照0.5%、1%、2%、3%、4%、5%的烟叶添加量配制发酵培养基,pH为发酵液原始值(约为6),接种5%体积分数种子液,160 r/min、30℃摇瓶培养6 d。发酵结束后经过滤离心获得黑曲霉发酵液,测定发酵液的淀粉酶和蛋白酶的酶活力。
接种量:以上述最佳烟叶添加量配制培养基,按照1%、3%、5%、7%、9%的接种量接种,其他条件同上所述,发酵结束后测定发酵液中淀粉酶和蛋白酶的酶活力。
初始pH值:以上述最佳烟叶添加量配制培养基,调节发酵培养基的pH值分别为4.0、5.0、6.0、7.0、8.0,并接种适当体积种子液。其他条件同上所述,发酵结束后测定发酵液中淀粉酶和蛋白酶的酶活力。
发酵温度:培养基中烟叶添加量、pH及接种量由上述实验确定,分别在26℃、28℃、30℃、32℃、34℃条件下,160 r/min摇床培养6 d。发酵结束后测定发酵液中淀粉酶和蛋白酶的酶活力。
发酵时间:其他发酵条件由上述实验确定,按照发酵时间为1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d分别收集对应时间的发酵液,过滤离心获取上清液,测定发酵液中的淀粉酶和蛋白酶的酶活力。
1.3.6 发酵液与复合酶对上部烟叶品质改善的条件
将发酵液以及发酵液作为缓冲液复配复合酶对上部烟叶进行处理,并优化处理条件,比较不同条件下上部烟叶品质的改善效果。
烟叶的处理方法:陈化后的上部烟叶经松散回潮、切丝、烘丝后,制得试验用长度均匀的烟丝(水分约12.5%)。精确称取(10.00±0.02)g烟丝置于筛网,于65℃水浴箱中保温回潮20 min。将回潮结束的烟丝平铺于干净的20 cm×16 cm陶瓷托盘,按照一定料水比将发酵液或发酵复合酶液均匀喷洒在烟丝上,以食品级密封袋密封好,于适当温度恒温箱中酶解。反应结束后,采用烘箱快速烘干至水分含量12.0%~12.5%,装袋存放。将烟叶样品磨成粉末后,测定其中的淀粉含量和蛋白质含量。
在本实验室前期进行的生物酶法降低上部烟叶中淀粉和蛋白等大分子的实验中,得到适于处理上部烟叶的商品复合酶配比为[21]:中性蛋白酶550 U/g烟叶,纤维素酶220U/g烟叶,果胶酶220U/g烟叶,低温α-淀粉酶33U/g烟叶(为降低反应温度,提高反应效率,采用低温淀粉酶)。将此配方中所含复合酶量定义为1个复合酶活力单位(1U/g),并用于本研究的实验中。其中果胶酶和纤维素酶的作用为适度降解烟叶细胞壁,使淀粉酶和蛋白酶可以更为充分地起到降解作用,在本研究的发酵条件优化中未作为测定指标。
分别考察含水量(即2mL、4mL、6 mL、8 mL)发酵液溶解1U/g烟叶复合酶,分别对应烟丝含水量(20%、40%、60%、80%)、发酵液比例(即在20%含水量前提下,调整其中发酵液比例为25%、50%、100%)、复合酶浓度[在20%含水量前提下,等量发酵液和水作为缓冲液,对不同复合酶添加量(1 U/g烟叶、0.5 U/g烟叶、0.25 U/g烟叶)]、反应温度(30℃、40 ℃、50 ℃)及反应时间(0.5 h、1.0 h、2.0 h、3.0 h、4.0 h)进行优化。
发酵培养基所用烟叶种类对上部烟叶品质的影响:在前期发酵时,使用不同的烟叶粉末配制不同的发酵培养基。使用的7种烟叶如下:福建B1F青烟叶、河南B1F上部烟叶、湖南B1F上部烟叶、贵州B1F上部烟叶、河南B2F上部烟叶、湖南B2F上部烟叶、贵州B2F上部烟叶。发酵结束后经过滤离心取上清收集7种发酵液和灭菌后未接种的河南B2F培养液,将所得样品按照上述条件对上部烟叶进行处理,比较改善效果。
1.3.7 烟叶评吸方法
由烟草公司的评吸人员对部分处理过的烟丝进行评吸,评吸方法参考烟草行业标准YCT 138—1998《烟草及烟草制品感官评价方法》中的三点检验的方法进行。每种样品使用未处理的烟丝作为空白对照,两支空白,一支样品。通过评吸时的差别对样品进行打分。参与评价的感官质量指标为:香气质、香气量、杂气、劲头、刺激性、余味。对每一种质量指标打分,最后进行比较总结。打分说明如下:杂气分数越高,说明杂气量越少;劲头分数越高,说明劲头越小;刺激性分数越高,说明刺激性(鼻腔、喉部)越小。
1.3.8 数据处理
所有试验均采用3次平行设计(n=3),试验数据采用Sigma plot 12.5软件进行统计分析和作图。
2 结果与分析
2.1 菌株筛选
选取实验室保藏的4株黑曲霉菌种,分别以上部烟叶为培养基底物进行液态发酵,筛选产淀粉酶及蛋白酶活力较高的菌株。结果表1所示。

表1 黑曲霉液态发酵上部烟叶菌种筛选Table1 Screening of the strains ofAspergillus nigerin liquid state fermentation of the upper tobacco leaves
由表1可以看出,选用的4株黑曲霉菌株中,菌株v产淀粉酶酶活最高,酶活力为2.02 U/mL,而菌株h5产蛋白酶酶活最高,为1.88U/mL。因此,综合两种酶活的结果(两种酶均具有较高酶活),选定黑曲霉h5菌株作为上部烟叶发酵菌株。
2.2 发酵条件的优化
2.2.1 培养基中最佳烟叶添加量的确定
通过改变发酵培养基中的烟叶添加量,以提高发酵后培养液中淀粉酶和蛋白酶的酶活,结果见图1。由图1可知,在测定烟叶添加量范围内(0.5%~5%),淀粉酶酶活先增大后降低,在烟叶添加量为3%时,淀粉酶酶活达到最高,为2.41 U/mL;而蛋白酶酶活呈现先增大后趋于稳定,在烟叶添加量为4%时达到最高,为1.83 U/mL,蛋白酶酶活在烟叶添加量为3%和4%时无显著差异(P>0.05)。因此,综合考虑两种酶活的最大值,选取发酵液中烟叶添加量为3%。

图1 不同烟叶添加量对培养液中淀粉酶和蛋白酶酶活的影响Fig.1 Effect of different tobacco addition on the activities of amylase and protease in culture medium
2.2.2 发酵培养基最佳接种量的确定
种子液接种量对发酵后培养液中淀粉酶、蛋白酶酶活的影响结果见图2。由图2可知,接种量对淀粉酶的酶活影响不大,但对蛋白酶的酶活影响较为显著,两种酶的酶活均是随接种量的增大而缓慢上升,在接种量为5%(V/V)时达到最大值,分别为2.69 U/mL和4.64 U/mL;接种量>5%之后,蛋白酶酶活逐步降低。因此,发酵液中最佳接种量选定为5%。
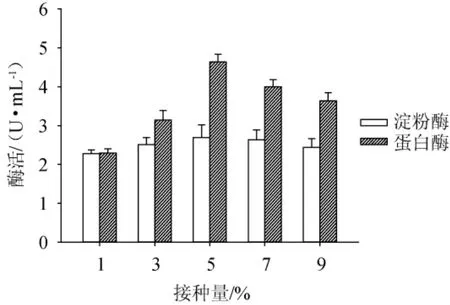
图2 不同接种量对培养液中淀粉酶和蛋白酶酶活的影响Fig.2 Effect of different inoculum on the activities of amylase and protease in culture medium
2.2.3 发酵培养基初始pH的确定
不同初始pH对发酵液中淀粉酶和蛋白酶的酶活的影响结果见图3。由图3可知,两种酶的酶活随发酵液初始pH的增高均具有明显的规律性,淀粉酶和蛋白酶酶活随初始pH增高而逐渐增高,在初始pH=6.0时达到最大值,分别为2.66U/mL和9.74U/mL,之后随pH升高而逐步降低,在初始pH 9.0时,蛋白酶酶活已检测不到。因此,最佳发酵液初始pH值为6.0。

图3 不同初始pH值对培养液中淀粉酶和蛋白酶酶活的影响Fig.3 Effect of different initial pH on the activities of amylase and protease in culture medium
2.2.4 发酵培养基最佳发酵温度的确定
发酵温度对于微生物的生长具有十分重要的影响,发酵培养温度对发酵液中淀粉酶和蛋白酶的酶活的影响,结果见图4。由图4可知,发酵温度对黑曲霉发酵产两种酶的酶活影响是一致的,随着发酵温度的上升,两种酶的酶活力的变化趋势为先升高后降低,当发酵温度为30℃时,两种酶的酶活都达到最大值,分别为2.97U/mL和12.55U/mL。因此,最佳发酵温度为30℃。

图4 不同发酵温度对培养液中淀粉酶和蛋白酶酶活的影响Fig.4 Effect of different fermentation temperature on the activities of amylase and protease in culture medium
2.2.5 发酵培养基最佳发酵时间的确定
发酵时间对发酵液中淀粉酶和蛋白酶的酶活的影响结果见图5。由图5可知,以烟草粉末为培养基底物接种黑曲霉发酵,淀粉酶酶活随发酵时间的延长而提高,在第6天达到最大值3.42 U/mL,继而逐步降低。蛋白酶酶活在发酵第2天出现一个较高值,继而降低,并随发酵时间延长而逐渐升高,第6天达到最高值12.73U/mL,之后酶活逐步降低。因此,确定最佳发酵时间为6 d。
综合上述单因素优化实验可知,使用黑曲霉h5为发酵菌株液态发酵上部烟叶(河南B2F)粉末产复合酶,最优产酶条件为烟叶添加量为3.0%、接种量5%、初始pH值为6.0、发酵温度30℃、发酵时间6 d。

图5 不同发酵时间对培养液中淀粉酶和蛋白酶酶活的影响Fig.5 Effect of different fermentation time on the activities of amylase and protease in culture medium
2.3 发酵液-复合酶体系对上部烟叶吸食品质的改善
前期研究表明,单纯使用复合酶处理上部烟叶,可分别降低其中影响吸食品质的淀粉和蛋白质,使吸食品质有一定提升,但仍存在香气质和香气量偏低、杂气较重等问题。预实验结果表明,使用上部烟叶粉末作为培养基底物进行黑曲霉发酵,将发酵液作为改良剂喷洒于上部烟丝,可显著提升处理后烟丝的香气质和香气量、降低杂气、提升余味,但对劲头和刺激性改善效果不明显。因此,本研究结合两者优势,以烟草发酵液作为缓冲液溶解复合酶(1U/g烟叶),配制复合改良剂,将其作用于上部烟丝,以淀粉和蛋白降解率为评价指标,结合感官评吸,探讨作用过程中的各类影响因素。
2.3.1 含水量对作用效果的影响
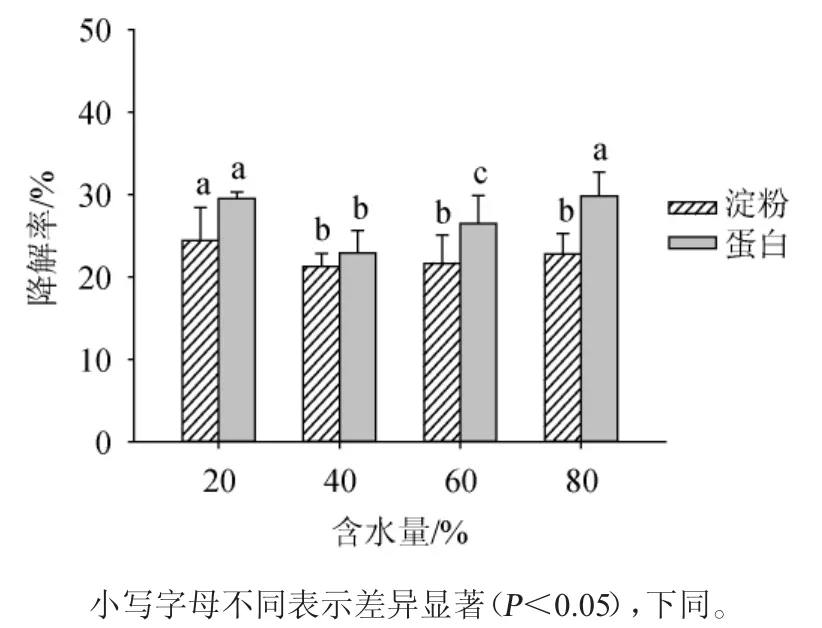
图6 含水量对上部烟叶淀粉和蛋白降解率的影响Fig.6 Effect of water content on degradation rate of starch and protein in upper tobacco leaves
由图6可知,随烟叶中含水量的增加,复合改良剂对烟丝中淀粉和蛋白的降解率均呈现先降低再升高的趋势。在含水量为20%时,淀粉降解率最高,为24.39%;而蛋白质降解率在含水量为80%时最高,为29.78%,但与含水量20%时(蛋白降解率为29.52%)并无显著性差异(P>0.05)。因在实际工业生产中烟叶含水量有严格要求,最高不得超过25%,因此,选择最佳含水量为20%。
2.3.2 发酵液添加量对作用效果的影响
保持20%的烟丝含水量不变,调整复合改良剂中发酵液添加比例分别占总含水量的25%、50%和100%(以水补充不足体积)处理烟丝,结果见图7。由图7可知,随着发酵液添加比例的提高,淀粉降解率显著提高(P<0.05),在发酵液添加量达到50%以后趋于稳定。而发酵液添加比例对蛋白降解率影响不明显,在实验范围内,蛋白降解率约为29.50%。因此,选择发酵液添加量为总含水量的50%为最佳的发酵液添加比例。

图7 发酵液添加量对上部烟叶淀粉和蛋白降解率的影响Fig.7 Effect of fermentation broth addition on degradation rate of starch and protein in upper tobacco leaves
2.3.3 复合酶添加量对作用效果的影响
在上述所确定条件的基础上,探讨复合改良剂中所添加的复合酶量对上部烟叶品质的改善效果,结果见图8。由图8可知,随着复合酶添加量的增加,上部烟叶样品中淀粉和蛋白降解率也随之增加,分别由2.09%和20.78%增加至23.65%和30.41%。当复合酶含量为1 U/g时,淀粉降解率最高为23.65%;蛋白的降解率最高为30.41%。由于前期研究结果显示,在不添加发酵液的条件下,复合酶添加量>1U/g之后,样品的劲头和刺激性有所增加,因此复合改良剂中复合酶添加量选定为1 U/g。
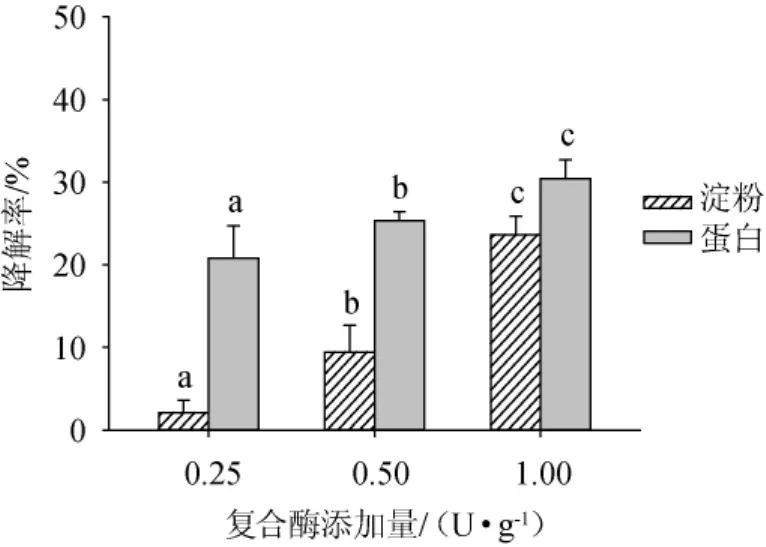
图8 复合酶添加量对上部烟叶淀粉和蛋白降解率的影响Fig.8 Effect of compound enzyme addition on degradation rate of starch and protein in upper tobacco leaves
2.3.4 反应温度对作用效果的影响
反应温度对上部烟叶品质的影响,结果见图9。由图9可知,反应温度在30℃和40℃时,淀粉降解率没有显著性差异,约为23%,而上升至50℃时,淀粉降解率显著下降(P<0.05)。蛋白降解率则呈先上升后下降趋势,在40℃时,蛋白降解率最高,为30.01%。淀粉和蛋白的降解率随温度变化的原因可能是,当反应温度的较高时,作用于烟叶上的酶的活力降低,使得烟叶中的相应化学成分的降解率也随随之降低。综合考虑,选取40℃为复合改良剂的最佳反应温度。

图9 反应温度对上部烟叶淀粉和蛋白降解率的影响Fig.9 Effect of reaction temperature on degradation rate of starch and protein in upper tobacco leaves
2.3.5 反应时间对作用效果的影响
反应时间对上部烟叶品质的影响,结果见图10。由图10可知,0.5~1.0 h作用时间时,淀粉降解率约为23%,无显著差异(P>0.05);在反应时间为2.0~3.0h时,淀粉降解率约为25%,作用时间继续延长,则淀粉降解率下降。蛋白质的降解效果则是随着时反应时间的增加呈下降趋势。在反应时间为0.5 h时,蛋白降解率最大为37.65%;在反应时间>2.0 h以后,蛋白质降解率趋于稳定。由此可得,使用复合改良剂作用于上部烟叶,其中淀粉的降解率在酶解时间为3.0 h时最好,蛋白降解效果在酶解时间为0.5 h时最好。由于淀粉和蛋白的降解率随反应时间的变化趋势呈现较明显的不一致,因此,安排感官评吸实验,以评吸结果确定最佳反应时间,结果见表2。
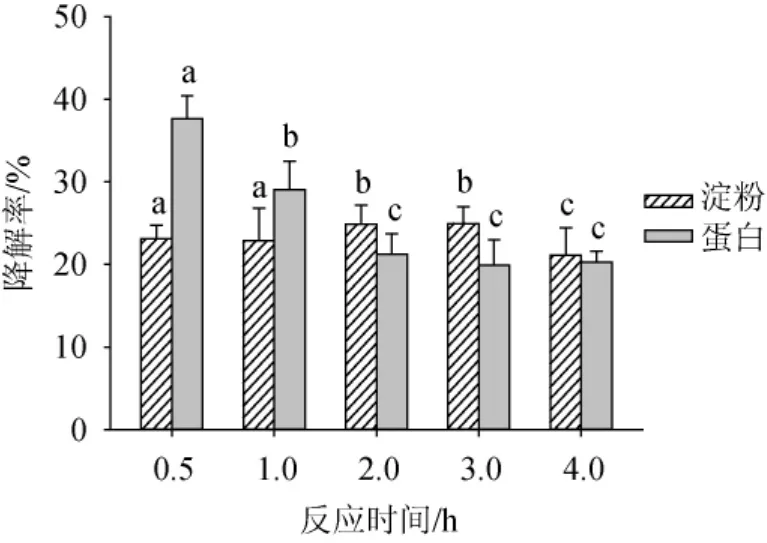
图10 反应时间对上部烟叶淀粉和蛋白降解率的影响Fig.10 Effect of reaction time on degradation rate of starch and protein in upper tobacco leaves

表2 反应时间对河南B2F烟丝感官评吸的影响Table2 Effect of fermentation time on sensory evaluation of Henan B2F cut tobacco
由表2可知,反应时间2.0 h和3.0 h时总分最高,烟气浓度较高,加入发酵液后均会使整支烟的劲头下降、杂气量减少,同时烟气在口腔中显得圆润,不暴躁,有一定的舒适感。而所有经复合改良剂处理过的样品香气质和香气量均有所提升,并具有较好的余味。因此,选取反应时间为2.0 h为最佳,此时,淀粉降解率为24.84%,蛋白降解率为21.22%。
2.4 不同烟叶发酵液作用效果的差异
为进一步探讨不同发酵液-复合酶组成的复合改良剂对上部烟叶吸食品质的改善效果,使用不同类型、不同产地的烟叶作为底物进行黑曲霉发酵,将所得发酵液-复合酶分别用于处理河南B2F烟叶,结果见图11。

图11 多种上部烟叶发酵液(含复合酶)对上部烟叶作用效果Fig.11 Effect of various upper tobacco leaves fermentation broth(with compound enzymes)on upper tobacco leaves
由图11可知,喷洒在烟丝上的发酵液种类不同,淀粉降解率和蛋白降解率不同。其中以产自湖南的两类上部烟叶粉末(湖南B1F和湖南B2F)作为培养液基质进行黑曲霉发酵,所得发酵液与复合酶的复合改良剂(即图11中3和6)对淀粉和蛋白的降解率相对其他产地较高。湖南B1F发酵液与复合酶的复合改良剂对河南B2F上部烟叶中淀粉和蛋白降解效果最好,降解率分别为28.28%和28.83%。
对本实验中所处理的烟叶进行感官评吸,结果如表3所示。

表3 不同发酵液添加复合酶对河南B2F感官品质的影响Table3 Effect of different fermentation broths with compound enzymes on sensory evaluation of Henan B2F
由表3可知,采用不同发酵液-复合酶的复合改良剂对河南B2F上部烟叶样品均有较明显的品质提升,但青烟叶处理得到的样品稍带青杂气,余味略苦涩,不适合于上部烟叶吸食品质的改善。感官评价上湖南B1F上部烟叶发酵液整体效果最好,使样品香气质、香气量有明显提高,同时杂气下降明显,有一定的舒适感,且余味较好,在该组样品中为最优。
2.5 湖南B1F发酵液-复合酶对不同上部烟叶的作用效果
为考察湖南B1F上部烟叶发酵液与复合酶的复合改良剂在其他烟叶中的适用性,将其作用于其他品种的上部烟叶,得到的感官评吸结果见表4。

表4 湖南B1F发酵液处理福建B2F和贵州B2F烟叶的感官评价结果Table4 Sensory evaluation results of Fujian B2F and Guizhou B2F tobacco treated with Hunan B1F fermentation broth
由表4可知,使用湖南B1F发酵液(含复合酶)处理过的福建B2F烟丝样品的烟气稍带暴躁,杂气未发生明显变化,但香气量饱满,主要体现在福建B2F的枯焦气和特征性酸感较舒适,加料之后的整体效果有一定提升。而由于贵州B2F烟叶几乎没有杂气,对于使用湖南B1F发酵液(含复合酶)处理过的贵州B2F烟叶样品,加料之后劲头下降,杂气并未发生变化,但烟气浓度降低,舒适感增强,燃吸品质改善明显。
3 结论
本研究采用微生物发酵法结合生物酶法,以降低上部烟叶中的淀粉和蛋白质含量,提升其燃吸品质。首先筛选得到以上部烟叶粉末为液态发酵培养基底物可以产较高淀粉酶和蛋白酶酶活的菌株黑曲霉h5,并对接种量、培养基中烟叶添加量、培养基初始pH、发酵温度和时间等因素进行优化探索。将所得发酵液与生物酶配制成复合改良剂并作用于上部烟叶,结果显示,在含水量20%、发酵液添加量50%、复合酶添加量1 U/g、反应温度40℃、反应时间2 h的条件下,虽然淀粉和蛋白质降解率并不是最高,但是具有相对较好的感官评价。进一步对所用于发酵的烟叶底物进行比较发现,湖南B1F烟叶发酵液对上部烟叶燃吸品质的改善效果更为显著,并且在其他不同烟叶中均具有良好的改善效果。

