功能性黄酒提高机体免疫力研究
周建弟,张 蕾,钱 斌,蒋予箭*,邹慧君,李智慧,王 兰
(1.国家黄酒工程技术研究中心,浙江 绍兴 312000;2.浙江古越龙山绍兴酒股份有限公司,浙江 绍兴 312000;3.浙江工商大学 食品与生物技术学院,浙江 杭州 310012)
黄酒是中国特有的酿造酒,与啤酒、葡萄酒并称为世界三大发酵酒。黄酒发酵方式属于双边发酵且伴随着多种微生物共同发酵,特定的发酵工艺使黄酒具有独特的风味特征以及特定的功能性。随着生活水平的不断提高,消费者的需求目标已向健康保健转变,单纯的酒种已不能满足消费者的需要。研究表明[1-2],黄酒中吡嗪类、核苷类、黄酮类、萜烯类化合物等比较丰富,此外黄酒中游离氨基酸、功能性低聚糖、矿物质元素和多酚类物质含量要明显优于其他酒类。黄酒是富含功能性低聚糖的天然饮品,功能性低聚糖具有多种重要的生理功能,因此适量饮用黄酒能起到较好的保健作用[3]。黄酒中富含γ-氨基丁酸,具有提高记忆力、降血压、活化肝肾及防止动脉硬化等功能[4]。
功能性黄酒就是指在生产过程中添加功能因子后制成的一类黄酒,对人体有一定的保健功能[5]。杨祖滔[6]研究表明,薏米茯苓黄酒中含有丰富的功能性成分,具有较强的抗氧化能力。此外,红曲黄酒[7]、桑葚黄酒[8]、牡蛎黄酒[9]等新型的功能性黄酒得以被开发,这些新型黄酒适量饮用能够改善机体免疫力。闫训友等[10]研究富含冬虫夏草发酵液中虫草素的功能性黄酒。赵贝等[11]研究阿魏药酒表明,抗肿瘤作用可能与其免疫调节和抗氧化作用有关。李鸿儒等[12]研究附子药酒表明,附子药酒虽有一定抗肿瘤作用,但同时对阻止肿瘤生长也有不利的方面。近年来富含中草药成分的黄酒也被开发出来,许多学者对黄芪甲苷和三七[13-14]、麦冬[15-16]、甘草[17]、五味子[18]等进行了大量研究,表明这些中草药对提高人体免疫力方面具有很大的作用。因此,功能性黄酒的开发具有很大的前景。
但是具有功能性的黄酒,其功能性表现尚不明确。因此本研究以低度传统半干绍兴黄酒为酒基,加入黄芪、麦冬、五味子、生晒参、甘草中药提取物,增加皂苷、多糖等功能性成分含量,通过建立不同的小鼠免疫抑制模型,对小鼠进行功能性黄酒的处理,以说明功能性黄酒对提高机体免疫力的作用,为开发新型的功能性黄酒提供参考。
1 材料与方法
1.1 材料与试剂
中药材(黄芪、五味子、生晒参、麦冬、甘草):杭州东仁堂医药零售十号大街店;清洁级美国癌症研究所(institute of cancer research,ICR)小鼠(体质量(20±2)g):浙江医学科学院动物中心;绍兴黄酒(酒精度15%vol):浙江古越龙山绍兴酒股份有限公司;环磷酰胺:上海生工生物工程股份有限公司;酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)试剂盒:上海邦奕生物科技有限公司;细胞裂解液:国家黄酒工程技术中心;磷酸缓冲液:国家黄酒工程技术中心。
1.2 仪器与设备
BW3200S电子天平:上海精密仪器仪表有限公司;5910R高速冷冻离心机:艾本德中国有限公司;BD FACSCalibur流式细胞仪:碧迪医疗器械(上海)有限公司;DFY-200C小型粉碎机:上海利闻科学仪器有限公司;FE30 pH计:瑞士梅特勒-托利多集团。
1.3 实验方法
1.3.1 功能性黄酒制作
将实验用中药材在40℃烘干至恒质量,将其粉碎至40目大小均匀颗粒。称取黄芪20 g、五味子4 g、生晒参20 g、麦冬8 g、甘草8 g,将药材以1∶1.5(g∶mL)的料液比,利用体积分数为75%的乙醇在37℃条件下浸提12 h,并在70℃的条件下回流5h,经过滤、在温度50℃条件下进行真空浓缩,用绍兴黄酒作为酒基,用浸提液勾兑成8度的功能性黄酒,测定功效成分含量,并进行试验。
1.3.2 小鼠建模实验
将小鼠饲养在洁净的环境中,环境温度稳定在(22±2)℃,保持12 h的白天和夜晚循环饲养,经过1周的适应性饲养后进行相关的免疫学实验。取60只ICR小鼠,12只一组进行实验。
建模组和给药组小鼠进行环磷酰胺[19-20]建模处理,模型1:腹腔注射环磷酰胺,剂量80 mg/kg体质量,连续注射3 d,在试验的第11、12、13天,皮下注射环磷酰胺,剂量80 mg/kg体质量。在试验的第21、22、23天后再强化一次,即皮下注射环磷酰胺,剂量80 mg/kg体质量。模型2:腹腔注射环磷酰胺剂量40 mg/kg体质量连续7 d,停用环磷酰胺3 d,然后再用以同样的方法强化(即腹腔注射环磷酰胺剂量40 mg/kg体质量连续7 d,停用环磷酰胺3 d)。
给药实验,于环磷酰胺实验处理后分别于第9、10、11天和第19、20、21天后再强化一次。每周称质量一次,记录死亡情况。按体质量进行给药(功能性黄酒喂食),各组给药剂量为小鼠体质量×10 mL/kg,给药30 d。
1.3.3 分析检测
(1)小鼠体质量的测定
通过对不同实验组进行处理,每星期对小鼠进行称质量,记录试验数据。
(2)小鼠免疫器官的测定
末次给药24 h后,脊椎脱臼处死小鼠,及时取出小鼠的胸腺、脾脏、肾脏、肝脏,生理盐水冲洗后,用滤纸吸干水分,进行称质量,按下列公式计算胸腺指数、脾脏指数、肾脏指数、肝脏指数:

式中:I为胸腺指数/脾脏指数/肾脏指数/肝脏指数;W1为胸腺/脾脏/肾脏/肝脏质量,mg;W0为小鼠体质量,g。
(3)小鼠血浆中免疫球蛋白M含量测定
动物眼眶采血,放在非抗凝血试管中,室温静置2 h后,2 500 r/min离心10 min,取上清,测定免疫球蛋白M(immunoglobulin M,IgM)。采用ELISA法进行测定,具体操作均按照试剂盒说明书处理。
(4)小鼠血浆中T细胞分型的测定
动物眼眶采血,放在抗凝血试管中,按说明书处理后,流式细胞仪测定T淋巴细胞亚细胞群分化簇3(cluster of differentiation3,CD3)、分化簇 4(cluster of differentiation 4,CD4),分化簇 8(cluster ofdifferentiation8,CD8)。具体步骤如下:取500 μL血浆至细胞流式管,加入2 mL红细胞裂解液,静置10 min,然后加入磷酸盐缓冲液至流式管顶部,2 000 r/min离心10 min。弃去上清液,再次加入2 mL红细胞裂解液,静置10 min,然后加入磷酸盐缓冲液至流式管顶部,2 000 r/min离心10 min。看红细胞裂解程度,是否需要再次裂解。全程放在低温环境中操作。最后一次弃去上清液,沉淀加入100微升磷酸盐缓冲液,各加10 μLCD3、CD4、CD8鼠抗人荧光单克隆抗体,4℃避光放置30 min。然后加入磷酸缓冲液至流式管刻度稍微以下,2 000 r/min离心10 min。离心结束后,弃去上清液,再加入100 μL的磷酸缓冲液。通过荧光单克隆抗体对组织细胞内抗原进行定性、定量,在流式细胞仪上计数1×105个/kg以上细胞,分别记录T淋巴细胞(CD3+),辅助诱导T淋巴细胞(CD3+CD4+),抑制细胞毒T淋巴细胞(CD3+CD8+)以及T辅助细胞/T抑制细胞(CD4+/CD8+)表达的阳性率。
1.3.4 数据处理及分析
采用Origin 8.5软件、Excel和SPSS 17.0统计软件进行作图和差异显著性分析。所有的数据都以“平均值±标准偏差”表示,P<0.05时表示差异显著。
2 结果与分析
2.1 功能性黄酒成分
功能性黄酒是指以黄酒为基酒,通过添加特定中草药成分的萃取浓缩液而形成的一种新型黄酒,使其能够增强机体免疫力,改善人体亚健康,但不以治疗为目的[5]。黄芪、麦冬、甘草、生晒参、五味子均记载于《中国药典》[21],且允许用于保健食品。通过《中国药典》推荐摄入量查询以及问询中医,确定了功能性黄酒的基本配方见表1。

表1 人体推荐摄入量和功能性黄酒配方Table1 Recommended intake and functionalHuangjiuformula
依据表1功能性黄酒配方,对该功能性黄酒中的功效成分进行检测,通过已有的检测方法[22-25],进行总皂苷、总多糖、总多酚、总黄酮的含量测定,结果见表2。
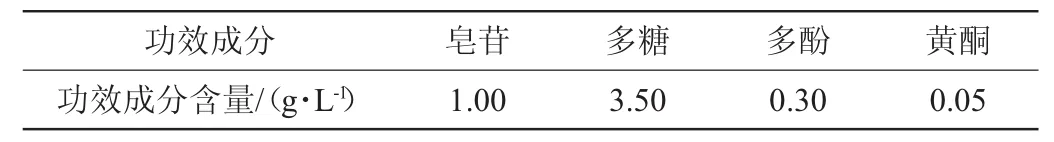
表2 功能性黄酒中功效成分含量Table2 Content of functional components in functionalHuangjiu
由表2可知,功能性黄酒中含有皂苷、多糖、多酚及黄酮等功效成分。
2.2 小鼠建模结果
通过环磷酰胺作为免疫抑制剂建立免疫抑制模型的实验方法,对小鼠进行建模处理,建立不同的免疫抑制模型以验证不同处理组的免疫提升效果,建模结果见表3。

表3 小鼠建模及处理方法Table3 Modeling and treatment methods of mice
由表3可知,空白对照组:8度空白黄酒;模型组1:在造模基础上,喂食8度空白黄酒;模型组2:在造模基础上,喂食8度空白黄酒;给药组1(模型组1+药物):在造模基础上,喂食药酒。药酒酒精度8度,生药量0.91 g/mL;给药组2(模型组1+药物):在建模基础上,喂食药酒。药酒酒精度8度,生药量0.91 g/mL。
2.3 不同造模模型对小鼠体质量的影响
小鼠体质量变化是小鼠免疫力的最直观的体现。实验30 d后,对实验小鼠进行称质量,每周小鼠的体质量变化见表4。
由表4可知,从第二周开始造模组小鼠的体质量均低于空白组小鼠体质量,存在显著性差异(P<0.05),说明通过环磷酰胺处理,小鼠的免疫功能遭到抑制,实验建模成功。对比给药1组和给药2组可知,在给药1组的条件下,免疫恢复效果要好于给药2组。且给药2组与模型组相比,体质量反而减少,可能是由于模型2组造模程度太深,这与宋雁等[19]研究结果相似。
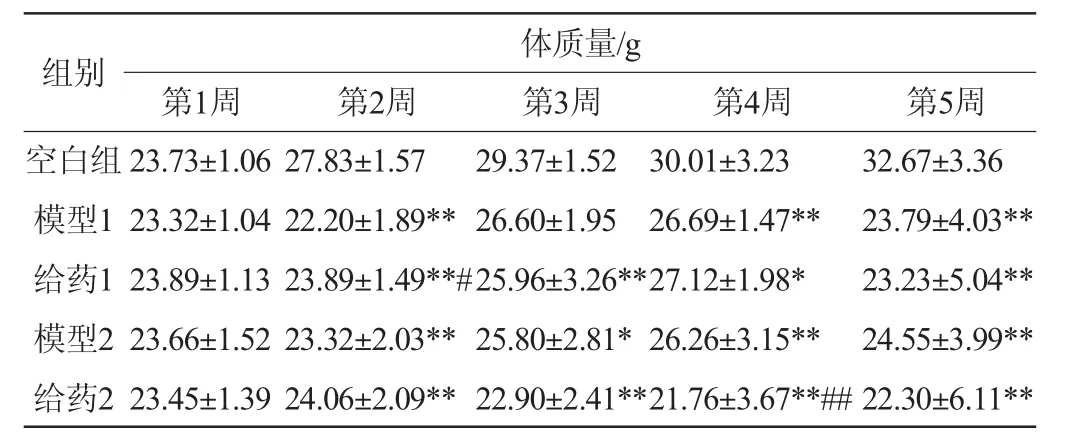
表4 不同建模模型对小鼠体质量的影响Table4 Effects of different modeling models on body mass of mice
2.4 不同建模模型对小鼠免疫器官指数的影响
胸腺指数和脾脏指数是与免疫相关的主要脏器指数[26-27]。实验30 d后,对小鼠进行解剖,取下小鼠的脾脏、胸腺、肝脏和肾脏进行称质量,结果分别见图1和图2。
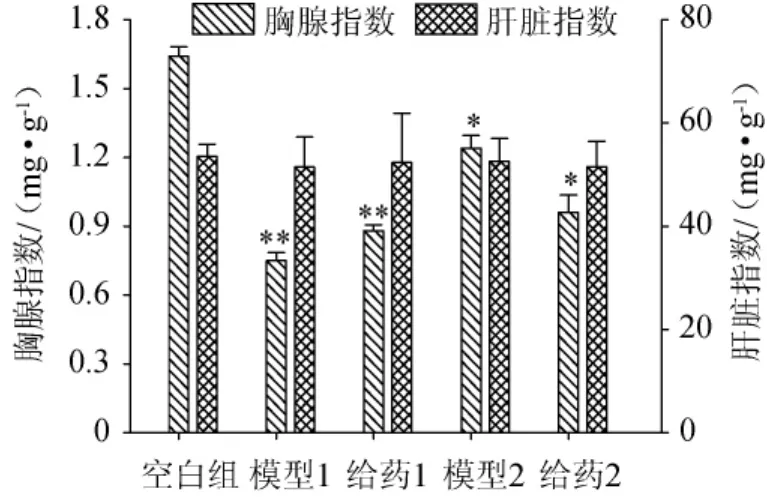
图1 不同建模模型对小鼠胸腺和肝脏指数的影响Fig.1 Effects of different modeling models on thymus and liver indexes of mice
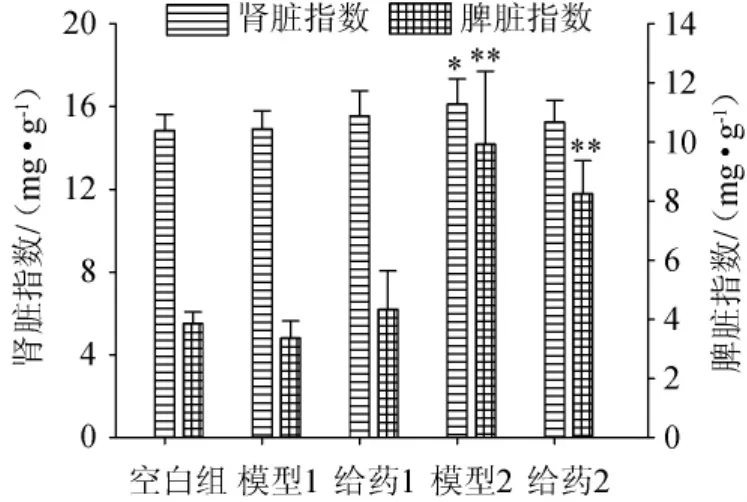
图2 不同建模模型对小鼠肾脏与脾脏指数的影响Fig.2 Effects of different modeling models on kidney and spleen indexes of mice
由图1和图2可知,模型1组和给药1组的胸腺指数与空白组相比,分别降低了54.27%和46.34%,并且存在显著性差异(P<0.05);模型2组和给药2组的脾脏指数和胸腺指数与空白组相比,脾脏指数分别增加了157.25%和113.99%,胸腺指数分别降低了24.34%和41.46%,并且存在显著性差异(P<0.05)。给药1组和模型1组相比,给药组的脾脏指数和胸腺指数分别增加了28.78%和17.33%,说明给药组较模型组对小鼠的免疫器官有改善作用,且趋势靠近空白组;给药2组和模型2组相比,给药组的脾脏指数和胸腺指数无显著性变化(P>0.05),但是都有一定程度的降低,分别降低了17.17%和25.01%,并且趋势远离空白组。造模组的肝脏指数和肾脏指数与空白组相比,无明显变化(P>0.05)。综上结果表明,在模型1的基础上,给药组对小鼠的免疫器官具有一定的改善作用;在模型2的基础上,给药组对小鼠的免疫器官无改善作用。这说明小鼠的免疫机制破坏程度加大,给药组已失去提高免疫力的作用。
2.5 不同建模模型对小鼠血浆中免疫球蛋白M含量的影响
免疫球蛋白M(IgM)主要分布在血液中,在机体免疫反应中出现最早,具有强大的抗感染作用。不同造模模型对小鼠血浆中IgM含量测定结果见图3。

图3 不同建模模型对小鼠血浆中免疫球蛋白的影响Fig.3 Effects of different modeling models on immunoglobulin in mice plasma
由图3可知,造模组与空白组相比,小鼠血浆中免疫球蛋白M含量分别降低了50.37%、38.21%、162.90%、和69.25%,并且存在显著性差异(P<0.05)。给药1组的IgM含量与模型1组相比,增加了24.49%,说明给药组较模型组对小鼠的免疫器官有改善作用,且趋势靠近空白组;给药2组的I gM含量与模型2组相比,减少了19.16%,不存在显著性差异(P>0.05)。综上所述,在模型1的基础上,给药组对小鼠产IgM具有一定的调节作用;在模型2的基础上,给药组对小鼠产IgM无明显调节作用。
2.6 不同造模模型对小鼠血浆中T细胞分型的影响
通过实验分别对T淋巴细胞(CD3+),辅助诱导T淋巴细胞(CD3+CD4+),抑制细胞毒T淋巴细胞(CD3+CD8+)以及T辅助细胞/T抑制细胞(CD4+/CD8+)进行测定,不同造模模型对小鼠血浆中T细胞分型的影响结果分别见图4和图5。
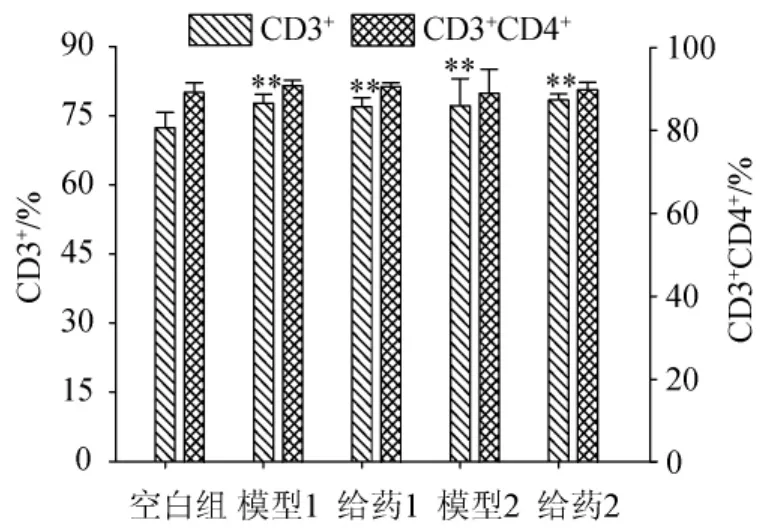
图4 不同造模模型对小鼠血浆中T细胞分型(CD3+、CD3+CD4+)的影响Fig.4 Effect of different modeling models on T cell typing(CD3+、CD3+CD4+)in mice plasma
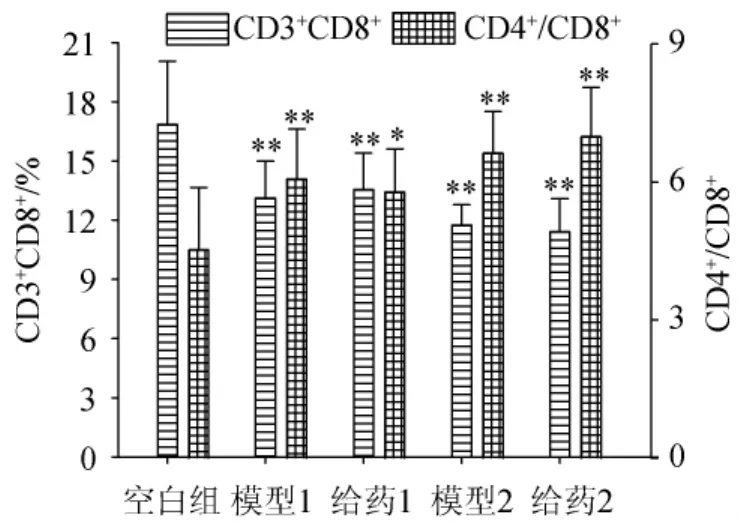
图5 不同造模模型对小鼠血浆中T细胞分型(CD3+CD8+、CD4+/CD8+)的影响Fig.5 Effect of different modeling models on T cell typing(CD3+CD8+、CD4+/CD8+)in mice plasma
由图4可知,与空白组相比,模型1组、给药1组、模型2组、给药2组的CD3+CD4+含量分别增加了7.45%、6.44%、6.72%和8.46%,并且存在极显著性差异(P<0.01)。由图5可知,与空白组相比,模型1组、给药1组、模型2组、给药2组的CD3+CD8+含量分别降低了22.08%、19.53%、30.27%和32.23%,并且存在极显著性差异(P<0.01);与空白组相比,模型1组、给药1组、模型2组、给药2组的CD4+/CD8+比值分别增加了34.07%、27.88%、46.46%和54.42%,并且存在极显著性差异(P<0.01)。给药1组的CD3+含量、CD3+CD4+含量、CD3+CD8+含量、CD4+/CD8+比值与模型1组相比,分别降低了0.94%,增加了3.27%,降低了4.62%,虽然都不存在显著性差异(P>0.05),但是给药组数据更接近空白组;给药2组的CD3+含量、CD3+CD4+含量、CD3+CD8+含量、CD4+/CD8+比值与模型2组相比,分别增加了1.63%,减少了2.81%,增加了5.44%,但是都不存在显著性差异(P>0.05)。
结果表明,在模型1的基础上,给药组对小鼠血浆中T细胞分型含量具有一定的调节作用;在模型2的基础上,给药组对小鼠血浆中T细胞分型含量没有明显的调节作用。
3 结论
通过动物实验的体质量、免疫器官指数、血浆中免疫球蛋白M、血浆中T细胞分型等指标对小鼠建模模型进行验证。与空白组相比,两个模型组小鼠的体质量、免疫器官指数、免疫球蛋白M、血浆中T细胞含量都有显著性的变化,说明本试验的两个建模成功。给药1组与模型1组相比,免疫器官指数增加,IgM含量增加,CD4+/CD8+比值降低,且给药组的数据较模型组更接近于空白组,说明给药组对小鼠免疫具有一定的调节作用;给药2组与模型2组相比,体质量降低,免疫器官指数降低,IgM含量降低,CD4+/CD8+比值增加,说明造模程度深,小鼠的免疫调节能力破坏大,无法恢复。但是通过给药1组和模型1组的数据对比,可以验证得到该配方具有调节免疫力的功能。综上,本研究免疫功能调节验证试验探索出了较优造模模型,即模型组1。并且由模型组1的建模试验结果证明,功能性黄酒具有提高机体免疫力的功能。

