羧甲基改性玉米芯的制备及其Cu2+吸附性能研究
陈燕敏,黄顺江,邢玮玮
(1.郑州师范学院 化学化工学院,河南 郑州 450044;2.郑州工商学院 公共基础教学部,河南 郑州 451400)
近年来,随着城市化、工业化的高速发展,全球水质遭到严重污染。铜离子作为一种重金属水体污染物是不可忽视的,当铜浓度>60g/L时会抑制藻类的光合作用,人体中铜含量超过200 mg会对肝脏造成损害。如何有效地处理含铜废水已成为人类迫切需要解决的问题[1-2]。
传统的废水处理方法主要有离子交换法、萃取、沉淀、活性炭吸附、超滤、反渗透、电渗析等方法[3]。这些传统方法通常有一定的局限性,如处理效率低、运行条件苛刻、经济成本高、难再生利用等。吸附法具有材料来源广,去除能力较强,可有效达到排放标准,成为前景广阔的废水处理方法[4-7]。活性炭是应用较广泛的吸附剂,但其价格偏高,为了降低成本,找到了一种价廉、量大且可再生的玉米芯作为铜离子吸附剂,并对玉米芯进一步羧甲基化改性,得到了铜去除率很高的一种吸附剂材料。
1 实验部分
1.1 材料与仪器
氢氧化钠、氯乙酸钠、三水合二乙基二硫代氨基甲酸钠、硫酸铜、氨水、氯化铵、四氯化碳、浓盐酸、氯化钠、乙醇等均为分析纯;玉米芯,来源于本地农场;实验用水为去离子水。
JSM-7500F冷场发射扫描电子显微镜(SEM);NEXUS-470傅里叶红外光谱仪(FTIR);UV2550型紫外可见分光光度计;JG-FS200L粉碎机;DZF-6050真空干燥箱;524G磁力恒温搅拌器;pHS-3D酸度计。
1.2 改性玉米芯的制备
将玉米芯粉碎,过40目筛,用自来水清洗除去表面泥沙,用去离子水清洗3次,80 ℃烘干。取10 g烘干的玉米芯,分散于200 mL 85%乙醇中,加入氢氧化钠7 g,氯乙酸钠14 g,加热至50~70 ℃,反应5 h。过滤,用去离子水洗涤至中性,80 ℃烘干,得到羧甲基改性玉米芯。
1.3 性能表征
采用冷场发射扫描电子显微镜(SEM)观察样品的整体形貌,工作电压15 kV;采用傅里叶红外光谱仪(FTIR)测定样品的红外光谱,分析样品所带官能团;利用紫外可见分光光度计扫描样品的吸收光谱,Cu2+吸收峰位于440 nm。
1.4 吸附实验
用配制的CuSO4溶液模拟含铜废水,检测玉米芯(YMX)和羧甲基改性玉米芯(CM-YMX)的吸附性能。CuSO4水溶液pH值为5.0,将一定量吸附剂加入到50 mL的CuSO4水溶液中,于室温下搅拌一定时间,每30 min取上层清液,过0.45m滤膜后测定Cu2+浓度。
1.5 铜离子浓度的测定
Cu2+浓度采用二乙基二硫代氨基甲酸钠分光光度法来测定[8]。以CCl4为参比,测试出不同Cu2+含量(x轴)在440 nm处的吸光度(y轴),进而得到了铜离子吸收的标准曲线图(图1),该标准曲线方程为:y=0.016 6x+0.008 5,R2=0.981 1。

图1 Cu2+标准曲线Fig.1 Standard absorption curve of Cu2+
由图1可知,Cu2+含量在0~30g范围时,与440 nm处的吸光度具有良好的线性关系。
Cu2+浓度可从标准吸收曲线得到(式1):
(1)
式中c——水样中Cu2+浓度,mg/L;
A、A0——分别为样品和空白实验的吸光度;
a——标准曲线方程的截距(吸光度);
V——萃取时用的试样体积,mL。
Cu2+去除率ρ(%)和吸附量由式(2)和式(3)计算:
(2)
(3)
式中c0——吸附试验前水样中Cu2+浓度,mg/L;
c——吸附后水样中Cu2+浓度,mg/L;
V——溶液体积,L;
m——吸附剂质量,mg。
2 结果与讨论
2.1 结构与性能表征
SEM(图2)显示玉米芯(YMX)表面有着紧密的纤维素结构,改性后的羧甲基化玉米芯(CM-YMX)表面非常粗糙,增加了很多孔隙和通道,这就使得改性后的CM-YMX比表面积增大,有利于吸附位点与溶液中Cu2+的接触。因此,CM-YMX对Cu2+的吸附效果更好。

图2 玉米芯(a)和羧甲基改性玉米芯(b)的SEM图Fig.2 SEM figures of corncobs(a) and carboxymethyl modified corncobs(b)


图3 玉米芯(a)和羧甲基改性玉米芯(b)的红外光谱图Fig.3 FTIR spectra of corncobs(a) and carboxymethyl modified corncobs(b)
2.2 玉米芯的Cu2+吸附性能
2.2.1 吸附时间的影响 在两份盛有50 mg/L的CuSO4水样中,分别加入0.3 g玉米芯(YMX)和0.3 g 羧甲基化玉米芯(CM-YMX),在搅拌下进行吸附实验。检测吸附时间为0.5,1.5,2.5,3.5,4 h时的Cu2+浓度及其去除率(ρ),结果见图4。

图4 吸附时间对Cu2+离子去除率的影响Fig.4 The effect of adsorption time on Cu2+ adsorption rate
由图4可知,吸附时间增加,Cu2+去除率升高,2.5 h时达到最大值33%(YMX)和98%(CM-YMX),羧甲基改性后的玉米芯对Cu2+的吸附效果明显优于改性前的玉米芯;2.5~4 h内,YMX和CM-YMX对Cu2+的去除率趋于稳定。说明羧甲基改性后的玉米芯对水中Cu2+的吸附效果非常好,可以有效地处理低浓度的含铜废水,吸附时间仅需2.5 h。因此,吸附时间选择2.5 h。
2.2.2 吸附剂用量的影响 向3份盛有50 mg/L的CuSO4水样中分别加入0.1,0.3,0.5 g YMX和CM-YMX,搅拌吸附2.5 h后进行检测,结果见图5。
由图5可知,0.1 g投加量下,YMX对Cu2+的去除率为33%,而CM-YMX达到了90%;增大投加量到0.3,0.5 g时YMX去除率基本没变,说明已经达到了吸附饱和状态,CM-YMX去除率上升到了98%和97%。故吸附剂投加量选取0.3 g。
2.2.3 初始CuSO4浓度的影响 将0.3 g CM-YMX分别加入初始浓度50,100,150 mg/L的CuSO4水样中,YMX同理,搅拌2.5 h后检测Cu2+浓度,结果见图6。
由图6可知,Cu2+的去除率随着水样中CuSO4浓度的增大有降低趋势,这是因为相同量的吸附剂中吸附位点是等量的,即达到吸附饱和后吸附的Cu2+大致相当,当初始浓度较大时,去除率就会减小[12]。

图6 初始CuSO4浓度对Cu2+去除率的影响Fig.6 The effect of initial CuSO4 concentrations on Cu2+ adsorption rate
2.2.4 离子强度的影响 水样离子强度对Cu2+去除率的影响见图7。
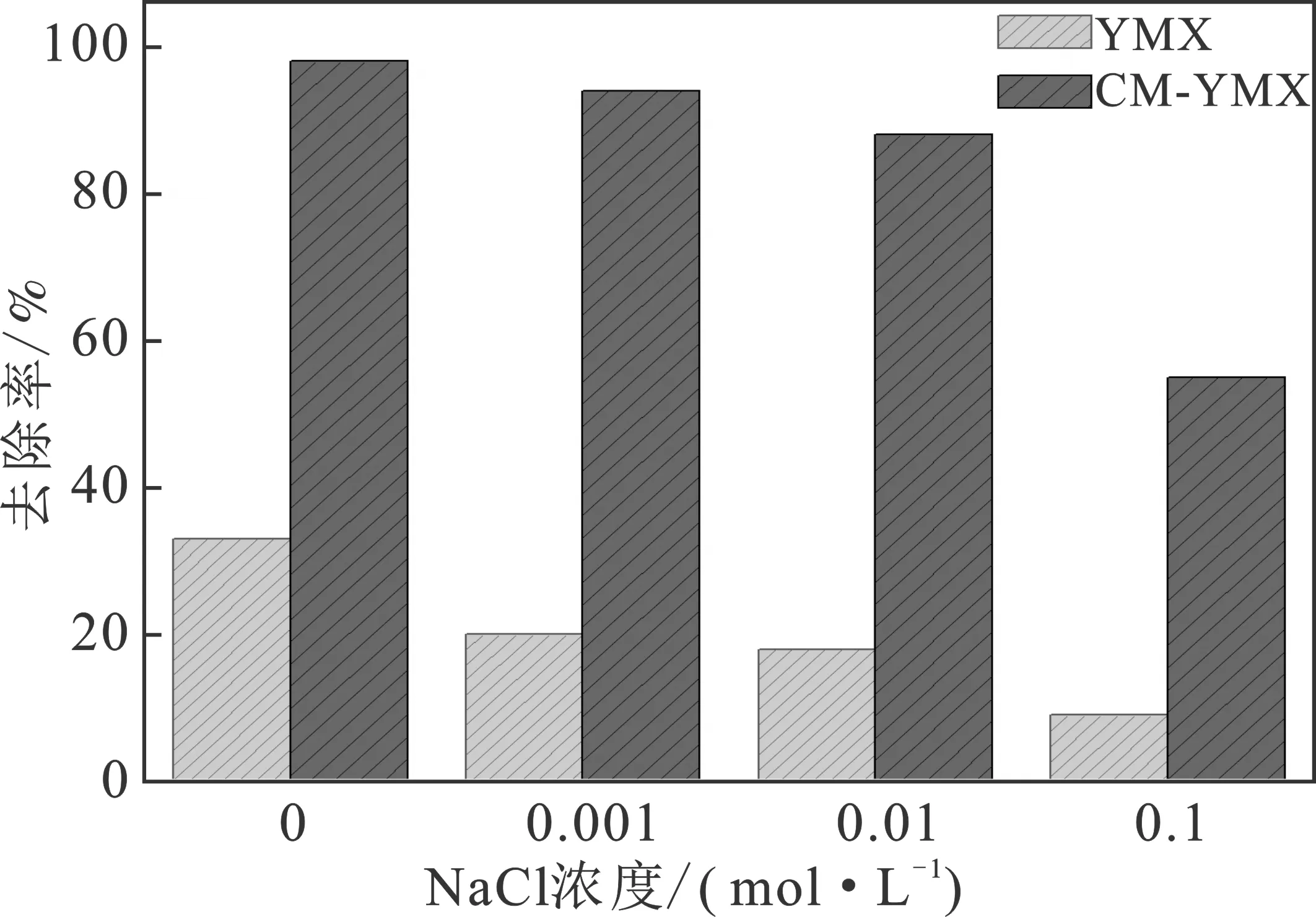
图7 水样离子强度对Cu2+去除率的影响Fig.7 The effect of ionic strength on Cu2+ adsorption rate
由图7可知,随着离子强度的增大(cNaCl=0~0.1 mol/L),Cu2+的去除率降低。这是由于NaCl浓度增加后,溶液中钠离子含量随之变大,不仅会与铜离子竞争玉米芯表面的活性吸附点,还对铜离子与玉米芯表面的静电引力作用造成一定影响,使得玉米芯对Cu2+的吸附性能变差。另外,表面化学理论指出,当溶液中存在电解质时,Cu2+必须通过电扩散双层才能到达玉米芯表面,而该扩散双层的厚度与电解质的浓度即离子强度成正比,离子强度越大,其厚度越大,从而会抑制玉米芯和Cu2+的接近[13]。
2.2.5 pH值的影响 通常情况下,含铜水样的pH处于中性、碱性条件时,向生成Cu(OH)2沉淀的方向移动,这样就会影响吸附过程的顺利进行,并对吸附剂的吸附效果判断造成干扰。通过酸度计测得CuSO4溶液的pH值为5.3,本实验选择的pH范围为2~5,结果见图8。
由图8可知,在pH值为2~5时,对Cu2+的去除率随着pH值的升高而升高,这主要归因于玉米芯表面的羟基吸附活性位点。当pH处于较低值时,溶液中的H+含量很大,会与Cu2+争夺玉米芯表面的活性吸附位点,使得部分吸附位点被H+所占据;与此同时,玉米芯表面的羟基也会与H+发生质子化反应,导致其对Cu2+的吸附效果更差。基于以上两方面原因,在pH值较小时,玉米芯对Cu2+的去除率明显偏低。但是,随着水样pH值的逐渐升高,溶液中H+的含量呈指数级下降,这样可以吸附Cu2+的活性位点大幅度增加,pH=5时,改性后的CM-YMX对Cu2+的去除率达到98%。

图8 水样pH值对Cu2+去除率的影响Fig.8 The effect of pH values on Cu2+ adsorption rate
2.3 吸附动力学特性
分别采用准一级动力学方程(式4)和准二级动力学方程(式5)对数据进行拟合[14],结果见图9。


图9 玉米芯和羧甲基改性玉米芯的吸附动力学模型Fig.9 Adsorption kinetic model of YMX and CM-YMX
ln(Qe-Qt)=lnQe-k1t
(4)
(5)
式中Qt和Qe——t时刻和平衡时的吸附量,mg/g;
k1——一级吸附速率常数,h-1;
k2——二级吸附速率常数,g/(mg·h)。
由图9可知,YMX在吸附Cu2+(50 mg/L)的过程中,无论是按照准一级动力学模型还是准二级动力学模型,均可以进行较好的拟合。对于CM-YMX来说,吸附铜离子的过程只符合准二级动力学模型,R2为0.999 5。文献指出[7,12],准一级动力学模型描述的是物理吸附过程,准二级动力学模型则适用于化学吸附过程,后者主要是由于吸附剂和被吸附离子之间存在电子共用或电子转移。由此可以推测出,YMX对Cu2+的吸附兼具物理和化学两种吸附过程,而CM-YMX对Cu2+的吸附主要是化学吸附过程,这源于羧甲基改性后的玉米芯中羧基与Cu2+之间的螯合反应。
3 结论
(1)玉米芯改性后,由原来的典型纤维素结构变成了表面粗糙,且多空隙和通道的形貌,羧基被成功引入到玉米芯上。
(2)浓度50 mg/L的CuSO4水溶液,0.3 g羧甲基化玉米芯对Cu2+的吸附效果最优,在2.5 h后达到吸附饱和,吸附率为98%;随着溶液离子强度的增大(0~0.1 mol/L),吸附率逐渐下降,而pH值变大(2~5)后,吸附率呈现上升趋势,这主要是因为在高离子强度和低pH值下,Cu2+进入吸附剂的吸附位点时会受到溶液中Na+和H+的竞争吸附干扰。
(3)羧甲基改性玉米芯吸附Cu2+的过程符合准二级动力学模型,为化学吸附过程。

