非对称流场流分离-超高效液相色谱-串联四极杆飞行时间质谱用于过敏原蛋白表位筛选
李 阳, 杨 奕, 邵 兵, 邹 悦, 宋 宇, 舒 琳, 梁启慧, 韩南银*
(1. 北京大学药学院, 北京 100191; 2. 北京市疾病预防控制中心, 北京 100013)
场流分离(field flow fractionation, FFF)技术是近年来新兴发展的一种分离分析方法,主要应用于大分子,因其具有温和、广谱的分离特性,同时分离过程不会改变被分析物的结构形态和生物活性,尤其适合生物大分子的分析应用,从而引起越来越多的关注[1-4]。非对称流场流分析(asymmetrical flow field flow fractionation, AF4)是场流技术中应用最广泛的一个分支,也是目前可信赖的纳米颗粒分离和表征的方法。AF4类似于液相色谱,区别在于其没有固定相,仅由通道流(channel flow)和垂直于通道的交叉流(cross flow)组成。AF4的分离在如图1所示的领带形的可渗透超滤膜(截留相对分子质量通常为10或30 kDa)通道中进行[5]。在分离的过程中,载液在通道中的层流作用下在通道的横截剖面上形成抛物线形轮廓,向前移动。离上下壁越近的载液移动速度越慢,越靠近通道中心的载液移动速度越快。与此同时,被分析物在cross flow的带动下,向着下方的积累壁移动。被分析物由于自身的扩散作用产生一个和cross flow方向相反的力,使颗粒偏向于抛物线的中心即流速最快的点。颗粒的大小及尺寸不同,所产生的扩散力不同。颗粒越小,扩散作用越明显,越靠近抛物线中心。根据颗粒的流体动力学性质在AF4通道中产生流速分级,小粒越靠近中心位置,相较于大颗粒更快地被洗脱[6,7]。
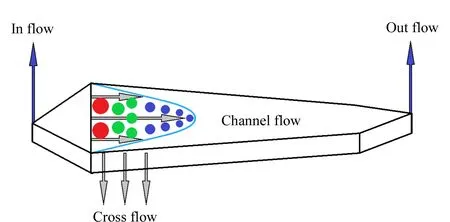
图 1 AF4分离通道Fig. 1 Separate channel of the asymmetrical flow field flow fractionation (AF4)
食物过敏通常是由食物中的蛋白质引起的,这种蛋白质称为过敏原蛋白。而过敏原蛋白参与过敏反应的往往只有氨基酸序列中的一小段抗原决定簇(数个至数十个氨基酸),又被称为“表位”[8]。传统的表位研究方法有酶解技术、肽扫描技术等,20世纪90年代发展起来的质谱技术是目前表位定位应用较多的一种方法[9-11]。表位预测主要是采用生物信息学方法,不管是酶解法、构建噬菌体展示文库筛选法以及生物信息学预测方法等,这些方法大都需要预先设计肽段的氨基酸序列然后进行合成,之后再将这些合成的肽段与免疫球蛋白E(IgE)进行结合,测定活性以筛选表位,其针对性差,繁琐,效率低下[11]。
虾蟹等甲壳类动物是联合国粮农组织提出的八大类过敏食物中重要的一类。研究发现,虾的主要过敏原是一种相对分子质量约为32 kDa的酸性糖蛋白----原肌球蛋白(TM), TM的等电点在4.5左右,其氨基酸组成中没有色氨酸,酪氨酸和苯丙氨酸的含量也较少[12,13]。虽然虾原肌球蛋白的结构比较清楚,但是其引起食物过敏的表位研究还较少,1993年Shanti等[14]第一次利用过敏患者和对照者血清发现了两个过敏原表位,分别为第50-66位和第153-161位的氨基酸残基。为了进一步研究虾过敏原蛋白的空间表位,Ayuso等[15,16]利用36段有重复序列的多肽,用18位虾过敏患者血清进行检测时,发现了5个肽段具有IgE结合活性。
非对称流场流分离技术已经成功应用于多种蛋白质的分析,但对过敏原蛋白的分析研究较少[17-19]。受到Schachermeyer等[20,21]运用AF4对IgE和适配体等结合检测的启发,拟引入AF4和UPLC-QTOF-MS联用建立过敏原蛋白表位的快速筛选方法。本实验使用非对称流场流分离技术将选择的过敏原蛋白虾TM的酶解肽段与IgE孵育后的免疫复合物分离,收集AF4流出的组分,经浓缩后进行UPLC-QTOF-MS检测,匹配已经建立的过敏原蛋白肽谱,寻找过敏原蛋白的抗原表位,实验流程见图2。此方法可以反映过敏原蛋白和IgE在体外的结合情况,为过敏原蛋白表位筛选提供了一种新方法策略,同时扩展了非对称流场流技术的应用。
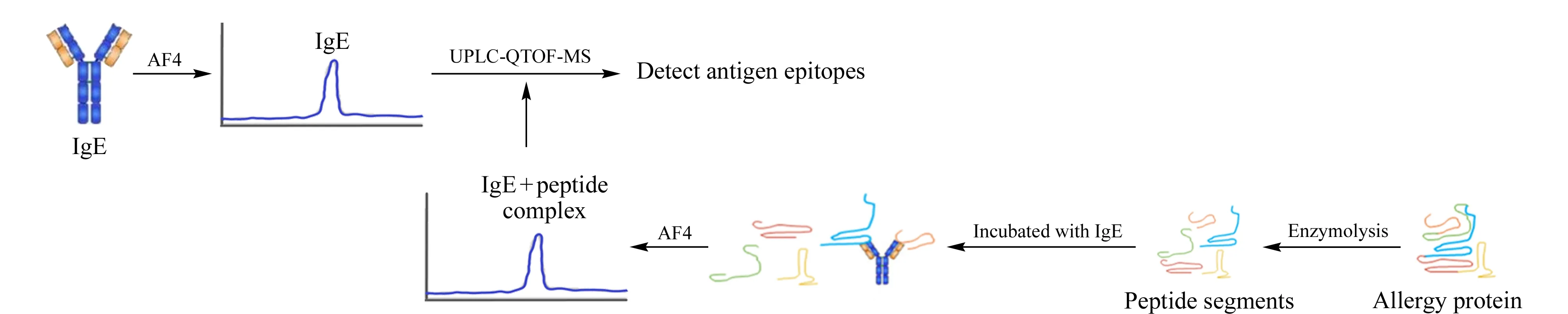
图 2 实验流程Fig. 2 Experimental processesIgE: immunoglobulin E.
1 实验部分
1.1 仪器、材料与试剂
Eclipse AF4非对称流场流分离仪购自美国怀亚特(Wyatt)公司;Agilent 1200系列四元泵、脱气装置、自动进样器和UV/Vis检测器(美国安捷伦公司);超高效液相色谱(ACQUITY UPLC)-离子淌度飞行时间质谱仪(Vion IMS QTOF)、ACQUITY UPLC®BEH300 C4色谱柱(100 mm×2.1 mm, 1.7 μm)均购自美国Waters公司。电子分析天平(BS 210S,德国Sartorius公司),空气浴振荡器(HZQ-C,常州朗越公司),微型冷冻离心机(5418R, Eppendorf公司),超滤离心管(Amicon Ultra-5, 10 kDa),再生纤维素膜(RC膜,截留相对分子质量30 kDa)购自Wyatt公司;水系聚醚砜微孔滤膜(0.2 μm)购自津腾公司。
虾TM标准溶液(1 mg/mL)购自美国Indoor公司,人IgE标准溶液(1 mg/mL)购自美国Abcam公司,磷酸缓冲盐溶液(phosphate buffer saline, PBS)、二硫苏糖醇(DTT,纯度99%)、乙酸钠(3 mol/L)购自碧云天,RapiGest SF表面活性剂购自美国Waters公司,乙腈(含 0.1%(v/v)甲酸,LC-MS 级)、胰蛋白酶(蛋白组学级)、盐酸(质量分数36%~38%)、碘乙酰胺(IAA,纯度98%)、甲酸(纯度99%)、碳酸氢铵(纯度99%)、三氟乙酸(纯度99%)购自美国Fisher Scientific 公司,NaCl、MgCl2、KCl、K2HPO4、Na2HPO4512H2O、NaH2PO452H2O、NaOH、磷酸、NaN3均为分析纯,购自美国Fisher Scientific公司。试验用水由Milli-Q Plus水净化系统制备(电阻率18.2 MΩ·cm)。
碳酸氢铵溶液(0.05 mol/L):准确称取碳酸氢铵0.395 0 g,置于100 mL容量瓶中用超纯水溶解并定容至100 mL。碳酸氢铵溶液(0.05 mol/L,含0.1% RapiGest SF):准确称取1 mg RapiGest SF试剂加入到1 mL碳酸氢铵溶液(0.05 mol/L)中,充分溶解。碘乙酰胺溶液(1 mol/L):准确称取碘乙酰胺1.85 g于10 mL棕色容量瓶中,用超纯水溶解并定容至10 mL,于2~8 ℃避光保存。胰蛋白酶溶液(1 mg/mL): 将20 μg胰蛋白酶固体加入20 μL盐酸(0.001 mol/L)中充分溶解,-80 ℃保存。DTT溶液(1 mol/L): 将3.09 g DTT加入20 mL 乙酸钠溶液(0.01 mol/L)充分溶解,过滤除菌后于-20 ℃保存。
1.2 过敏原蛋白酶解
取50 μL TM标准溶液于1.5 mL离心管中,加入50 μL碳酸氢铵溶液(0.05 mol/L,含0.1% RapiGest SF),混匀后加入0.5 μL DTT (1 mol/L)溶液,在95 ℃下孵育10 min,冷却至室温后加入1.5 μL IAA(1 mol/L),室温避光放置45 min后加入1 μL胰蛋白酶液(1 mg/mL), 37 ℃振摇酶解12 h。加入0.5 μL三氟乙酸,37 ℃下振摇30 min后以14 000 r/min离心10 min,取上清液待分析。
1.3 体外结合实验
将TM标准溶液和IgE标准溶液等体积混合,孵育30 min进行体外结合实验,孵育后的溶液进行AF4分析。将TM标准溶液按照1.2节的酶解条件进行酶解,进行TM水解肽段与IgE的体外结合实验,用于研究TM的抗原表位。具体操作如下:将酶解肽段与IgE标准溶液等体积混合,孵育30 min。孵育后的溶液进样AF4进行分析,在IgE的出峰时间收集流出的组分,并用10 kDa超滤管于4 ℃离心15 min,将收集到的流出组分进行浓缩,之后加入1 μL DTT(1 mol/L)用于UPLC-QTOF-MS分析。
1.4 分离条件
1.4.1AF4实验条件
AF4通道的几何参数:长度153 mm,最大宽度22 mm;使用350 μm垫片作为通道厚度,以截留相对分子质量30 kDa的再生纤维素膜作为积累壁膜,以PBS作为载液,使用前经过0.2 μm水系聚醚砜微孔滤膜过滤,现用现配。在进样前,载液先冲洗、平衡通道至少30 min,确保通道的洁净和实验的重复性。进样量:10 μL;紫外检测波长为215 nm。仪器操作和数据处理均使用安捷伦Open lab软件。AF4洗脱参数检测器流(detector flow)、聚焦流(focus flow)、进样流(inject flow)和cross flow设置见表1。
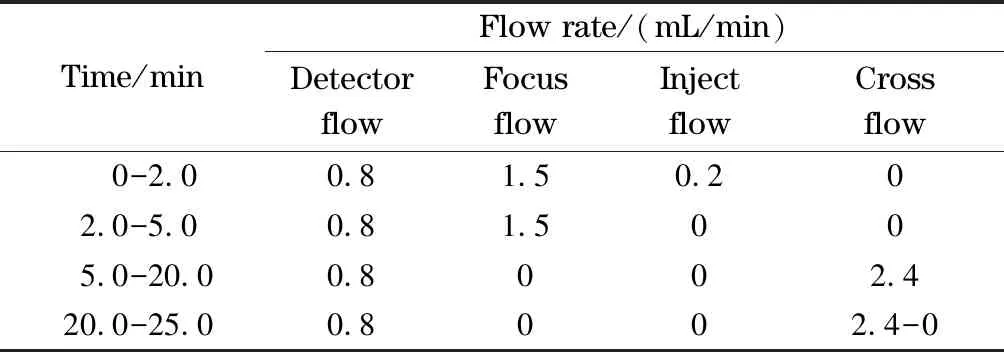
表 1 AF4洗脱条件Table 1 Elution conditions of AF4
1.4.2UPLC-QTOF-MS条件
色谱柱(100 mm×2.1 mm, 1.7 μm);色谱柱温度为80 ℃;进样体积为1 μL;流速为0.3 mL/min;流动相A: 0.1%(v/v)甲酸-水,流动相B: 0.1%(v/v)甲酸-乙腈,梯度洗脱条件:0~1 min, 98%A; 1~5 min, 98%A~50%A; 5~10 min, 50%A~5%A; 10~16.5 min, 5%A; 16.5~17 min, 5%A~98%A; 17~20 min 98%A.
电喷雾离子源(ESI+);离子源接口电压为3 kV;雾化气为氮气,流速为2.0 L/min;加热气为空气,流速为15 L/min;干燥气为氮气,流速为5 L/min;碰撞气为氩气;离子源接口温度为100 ℃;脱溶剂管温度为300 ℃;加热模块温度为250 ℃;扫描模式为多反应监测(MRM);延迟时间为3 ms。
2 结果与讨论
2.1 AF4分析方法的建立
2.1.1紫外检测波长的选择
通常蛋白质的紫外检测波长设定为280 nm, 280 nm波长下的紫外吸收主要来自于蛋白质样品中的酪氨酸和色氨酸[22],然而TM的氨基酸组成中没有色氨酸,酪氨酸的含量也较少[12],因此TM在280 nm下的紫外吸收较弱。215 nm是肽键的特征紫外吸收,更适合于小分子多肽和不含酪氨酸、色氨酸的相对分子质量较小的蛋白质[23]。实验中发现TM在215 nm下的吸收和峰形与280 nm相比均较优,因此最终设定紫外检测波长为215 nm。
2.1.2分离参数的优化
天然的过敏原蛋白粒径偏小,通常在100 nm以下,AF4实验洗脱参数中的cross flow值一般设定在3 mL/min才能保证过敏原蛋白紧贴积累壁,成功聚焦。cross flow和detector flow的比值会影响样品的保留时间,通常情况下,cross flow/detector flow值设定为3。TM是一种十分易于聚集的蛋白质,其在分析过程中可能发生聚集,detector flow值设置得越小,纵向的流速则越慢,则将会增加样品分子间的碰撞。focus flow值越高,聚焦的条带越窄,也可能增加分子间的碰撞,因此应设定适宜的focus flow和detector flow以减少蛋白质在分析过程中发生聚集。此外,载液条件如载液的种类、离子强度、pH等均会对过敏原蛋白质的理化性质产生影响。同时,实验中采用的再生纤维素膜的性质也会因载液的不同而不同。课题组前期的工作中对载液条件进行了系统的研究,本实验中载液条件的选择参考梁启慧等[24]的研究。综上,最终确定TM的AF4分离条件(见表1)。

图 3 TM标准溶液、IgE标准溶液及TM-IgE结合物的 AF4-UV流出图Fig. 3 AF4-UV fractograms of TM reference, IgE reference and TM-IgE complex
2.2 TM与IgE体外结合的AF4分析
将TM标准溶液与IgE标准溶液等体积混合后孵育30 min,反应液经AF4-UV分析检测,考察是否形成TM-IgE复合体,从而研究TM与IgE是否可以在体外发生特异性结合。
图3为虾TM标准溶液、IgE标准溶液、TM标准溶液与IgE标准溶液孵育液的AF4-UV流出图。TM的相对分子质量约为32 kDa, IgE的相对分子质量约为188 kDa,根据AF4的分离原理,相对分子质量小的物质会优先出峰,由于TM和IgE相对分子质量相差较大,理论上两者在AF4中应具有良好的分离度。然而,由于TM自身的聚集效应很强,在溶液中主要以聚集体的形式存在,其在溶液中的分子尺寸较大,导致TM与IgE的出峰时间十分相近,难以达到很好的分离效果。尽管TM与IgE在AF4中不能完全分离,但由图3可见保留时间约12 min的TM标准溶液和IgE标准溶液孵育液的出峰时间较TM标准溶液、IgE标准溶液略有延迟,表明孵育液的相对分子质量较TM和IgE均有增加,说明TM标准溶液与IgE标准溶液可以在体外孵育形成TM-IgE复合物。
2.3 TM抗原表位的AF4-UPLC-QTOF-MS分析
2.3.1TM的肽谱分析
图4为TM标准溶液的酶解指纹肽谱,肽谱分析采用UNIFI软件结合Uniprot数据库中TM的氨基酸序列数据,自动检索每一个酶解肽段的氨基酸序列。图4肽谱分析中下划线部分为本实验中实际检测到的肽段片段,计算得到TM标准溶液的水解肽段覆盖率为95%,说明TM在实验条件下基本水解完全,可以用于后续的酶解肽段与IgE的结合实验。
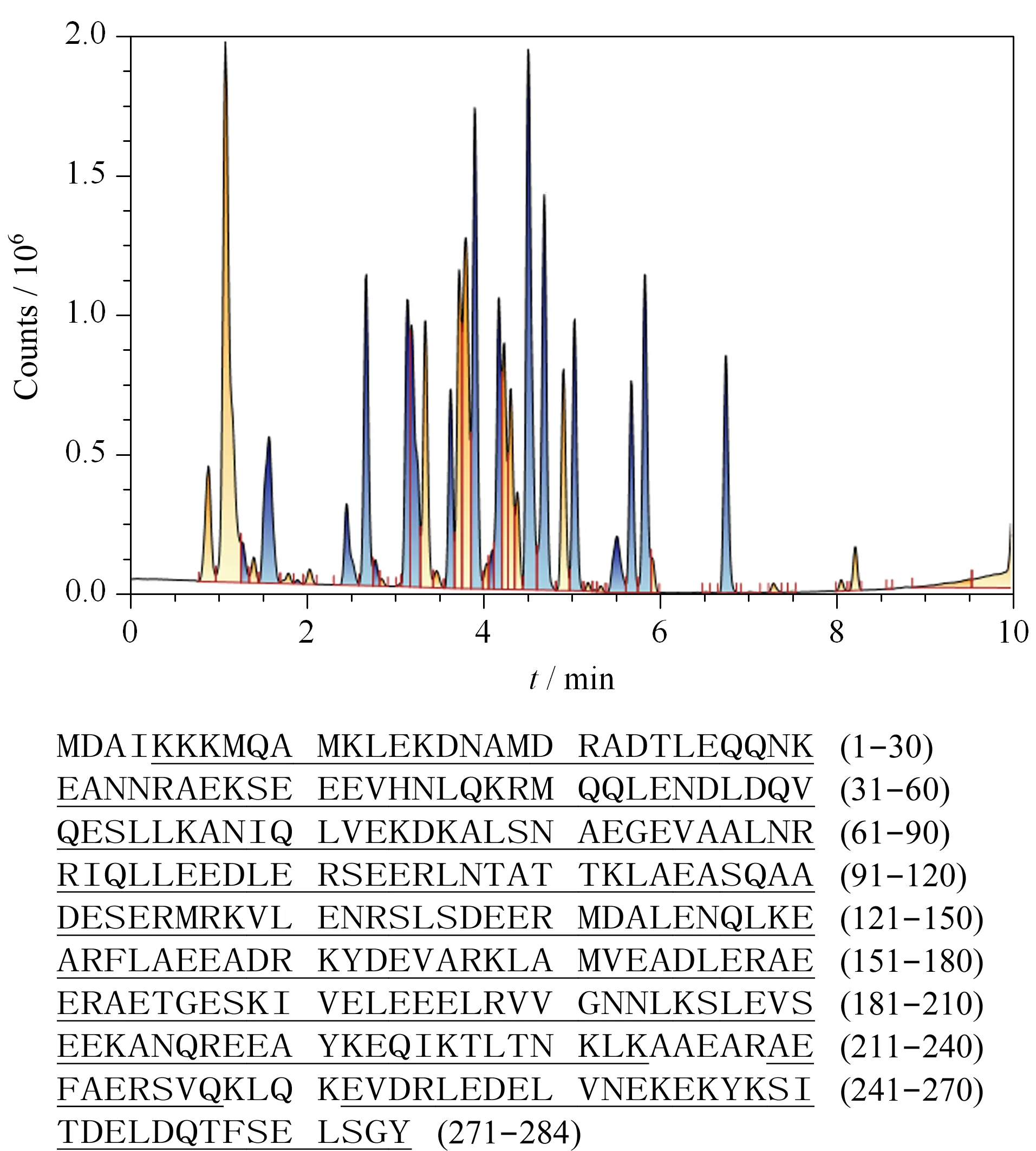
图 4 TM酶解指纹肽谱及肽谱分析(下划线部分为 检测到的片段)Fig. 4 Fingerprint peptide spectrum of TM and the analysis of peptide spectrum (The underscore parts are the detected fragments.)
2.3.2TM抗原表位分析
将TM酶解肽段与IgE标准溶液混合孵育30 min,孵育液浓缩后经UPLC-QTOF-MS分析,结果见图5。根据AF4的分离原理,只有相对分子质量大于30 kDa的化合物才能保留在分离通道内,随洗脱液一起流出到达检测器。而相对分子质量小于30 kDa的化合物则会在cross flow的作用下直接滤过再生纤维膜至废液,不能被检测器所检测到。本实验中,只有在孵育过程中与IgE标准溶液发生结合的肽段才能以肽段-IgE复合物的形式跟随洗脱液一起流出,而那些没有与IgE标准溶液结合的肽段在通过AF4时会直接流出到废液。因此,我们认为只有具有抗原表位活性的酶解肽段才能与IgE标准溶液结合形成肽段-IgE复合物,并以复合物的形式经AF4流出被收集。通常酶解肽段含5~20个氨基酸,其相对分子质量通常在500~2 000 Da之间。而IgE的相对分子质量约为188 kDa,因此酶解肽段与IgE标准溶液复合物的相对分子质量与IgE的相对分子质量相比相差不大,从而导致了肽段-IgE复合物在AF4中的保留行为与IgE标准溶液基本一致。

图 5 孵育后结合的TM肽段的UPLC-QTOF-MS色谱图Fig. 5 UPLC-QTOF-MS chromatogram of the binding TM peptides after incubation
实验发现,与TM标准溶液的酶解肽谱相比,TM酶解肽段与IgE标准溶液结合后可以检测到的肽段数量明显减少。经软件分析,共检测到12条肽段,这些肽段即是潜在的表位抗原,检测到的肽段信息在表2中详细列出。文献[25]采用生物信息学方法预测TM的抗原表位,认为TM的12-25、47-60、87-105、112-128、131-147、155-167、187-203、221-239、243-259、263-280氨基酸残基均是抗原表位。本研究共检测到12条可能是抗原表位的氨基酸残基,其中ADTLEQQNK(22-30)、IQLLEEDLER(92-101)、LAEASQAADESERMA(113-127)、EARFLAEEADR (150-160)、FLAEEADRK (153-161)、YDEVAR(162-167)、AETGESK(183-189)、IVELEEELR(190-198)、EQIK(223-226)、SVQKLQK(245-251)共计10条与文献报道具有较高的一致性。
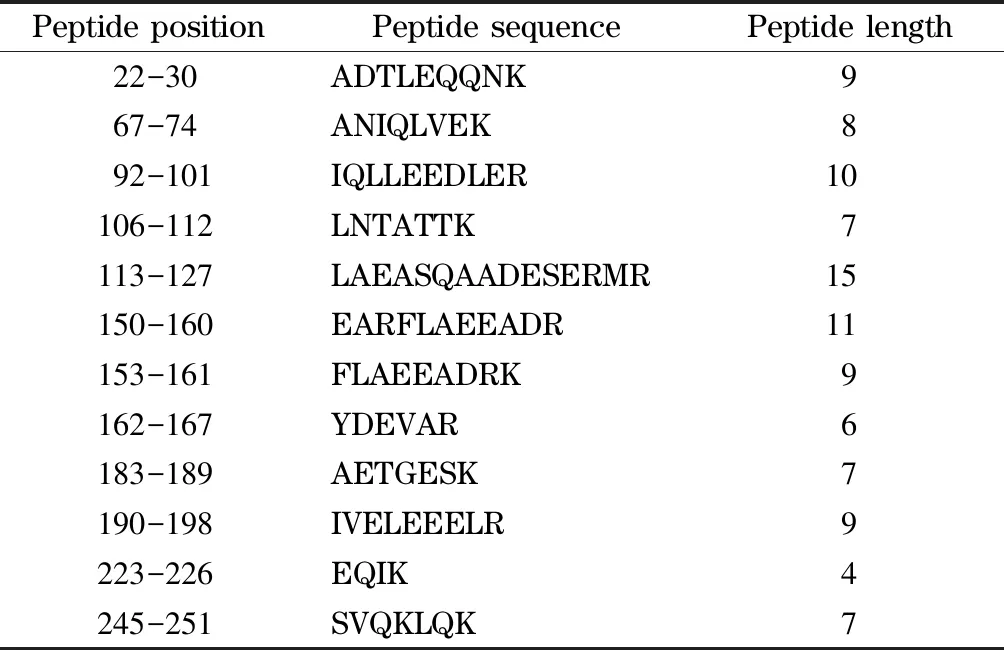
表 2 检测到的与IgE结合的TM肽段Table 2 Peptide segments detected in combination with IgE
3 结论
本文采用非对称流场流分离技术联合超高效液相色谱-串联四极杆飞行时间质谱分析技术对过敏原表位的研究进行了初步的探索。通过AF4实验证实了虾TM标准溶液与IgE标准溶液可以在体外发生结合,通过将虾TM标准溶液酶解成为肽段之后与IgE标准溶液进行结合,之后采用AF4-UPLC-QTOF-MS研究策略,分析了虾TM的抗原表位。实验共筛选得到12条可能含有抗原表位的肽段,其中10条肽段的氨基酸序列与文献[25]所预测的虾TM抗原表位基本一致。本实验将AF4应用于过敏原蛋白表位的检测,拓展了AF4技术的应用,同时为过敏原表位筛选提供了一种新的研究策略,通过进一步的研究有望建立起AF4-UPLC-QTOF-MS的过敏原蛋白表位筛选平台。

