干酪乳杆菌在牦牛奶酪制作中发酵特性的研究
谢文栋,旦久罗布,何世丞,次旦,严俊,张海鹏,高科
(西藏那曲市草原站,那曲 852000)
益生菌主要是指那些通过改善其宿主肠道微生态作用而有益于宿主的微生物活体。目前,市场上益生菌食品已有很多种,且市场占有率不断上升,开发更多更新的益生菌产品是大势所趋。干酪乳杆菌(Lactobacillus casei,Lc)和双歧杆菌一样,是益生菌中最具代表性的菌属[1]。
经研究表明干酪乳杆菌具有良好的耐酸性、人工胃肠液耐受性及胆盐耐受性[2],对免疫系统具有显著的调节功能[3,4],喂饲该菌体能显著降低高脂饲料大鼠血清胆固醇和低密度脂蛋白含量[5]。这些研究证实该菌具有良好的益生潜力,因此对其发酵特性的研究具有重要的意义。本研究是在传统牦牛乳酪(发酵剂为S.Lactis、Str.Cremoris)制作中添加不同量的干酪乳杆菌,观测其发酵特性,为其进一步开发提供依据。
1 材料与方法
1.1 原料
牦牛乳(来自西藏那曲地区);3.7%的乳清蛋白浓缩物(WPC-34,新西兰产),7.00%的白砂糖,0.35%的稳定剂(明胶0.30%和果胶0.05%),均为质量分数。
1.2 菌种及添加量
菌种为乳酸链球菌(S.Lactis),乳脂链球菌(Str.Cremoris),Lc。将Lc制成母发酵剂后,按0、1.0%、1.5%、2.0%、2.5%、3.0%分别添加于原料乳中;S.Lactis和Str. Cremoris采用直投法,添加量为0.006%(质量分数),编号见表1。

表1 菌种添加量
1.3 仪器设备
全乳成分分析仪(LacticheckTM LMA20132),黏度计(BR OOKFIELD DV- E),均质机( 上海申鹿SR H60-70),生化培养箱(上海一恒 LR H- 250),离心机(上海安亭 GL- 20B)等。
1.4 方法
1.4.1 干酪乳杆菌的活化及发酵剂的制作
将-84℃冷冻保存的Lc接种于MRS液体培养基中,置37℃培养18h,传代培养2次。
取上述Lc培养液5mL,经3 500g离心10min,收集菌体,加入5mL灭菌生理盐水洗涤2次后,混匀制成供试菌悬液,以2%接种于灭菌脱脂乳(质量分数为11%,添加5%蔗糖和0.75%葡萄糖)中,置37℃培养12h,制成母发酵剂。
1.4.2 牦牛奶酪的生产工艺

1.5 发酵特性指标测定
按上述工艺流程,当原料乳冷却至30℃时,将Lc、S.Lactis和Str. Cremoris按比例接种于其中,于30℃发酵。分别在0、3、6、9、12h和后熟12h(以H12h表示) 取样测定其pH值、滴定酸度、黏度、持水性、菌落总数、蛋白水解能力等指标( 平行实验重复3次,取平均值) 。 并将12h培养后的发酵乳样放入4℃冰箱中冷藏保存,于7、14、21和28d分别取样测定上述指标。
1.5.1 pH值:采用精密pH计( 雷磁PHS- 3C) 测量。
1.5.2 滴定酸度:取发酵乳样10mL,加入等体积的蒸馏水,混匀后,加入2滴酚酞作指示剂,用标准浓度为0.1mol/L的NaOH滴定。
1.5.3 活菌数:发酵乳样用灭菌生理盐水梯度稀释至一定倍数后,采用Rogasa[6]选择培养基平板倾注法,37℃培养48h后计菌落总数,测定Lc的活菌数。
1.5.4 黏度:采用Brookfield DV-1 VISCOMETER 黏度计进行测定。
1.5.5 蛋白水解能力:样品处理采用Abu-tarboush等方法[7];蛋白水解能力测定采用Frank等建立的邻苯二甲醛(OPA)法[8]。
1.5.6 持水力:将35g奶酪样品置于离心机中,以3 500g离心10min。其计算公式为:

2 结果与分析
2.1 不同添加量Lc的产酸能力
不同添加量Lc样品在30℃发酵过程中及在4℃冷藏过程中pH值及滴定酸度变化如图1~4所示。

图1 发酵过程中pH值变化
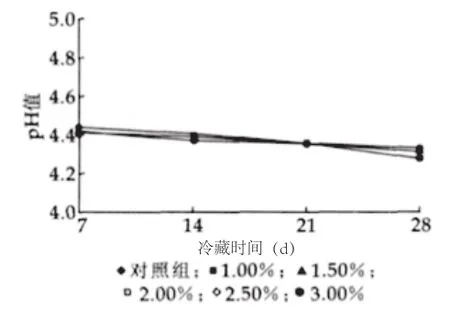
图2 冷藏过程中pH值变化

图4 冷藏过程中滴定酸度变化
由图1和图3可以看出,30℃发酵过程中,添加Lc的奶酪样品pH值均较对照组低,滴定酸度均较对照组高。发酵至6h样品的pH值和滴定酸度达到显著水平,Lc加量为3.00%的5号样pH值降幅最大为1.02(P<0.05),对照组降幅为0.80。说明随添加量的增大,Lc的产酸速率加快。
由图2和图4可以看出,4℃冷藏过程中,试验组与对照组的pH值有所降低,滴定酸度有所上升,组间差异不明显(P<0.05)。其中3.00%的5号样pH值的降幅最大且仅为0.16,说明Lc在贮藏期间几乎没有后酸化现象。
2.2 活菌数变化
不同添加量Lc在30℃发酵过程中和4℃冷藏过程中的活菌数变化如图5和图6所示。
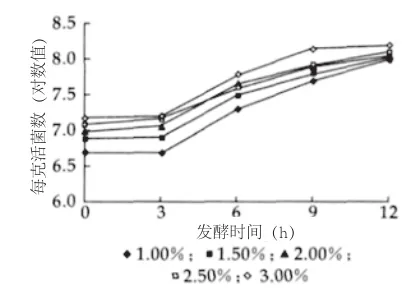
图5 发酵过程中Lc菌数变化

图6 冷藏过程中Lc菌数变化
由图5可以看出,在30℃发酵过程中,随着发酵时间的延长,不同添加量Lc的生长度逐渐上升,3~6h为对数生长期,之后进入平稳期,一直持续到发酵结束。Lc添加量为3.00%的5号样,在发酵6h时的活菌数为6.03×107/g;12h发酵结束时,活菌数为1.58×108/g。
2.3 样品黏度变化
不同添加量Lc在30℃发酵过程中和4℃冷藏过程中的黏度变化如图7和图8所示。
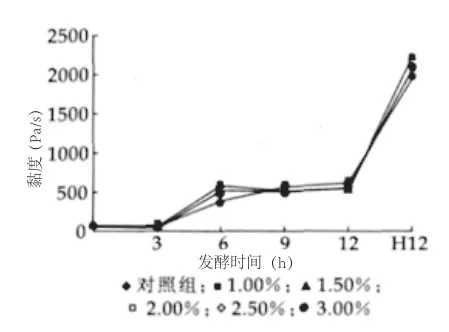
图7 发酵过程中黏度变化

图8 冷藏过程中黏度变化
由图7可以看出,在30℃发酵过程中,3h后黏度开始上升;发酵至6h时,由于pH值的进一步降低,黏度迅速增加,添加Lc的各组样品的黏度均较对照组显著增加(P<0.05)。
由图8可以看出,在4℃冷藏中,对照组在冷藏28d中黏度几乎不变化;其余各组样品的黏度在冷藏7~14d中显著降低,之后到28d黏度变化不明显。
2.4 蛋白水解能力变化
不同添加量Lc在30℃发酵过程中和4℃冷藏过程中的蛋白水解能力变化如图9和图10所示。

图9 发酵过程中可溶性蛋白氮变化

图10 冷藏过程中可溶性蛋白氮变化
由图9可以看出,各组样品在30℃发酵过程中,随发酵时间的延长可溶性氮的浓度略有增加。
由图10可以看出,在4℃冷藏过程中,Lc添加量为1.00%的1号样的可溶性氮先减少后增加,其余各组和对照组的可溶性氮均升高,尤其是在7~14d冷藏过程中可溶性氮升高的幅度较大。28d冷藏过程中添加Lc的各组样品的可溶性氮略高于对照组,组间差异不显著(P>0.05)。
2.5 样品持水力变化
图11为不同添加量Lc奶酪样品持水力变化。

图11 样品持水力变化
持水力是反映奶酪稳定性的一个重要指标,持水力好,奶酪的稳定性就好。由图11可以看出,发酵结束时,对照组的持水力最好。后熟12h后,对照组的持水力下降,而添加Lc的各组样品的持水力明显上升。4℃冷藏条件下,随贮存天数的延长,各组样品持水力有所下降。但在28d的冷藏过程中添加Lc的各组样品的持水力好于对照组(P<0.05)。
3 结论
本研究是在传统奶酪(发酵剂为S.Lactis、Str.Cremoris) 基础上,通过在原料奶中添加乳清蛋白浓缩物(WPC) 和适量稳定剂,使总固形物浓度提高,再添加益生菌干酪乳杆菌(Lc),经低温(30℃)长时间(12h)发酵制成酸性乳酪( 蛋白4.5%),省去了传统工艺中的排乳清工序,最大限度地保留了奶酪中的营养成分。尤其是添加Lc后,产品的附加值更高。
试验过程中主要是对不同Lc添加量(0~3%)的发酵特性进行了观测,结果如下∶
(1)产酸能力。30℃发酵过程中,发酵至6h各组样品的pH值显著下降而滴定酸度显著升高。其中从6h到12h发酵结束,各组样品pH值和滴定酸度变化缓慢。4℃冷藏过程中各样品的pH值及滴定酸度几乎没有变化,Lc不会造成奶酪在冷藏过程中的后酸化。
(2)活菌数。30℃发酵过程中,3~6h为Lc的对数生长期。Lc添加量为3.00%的样品,在发酵6h时的活菌数为6.03×107/g;12h发酵结束时,活菌数为1.58×108/g。在4℃冷藏期间,Lc活菌数逐渐上升,添加3.00%Lc的样品活菌数为9.77×108/g。
(3)黏度。30℃发酵过程中,3~6h各组样品黏度显著升高。发酵至6h时,添加Lc的各组样品的黏度均较对照组显著增加(P<0.05)。4℃后熟12h后,添加Lc的各组样品的黏度均较对照组增大(P<0.05)。在4℃冷藏期间,对照组在冷藏28d中黏度几乎不变化;其余各组样品的黏度在冷藏7~14d中显著降低,之后到28d黏度变化不明显。
(4)蛋白水解能力。30℃发酵及4℃冷藏过程中,对照组与添加Lc组的可溶性氮浓度差异不显著(P<0.05),Lc的蛋白水解能力较弱。
(5)持水力。奶酪后熟12h后,添加Lc的各组样品持水力明显好于对照组。4℃冷藏条件下,随贮存天数的延长,各组样品持水力有所下降。 但在28d的冷藏过程中,添加Lc的各组样品持水力好于对照组。
由以上试验所得结果可知,在奶酪发酵过程中,Lc不影响其他两株菌 (S. Lactis、Str. Cremoris)的正常生长;在奶酪冷藏过程中,Lc一直在生长,这为Lc的产品开发提供了依据。


