奶牛乳房炎主要致病原的分离鉴定及药敏试验
葛影影,张震,何国戈,郑经成,胡克科
(1.广东省清远市农业科技推广服务中心,清远 511500;2.河南省奶牛生产性能测定中心,郑州 450000 )
乳房炎是奶牛的一种常见、高发、难防、高淘汰的疾病,全世界每年因乳房炎造成的损失高达350多亿美元[1],我国每年因奶牛隐性乳房炎造成的损失约1.35亿元,平均每个病例损失1 200~3 600元[2]。据报道,引发奶牛乳房炎的主要致病菌有细菌、病毒、支原体和真菌等,约150多种[3],但以细菌性感染为主。奶牛乳房炎的发生除病原菌感染因素外,与季节、气候的变化、环境卫生状况、饲养管理水平、挤奶设备消毒与监测、奶牛自身及遗传等因素也密切相关。调查发现,近年来河南省奶牛乳房炎的发病率偏高(70.66%),其中临床型乳房炎的平均发病率约7.18%,隐性乳房炎的平均发病率约63.48%[4]。兽医临床上用抗生素治疗病原菌性奶牛乳房炎虽取得一定效果,但因地区差异,引起乳房炎的病原菌种类不同,长期大量使用单一抗生素导致的病原菌产生耐药性、乳汁兽药和毒素残留等问题突出,增加了乳房炎治疗工作的难度[5]。本研究针对河南地区奶牛乳房炎主要致病菌进行了分离鉴定和临床药敏试验,旨在为减少该地区乳房炎发病率,降低牧场养殖经济损失,更好地保证乳品质量安全提供参考依据。
1 材料
1.1 采样对象
选择河南4个地区20家奶牛场,采集乳样共210份。
1.2 主要试剂
MH肉汤、营养琼脂培养基、麦康凯琼脂培养基,购自青岛日水生物技术股有限公司;伊红美蓝琼脂培养基、却普曼琼脂培养基、革兰氏染液,购自青岛高科园海博生物科技有限公司;药敏纸片,购自杭州微生物试剂有限公司;乳房炎病原菌基因组 DNA 提取试剂盒和奶牛乳房炎病原体检测试剂盒,购自北京博奥生物集团有限公司;加州隐性乳房炎诊断液,北京奶牛中心生产。
2 方法
2.1 乳样采集
采样前先用40℃左右的温水清洗乳房,再用75%酒精棉球消毒,然后用一次性纸巾或消毒干毛巾将乳头擦拭干净,弃前三把奶后采集约20mL的奶样,放入无防腐剂的无菌奶样管,做好标记。
2.2 乳房炎的检测
2.2.1 加州乳房炎检测法(CMT)
每个检测盘内加入2mL乳房炎检测(CMT)试剂和2mL乳样,倾斜45°缓慢晃动,使盘内的乳汁与检测液充分混合。根据混合后乳汁状态,结合试剂瓶上的说明书进行判定。CMT的判定标准见表1。2.2.2 奶牛生产性能测定(DHI)

表1 CMT法的判定标准
将奶样送至实验室,使用荷兰Delta体细胞乳成分综合分析仪测定体细胞和乳成分。通过检测乳汁体细胞水平,并参考乳房炎SCC判定标准(≥50万个/mL),辅助诊断奶牛是否感染乳房炎及乳房炎的发病程度。根据乳成分测定结果,辅助分析奶牛日粮营养水平是否合理。
2.3 主要病原菌的分离
对CMT检测呈阳性的乳样进行病原菌的分离鉴定,乳样混匀后划线接种于鲜血琼脂培养基,37℃培养18~24h,挑取单菌落进行涂片、染色和镜检。根据菌落生长特征接种于麦康凯培养基、伊红美蓝培养基、改良爱德华培养基等选择性培养基, 进一步纯化培养后超低温保存菌种。
2.4 恒温扩增微流控芯片核酸分析法
2.4.1 奶牛乳房炎基因组 DNA 提取
无菌条件下吸取1mL牛奶到无菌离心管(正常和隐性乳房炎牛奶取1mL;临床症状明显的牛奶最多取200μL),12 000r/min离心5min,弃上清液,加入1mL生理盐水和 TE 溶液充分混匀,12 000r/min 离心2min,弃上清留沉淀,然后按照乳房炎基因组DNA提取试剂盒使用说明进行操作。
2.4.2 DNA 质量检测
取5μL乳房炎核酸样品置于微型分光光度计定量仪器中测定。若定量结果≥25ng/μL,则稀释到20ng/μL后与反应液混合后上芯片检测;若定量结果≤25ng/μ L,则直接与反应液混合后上芯片检测。
2.4.3 恒温扩增微流控芯片核酸分析检测
根据芯片分析检测说明制备核酸分析检测扩增反应体系,放入恒温扩增微流控芯片核酸分析仪进行核酸扩增分析检测。
2.5 药敏试验
将分离纯化的奶牛乳房炎主要致病菌接种于营养MH肉汤,恒温汽浴培养18h,用无菌生理盐水将菌液稀释至浓度约为2×106cfu/mL,吸取菌液200μL,用无菌涂布棒均匀涂布于MH琼脂平板上。将12种药敏纸片分别轻贴于两个平板上,37℃恒温培养18~24h,根据抑菌圈的直径大小判定分离株对药物的敏感性。药敏试验判定标准:抑菌环直径≥20mm为高度敏感;10mm≤抑菌环直径<20mm为中度敏感;抑菌环直径<10mm为耐药。
3 结果与分析
3.1 奶牛乳房炎发病率检测结果
检测发现,奶牛乳房炎的总发病率为49.52%(104/210),其中临床型乳房炎和隐性乳房炎的发病率分别为4.76%(10/210)、44.76%(94/210),两者间发病率的比例接近5∶47。
3.2 乳房炎病原菌种类及比例
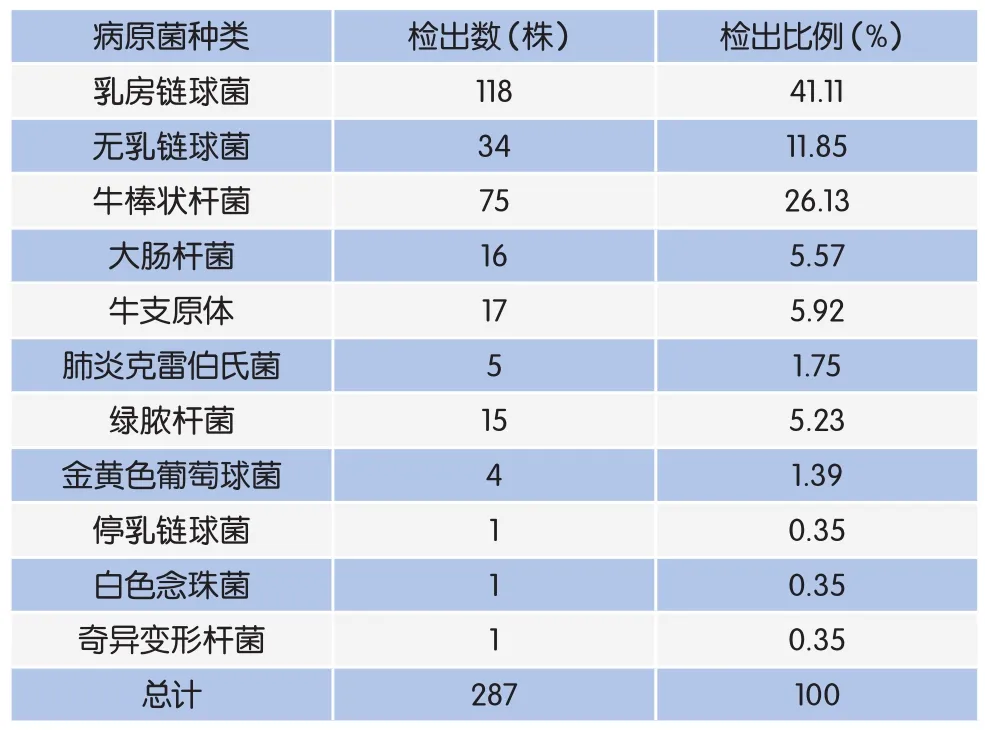
表2 乳房炎病原检出种类及比例
从210份乳样中共分离出287株乳房炎致病菌。其中,乳房链球菌、牛棒状杆菌、无乳链球菌、大肠杆菌、牛支原体分别检出118株、75株、34株、16株、17株,各占检出比例的41.11%、26.13%、11.85%、5.57%、5.92%(表2)。
3.3 主要致病菌药敏试验结果
选取临床上常用的11种抗菌药物对奶牛乳房炎4种主要致病菌进行药敏试验。结果显示,乳房链球菌、无乳链球菌、牛棒状杆菌、大肠杆菌对环丙沙星、恩诺沙星(喹诺酮类)高度敏感,对四环素、氯霉素中度敏感;对复方新诺明、头孢噻肟、头孢喹啉中高度敏感;对青霉素耐药(表3)。

表3 主要致病菌药敏试验结果
4 讨论
本试验通过恒温扩增芯片法检测210份阳性乳样,共检出11种287株病原菌,球菌、杆菌以及支原体均被检出,可见,细菌感染性乳房炎为常见多发。其中,链球菌、牛棒状杆菌、大肠杆菌、牛支原体所占比率高达90.58% 。以上被检出病原菌是引起河南地区奶牛乳房炎的主要致病菌。这与周婷婷等[6]的报道不完全一致。金黄色葡萄球菌检出率明显下降,可能是由于牧场对奶牛乳房和体躯的清洗、刷拭次数增加使皮肤保持干净完整,挤奶工做好清洁操作和定期消毒工作,金黄色葡萄球菌不易通过损伤的皮肤侵染、定植。杆菌感染性乳房炎的发病率也较高,这与王建忠的报道基本一致[7]。大肠杆菌、牛棒状杆菌、乳房链球菌均属于环境性病原菌,主要是因畜舍内外及奶厅的环境卫生不良引起,如粪便污水、垫料土壤、污染的奶杯内衬、肮脏的乳房乳头表面均是环境性病原菌的生活场所。因此,乳房炎防控工作中应加强挤奶设备的消毒和监测、规范挤奶员工的标准化操作程序、及时清理粪污、定期更换垫料和消毒圈舍,以有效阻断传播途径。其中,牛棒状杆菌主要感染成年母牛,寄居在泌乳、干奶和妊娠阶段奶牛乳腺内的时间较长,严重危害奶牛的产奶性能和乳品质。目前,关于牛棒状杆菌引发奶牛乳房炎的报道相对较少,其临床诊断和防治尚需进一步探究。本试验检出了牛支原体性乳房炎。奶牛的挤奶、呼吸、输精和分娩过程是传播支原体的重要途径[8],感染支原体的奶牛乳区表现红肿、胀痛,产奶量显著下降,乳汁呈黄褐色脓汁状,甚至停止产乳;有时会伴随关节肿痛、肢蹄跛行、呼吸异常等症状,在奶牛生产中应予以高度重视。
奶牛乳房炎的治疗主要以抗生素为主。通过试验结果发现,河南地区治疗奶牛乳房炎选择的有效药物有环丙沙星、恩诺沙星、复方新诺明、头孢噻肟、头孢喹啉等,原因是环丙沙星等作为喹诺酮类药物的新一代产品,抗菌广泛性好,抑制多种病原菌作用明显[9],这与韩瑞霞的研究报道相近[10]。可见,喹诺酮类和头孢菌素类抗菌药物对河南地区几种主要致病菌引起的奶牛乳房炎具有良好抑制作用。但以上四种主要致病菌对青霉素均产生耐药性,可能是生产中长期大量选择使用价格低的青霉素导致耐药菌株大量出现,菌株体内出现耐药基因,增加了抗性。因此,奶牛生产中开展及时、准确、有效的乳房炎主要病原菌的诊断与药敏试验及相关耐药基因的筛查工作,制定合理的交替用药综合防控方案,对缩短乳房炎治疗时间、降低治疗成本、减少经济损失有着重要意义。

