生脉饮对荷斯坦青年母牛运输应激的影响
孙宇,王义翠,贾荣玲,刘延鑫,付彤, 高腾云
(1.河南农业大学牧医工程学院,郑州 450002; 2.河南中医药大学,郑州 450046;3.南阳农业职业学院,南阳 473000)
荷斯坦牛是世界各国主要的奶牛品种,各地之间经 常会通过运输引入奶牛,在运输过程中因生活环境的变化,迫使动物处于适应新环境下的被动状态,同时途中由于惊吓、拥挤、伤风、饥饿、颠簸、温度等应激原的综合作用,机体的营养代谢和免疫机能发生改变,不仅出现食欲减退、拉稀等一系列症状,还会导致奶牛生长发育缓慢、生产性能降低,还可能诱发腹泻、肺炎等疾病,对奶牛业发展产生极大影响[1~4]。
生脉饮具有强心益气,养阴生津,增强免疫功能,提高机体抵抗力的作用[5]。动物试验已证实生脉饮有多脏器保护作用[6],有抗应激、抗炎作用[7~10]。在减少运输应激造成牛发病的添加药物方面,国内很多学者进行了有益的尝试[10~13],但至今国内外尚未见关于生脉饮防治奶牛运输应激的报道。鉴于此,本试验探讨了中草药试剂生脉饮对荷斯坦青年母牛运输后的作用效果,为降低奶牛运输应激提供参考依据。
1 材料与方法
1.1 试验地点和时间
试验时间为2017年4月份,试验地点在郑州市河南农业大学实验牛场。
1.2 试验药物与试剂
生脉饮(国药准字Z11020363)购自北京同仁堂科技发展股份有限公司,丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、超微量Na+/K+-ATP酶试剂盒、谷胱甘肽-过氧化物酶(GSH-Px)试剂盒和总蛋白试剂盒均购自南京建成生物工程研究所。
1.3 试验处理及饲养管理
选择15头体重、月龄相近(10月龄)的青年母牛,随机分为对照组、运输应激组和生脉饮处理组,每组5头。对照组牛不进行运输。运输应激组和生脉饮处理组牛随机装车,在模拟道路(包括红绿灯停车和颠簸路段)上进行3h速度为60km/h的公路运输(相当于从许昌出发运至郑州),途中均不提供饮水和食物。生脉饮处理组自运输前3d至运输后7d,按120mL/(头·d)在水中添加生脉饮,由专门实验人员监督试验牛服用。
到达场舍后,对各组试验牛在统一饲养管理条件下饲喂。运输后1d没有饲喂精饲料,自由饮水,每日人工饲喂2次。
1.4 样品的采集和指标测定
1.4.1 采食量、体温的测定 每天7∶40对每组牛的平均采食量进行测定;每天8∶30采用兽用体温计测定全部牛的直肠温度。
1.4.2 血液样本的采集与处理
在运输前1d,运输后1d、7d、14d对各组试验牛采集尾静脉血10mL,ACD抗凝,迅速用冰盒带回实验室,1 500r/min离心15min,分离上层血清以备测定血清无机离子含量、GSH-Px、SOD酶活力和MDA含量;下层的红细胞备测红细胞膜Na+/K+-ATP酶活力。
1.4.3 血液生化指标的测定
采用 Abacus Junior VET全自动血常规分析仪测定血液相关指标。
1.4.4 血清抗氧化指标的测定
GSH-Px活性采用二硫代二硝基苯甲酸法测定;SOD活性采用黄嘌呤氧化法测定;MDA含量采用硫代巴比妥酸(TBA)方法测定;红细胞膜Na+/K+-ATP酶用比色法测定;总抗氧化能力(T-AOC)等指标测定均严格按照试剂盒说明书进行。
1.4.5 生长性能及健康状况记录
于运输后1、7、14d称重,计算14d平均日增重;此外,观察并记录14d内所有试验牛的发病情况,主要观察呼吸道疾病和消化系统疾病。
1.5 数据处理
应用SPSS 19.0软件处理试验数据,结果以平均值±标准差表示。以One-Way ANOVA进行方差分析,比较不同试验处理对奶牛血液相关生理、生化指标及增重的影响,同时考察同一组内、不同时间点奶牛血液指标的变化。采用LSD法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 生脉饮对荷斯坦青年母牛直肠温度的影响
表1组内比较结果显示,运输应激组荷斯坦青年母牛平均直肠温度在运后1d与其他时间点比较温度略高,差异显著(P<0.05);对照组和生脉饮处理组平均直肠温度在运后1d与其他时间点比较,均差异不显著(P>0.05)。组间比较结果显示,运后1d,运输应激组与对照组和生脉饮处理组比较,平均直肠温度略高,差异显著(P<0.05)。
2.2 生脉饮对荷斯坦青年母牛干物质采食量的影响

表2 生脉饮对荷斯坦青年母牛干物质采食量的影响单位: kg/(头·d)
表2组内比较结果显示,荷斯坦青年母牛平均干物质采食量运输应激组和生脉饮处理组在运后7d与其他时间点比较,采食量下降,差异显著(P<0.05);对照组干物质采食量在运后7d与其他时间点比较,差异均不显著(P>0.05)。组间比较结果显示:运后7d干物质采食量,运输应激组与对照组和生脉饮处理组比较,均差异显著(P<0.05),对照组与生脉饮处理组比较,差异显著(P<0.05);运后14d,运输应激组与对照组和生脉饮处理组比较,差异显著(P<0.05)。
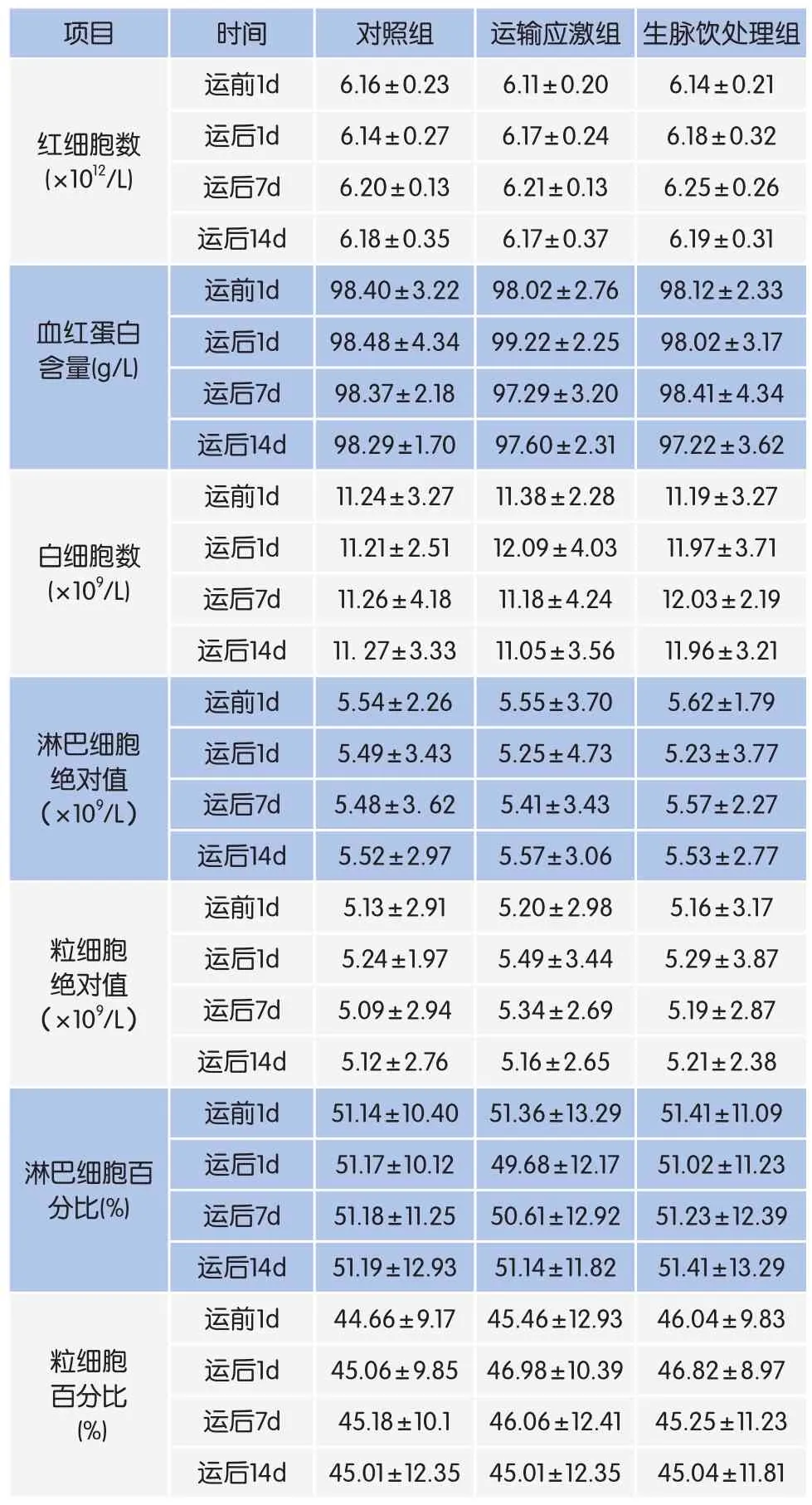
表3 生脉饮对荷斯坦青年母牛血液生化指标的影响
2.3 生脉饮对荷斯坦青年母牛血液生化指标的影响
表3组内比较结果显示,运输应激组白细胞数、粒细胞绝对值和粒细胞百分比在运达后1d高于其他时间点,淋巴细胞绝对值和淋巴细胞百分比在运达后1d低于其他时间点,但是差异均不显著(P>0.05)。生脉饮处理组的白细胞总数、粒细胞绝对值和粒细胞百分比在运达后1d高于其他时间点,淋巴细胞绝对值和淋巴细胞百分比在运达后1d低于其他时间点,但是差异均不显著(P>0.05)。组间比较结果显示,整个试验期各组之间红细胞数、血红蛋白含量、白细胞数、淋巴细胞绝对值、粒细胞绝对值、淋巴细胞百分比、粒细胞百分比均差异不显著(P>0.05)。
2.4 生脉饮对荷斯坦青年母牛抗氧化能力的影响
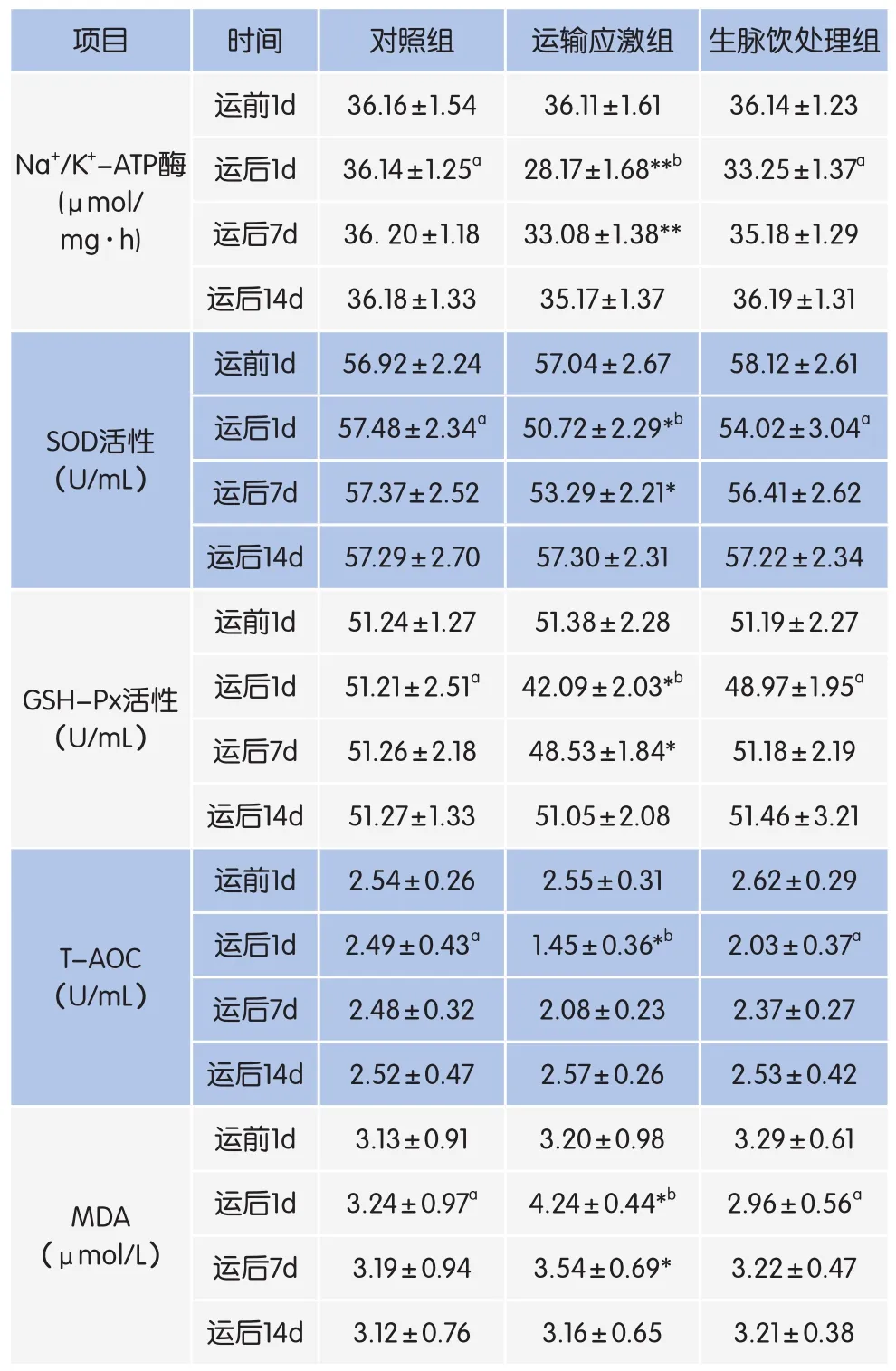
表4 生脉饮对荷斯坦青年母牛抗氧化能力的影响
由表4可知,运输应激组奶牛在运输后1d、7d的Na+/K+-ATP酶活性均极显著低于运输前1d(P<0.01),运输后1d、7d血清SOD活性、GSHPx活性和T-AOC均显著低于运输前1d(P<0.05),运输后1、7d血清MDA含量显著高于运输前1d(P<0.05)。
在运输后1d、7d,红细胞膜Na+/K+-ATP酶活性运输应激组均显著低于对照组和生脉饮处理组(P<0.05),后二者间差异不显著(P>0.05)。在运输后1d、7d,血清SOD活性、GSH-Px活性和T-AOC运输应激组显著低于对照组和生脉饮处理组(P<0.05)。在运输后1d、7d,血清MDA含量运输应激组显著高于对照组和生脉饮处理组(P<0.05)。
2.5 生脉饮对荷斯坦青年母牛平均日增重和发病率的影响
由表5可知,运输应激组运输后14d呼吸道发病率和消化道发病率分别达到15%和20%,而生脉饮处理组分别为0和10%。对照组和生脉饮处理组运输后14d平均日增重均极显著高于运输应激组(P<0.01)。
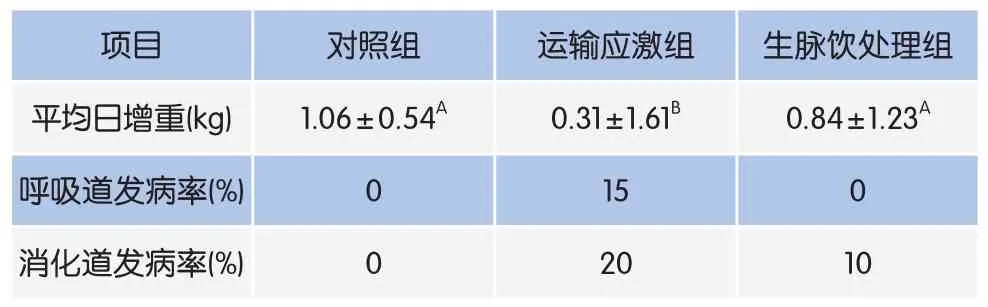
表5 生脉饮对荷斯坦青年母牛平均日增重和发病率的影响
3 讨论
胡长敏等[14]对三种抗牛运输应激技术效果比较的研究结果表明,运输前后相比,试验组牛体温平均值比对照组均有轻度升高,但差异不显著。本研究证明,运输应激影响了奶牛正常的体温,这与胡长敏等研究结果一致。在本研究中,运输应激组奶牛体温略有升高(P<0.05);生脉饮处理组与对照组及其他时间点比较无显著差异,原因可能是生脉饮能滋阴清热,具有抗疲劳作用[15],有利于稳定运输应激造成的奶牛体温改变。
Mackenzie等[16]研究表明,奶牛在运输过程中会精神不安、肌肉紧张,大多会饮食废止,运输后因反刍规律可能被打乱,采食量减少。在本研究中,运输后的牛采食量明显下降,与以上研究结果一致。本研究发现生脉饮不仅使奶牛试验期的干物质采食量得到显著改善(P<0.05),日增重也明显提高(P<0.05);生脉饮处理组奶牛在投喂生脉饮期间,平均日采食量有上升趋势,显著高于运输应激组的奶牛,日增重显著高于运输应激组,表明在运输后的饲喂过程中,生脉饮有提高奶牛日采食量、增加日增重的作用,原因可能在于生脉饮味微苦甘,益气复脉、养阴生津,从而能提高动物的生长性能等[17]。
机体处于应激状态时,免疫功能下降[4]。运后第7天时,生脉饮处理组奶牛血液中的白细胞数目有增高趋势,这提示生脉饮可以提高应激奶牛的细胞免疫力[18];在试验期内,各组之间红细胞数、血红蛋白含量、白细胞数、淋巴细胞绝对值、粒细胞绝对值、淋巴细胞百分比、粒细胞百分比均差异不显著,表明生脉饮对奶牛血液相关指标的影响不大,表明生脉饮可以安全应用于奶牛生产中。
机体的氧化/抗氧化状态平衡可能会被应激破坏,造成细胞功能异常。ATP酶可以为细胞输入许多新陈代谢所需的物质并输出毒物、代谢废物以及其他可能阻碍细胞进程的物质。钠钾ATP酶(又称为钠/钾离子ATP酶)能够调节细胞内钠/钾离子的浓度,从而保持细胞的静息电位,其活性对细胞正常功能的维持具有重要意义[18]。本试验结果表明,运输应激对血清SOD活性等均有显著影响,表明短途运输产生的应激对试验牛造成了一定程度的氧化损伤;但生脉饮处理组在运输后,血清SOD活性显著高于运输应激组,MDA含量显著低于运输应激组(P<0.05),表明生脉饮有利于机体保持氧化/抗氧化状态的平衡。曲维忠等[9]研究表明,生脉饮可显著增强小鼠血清中SOD活性并降低MDA含量,本试验结果与其一致,表明生脉饮增强了机体的抗氧化功能,在一定程度上缓解了运输应激对奶牛的影响。
生脉饮可增强动物机体免疫功能,改善心脏功能,调整心肌代谢,增强抵抗力;生脉饮具有显著抗炎作用,可提高动物对疾病的抵抗力。本研究表明,生脉饮处理组牛的呼吸道和消化道发病率明显减少。
4 结论
运输前3d添加生脉饮,运输后可以降低奶牛体温,提高奶牛干物质采食量,降低MDA的含量,增强机体的抗氧化功能;生脉饮用于奶牛生产是安全的;综合考虑各个因素,在奶牛运输前建议添加120mL/(头·d)生脉饮,以减轻运输应激对荷斯坦青年母牛造成的危害。


