地西他滨方案治疗骨髓增生异常综合征及急性髓系白血病疗效分析*
石 林,杨懿春,潘 晖,肖 青,陈建斌,唐晓琼,张红宾,刘 林,王 利
(重庆医科大学附属第一医院血液科,重庆 400016)
骨髓增生异常综合征(MDS)是一种克隆性造血干细胞疾病,特点是髓系细胞分化及发育异常,表现为病态造血及无效造血,难治性血细胞减少,造血功能衰竭,高风险向急性髓系白血病(AML)转化[1-2]。AML是一种以骨髓和外周血中原始及幼稚性髓系细胞异常增生为特点的恶性肿瘤[3]。地西他滨是一种2′-脱氧胞苷类似物,特异性DNA甲基转移酶抑制剂,低剂量能诱导DNA去甲基化,激活沉默失活的抑癌基因和造血细胞分化,高剂量则有细胞毒作用[4-5]。本研究中回顾性分析了使用含地西他滨方案治疗血液系统肿瘤,包括各型骨髓增生异常综合征(MDS)和AML的疗效和不良反应。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:根据骨髓和外周血涂片细胞分类计数、骨髓流式免疫表型分析、染色体核型分析、骨髓活检等实验室检查,符合《骨髓增生异常综合征诊断与治疗中国专家共识(2014)》[6]和《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)》[7]诊断标准;临床资料完整;本研究已获得医院医学伦理委员会批准,患者均签署知情同意书。
排除标准:未规律化学治疗(简称化疗);治疗过程中资料不完整。
病例选择与分组:选取我院2016年1月至2017年6月收治的MDS患者21例和 AML患者63例。21例MDS患者中,15例行MDS预后基因和融合基因检测,其中4例存在基因突变;19例行染色体检查,其中1例存在染色体核型异常,4例存在FISH检测异常(检查5q,7q,20q,+8)。63例 AML 患者中,41例行 AML 预后基因和融合基因检测,其中22例存在基因突变;29例行染色体检查,其中10例存在染色体核型异常,2例存在 FISH 检测异常(检查 5q,7q,20q,+8)。根据随机原则,将 MDS患者分为 A组(10例)和 B组(11例),将AML患者分为C组(20例)和D组(43例)。患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1和表2。

表1 MDS患者一般资料比较(n=21)
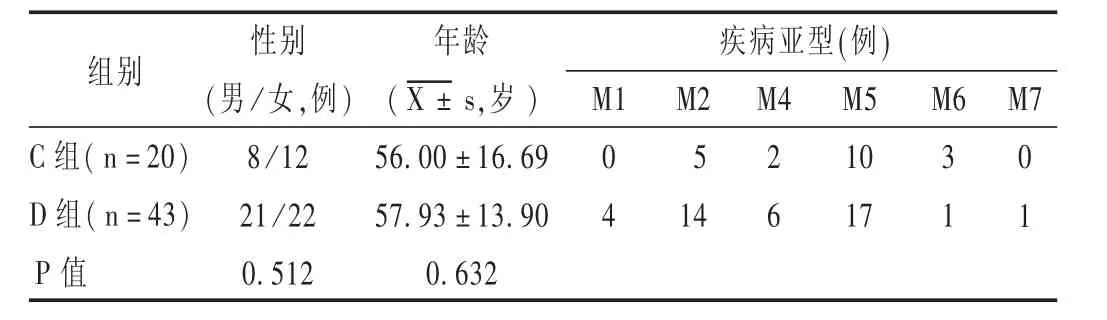
表2 AML患者一般资料比较(n=63)
1.2 方法
A组和C组均为单药治疗,方案为注射用地西他滨(正大天晴药业集团股份有限公司,国药准字H20120066,规格为每支 50 mg)20 mg /(m2·d),静脉滴注,第1~5天。化疗周期A组为2.5个,C组为2.6个。B组和D组均为联合化疗,方案为D-CAG,包括地西他滨 20 mg/(m2·d),静脉滴注,第 1~5 天;阿柔比星10 mg,静脉滴注,第3~10天;阿糖胞苷15 mg,静脉滴注,每 12 h 1次,第 3~16天;粒细胞集落刺激因子(G -CSF)300 μg,皮下注射 ,第 3~16 天 [白细胞(WBC)>20×109/L时停用]。化疗周期 B 组为 2.5个,D组为2.4个。血小板低于20×109/L者给予输入机采血小板,血红蛋白低于60 g/L者给予输注红细胞悬液。如果出现发热等感染征象,经验性使用广谱抗生素,同时积极查找病原菌。根据血培养、痰培养、G试验、GM试验、病毒筛查及胸部CT等检查结果及时调整抗生素。若治疗3~5 d后体温仍未得到控制,应结合真菌感染的证据加用抗真菌药物治疗。治疗3个疗程,每个疗程结束后2周复查,评价疗效。
1.3 疗效判定标准[8]
治疗结束2周复查骨髓穿刺,判定疗效。完全缓解(CR):症状、体征全部消失,中性粒细胞计数、血小板计数恢复正常,骨髓原始粒细胞所占比例在5%以下;部分缓解(PR):症状、体征已显著改善,中性粒细胞计数、血小板计数基本恢复正常,骨髓原始粒细胞所占比例为5% ~20%;未缓解(NR):症状、体征及骨髓均无改善。总缓解=CR+PR。不良反应按世界卫生组织(WHO)化疗药物不良反应分析标准判定。
1.4 统计学处理
采用SPSS 19.0统计软件进行分析。临床特征及疗效采用中位数(范围)、百分率表示,比较行 χ2检验,指标评分行Fisher精确概率法检验;生存曲线比较经Log Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
84例 MDS/AML 患者中,完全缓解(CR)59例(70.23%),部分缓解(PR)11 例(13.10%),总有效率为 83.33%(70/84)。不同方案对 MDS和 AML的疗效结果见表3。可见,A组和B组、C组和D组相比,差异均无统计学意义(P=1.000>0.05)。对可能存在影响疗效的因素进行Fisher精确概率法检验,结果见表4和表5。
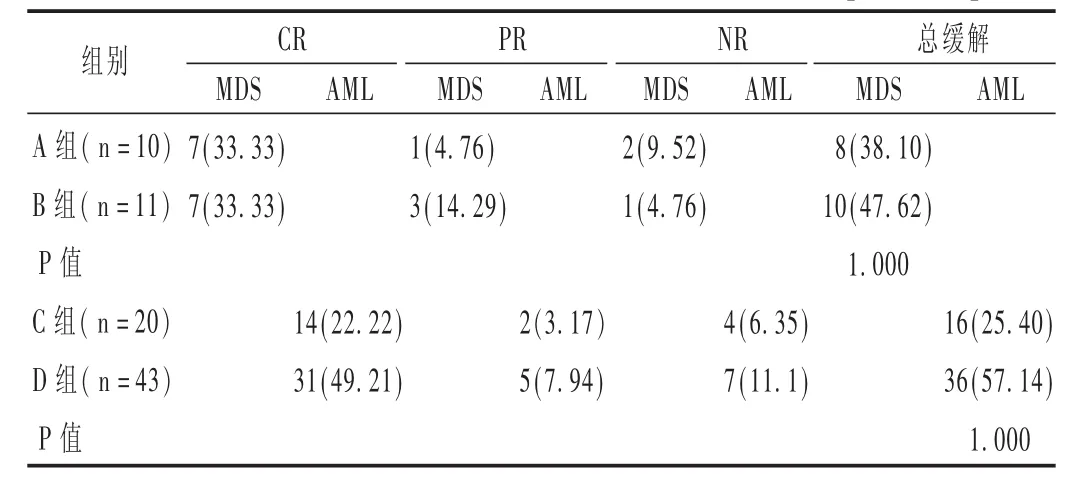
表3 不同方案对MDS和AML的临床疗效比较[例(%)]
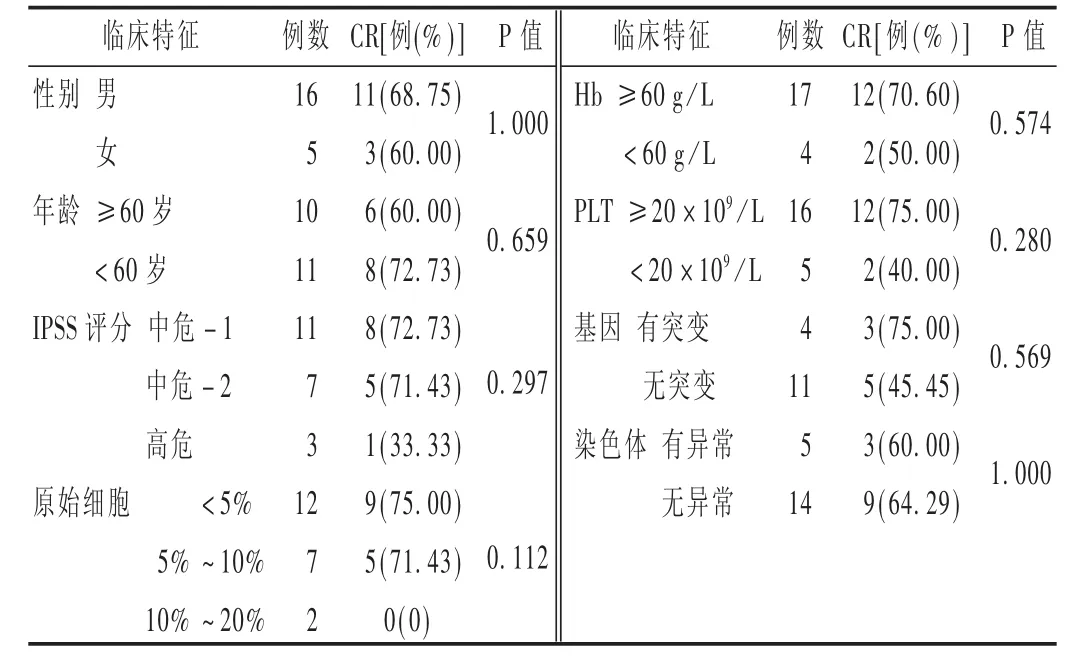
表4 不同临床特征对MDS治疗效果的影响
随访21例MDS及63例AML患者的生存情况,绘制生存曲线(图1),并对两组数据进行时序检验,可见,MDS患者使用地西他滨方案化疗后随访总生存率高于AML患者,但差异无统计学意义(P=0.208)。
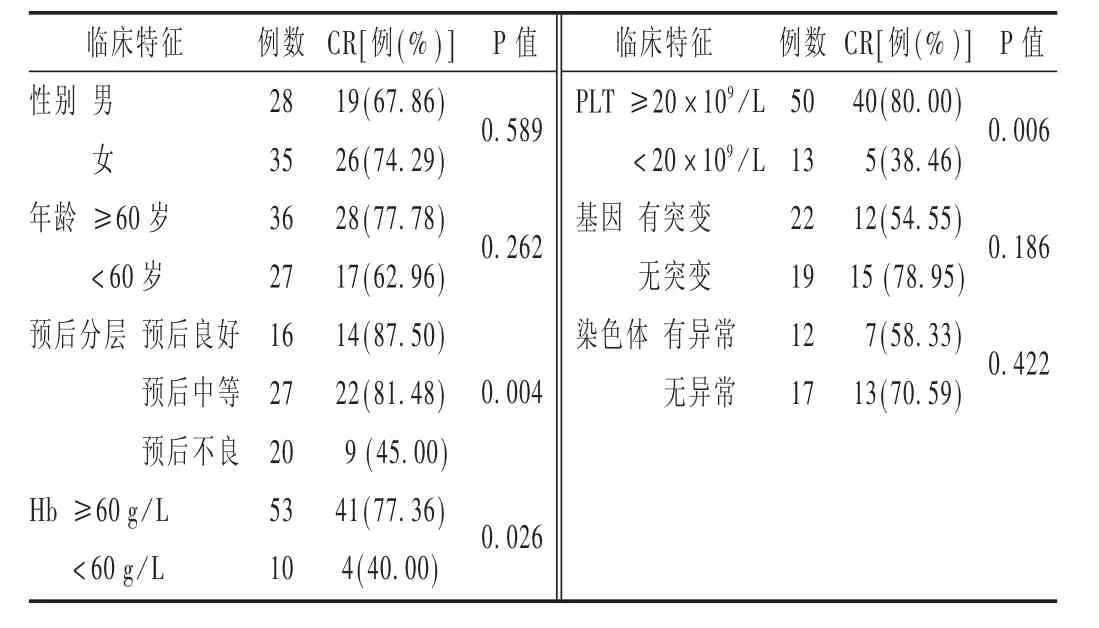
表5 不同临床特征对AML患者治疗效果的影响
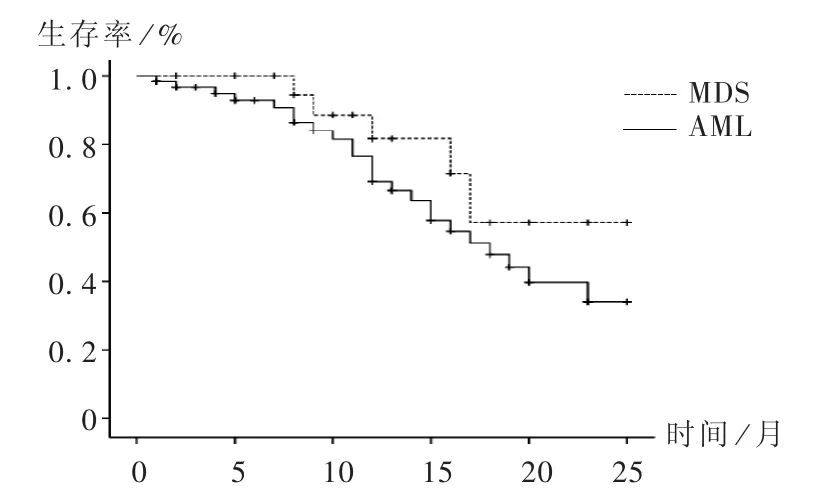
图1 MDS/AML患者生存曲线
2.2 不良反应
骨髓抑制:中性粒细胞计数 <0.5×109/L发生率为 85.71%(72 /84),中位持续时间为 14(0 ~ 23)d。血小板计数 < 20×109/L 发生率为 82.14%(69/84),中位持续时间为16(0~23)d。其中,Ⅳ级骨髓抑制的发生率为78.57%(66/84),余18例骨髓抑制较轻。
感染:化疗期间感染发生率为 52.38%(44 /84),其中肺部感染发生率为50.00%(42/84),肺部细菌合并真菌感染率为26.19%(22/84),上呼吸道感染和败血症各4例,消化道感染和尿路感染各1例,且部分患者合并多部位感染。肝、肾功能及凝血功能受损少见。绝大多数患者经积极抗感染可控制,但仍有4例(4.76%)患者发生严重感染,最终死亡。
3 讨论
地西他滨能抑制DNA甲基化转移酶的活性,使抑癌基因得以重新表达,是MDS/AML患者的治疗新选择[9]。WU等[10]发现,地西他滨与阿糖胞苷在杀伤髓系原始细胞上有协同作用,故地西他滨联合CAG方案可能比单药能取得更好的疗效。L譈BBERT等[11]分别用地西他滨单药和支持治疗的方法治疗233例高危老年MDS患者,结果显示,地西他滨组明显延长MDS向AML的转化时间,改善了患者的生活质量。GARCIAMANERO等[12]在分析856例MDS患者后得出IPSS评分、年龄不小于60岁、血小板小于50×109/L、原始细胞计数不低于4%等具有明显的预后意义。本研究中21例MDS患者中,多数老年、预后评估较差、不良基因突变和一般情况较差的患者选用单药方案化疗,但对上诉因素进行多变量分析未得出类似结论,可能与样本量不足和化疗方案的选择偏移有关。SCANDURA等[13]研究30例AML患者标准DA方案前予以地西他滨,完全缓解57%,部分缓解33%,不良反应与单用DA方案相似。本研究中,地西他滨方案对AML的治疗,缓解率高于上述研究,提示使用含地西他滨的化疗方案疗效高于DA方案,但仍需进一步扩大样本量进行验证。
GHANEM等[14]研究分析了122例使用地西他滨方案治疗MDS患者的数据,结果发现,地西他滨治疗有血液学毒性反应,且联合方案更易出现严重的骨髓抑制和继发感染。本研究中不良反应与其相关研究类似。感染以肺部感染多见,细菌感染为主,细菌合并真菌感染也较为常见,少数患者合并败血症、消化道感染、尿路感染,甚至合并多部位感染,但经积极预防和抗感染治疗均有效。故在使用地西他滨方案治疗MDS/AML过程中,应警惕感染相关并发症的出现,并积极预防感染及有效抗感染治疗。
此外,L譈BBERT等[15]对复杂核型AML的治疗中,地西他滨10 d方案可使患者获得75%的总反应率(在16例患者中,CR 8例,PR 4例);而在7号染色单体或del(7q)的AML患者中反应率高达91%。提示含染色体异常的患者对地西他滨化疗方案敏感。本研究中,染色体异常AML患者12例,化疗后,CR 7例,与同类研究结果一致。但与无染色体异常组比较,差异无统计学意义(P=0.422)。该结果可能与基因或染色体异常的患者样本量不足有关,需进一步扩大样本量研究。
有研究发现,随着地西他滨使用的疗程数增加,血液学毒性将逐渐下降[16]。本研究中观察结果与之相符,部分患者随疗程增加后骨髓抑制期逐渐缩短,甚至无明显骨髓抑制出现,且感染发生也较之前减少,耐受程度逐渐升高。可见,首程缓解后的巩固和维持治疗时骨髓抑制程度较轻,时间缩短,出现严重并发症的概率减少。
综上所述,地西他滨单药或联合化疗治疗MDS/AML,疗效确切,缓解率高,不良反应少,相对安全。随疗程的增加,其疗效及不良反应均有一定提高,需增强患者对该药的耐受性。

