中药白薇化学成分研究
孙 瑜,田树成,刘德军,王学妍
(辽宁中医药大学附属第三医院,辽宁 沈阳 110003)
白薇为萝 科鹅绒藤属植物白薇 Cynanchum atratum Bunge的干燥根茎,广泛分布于亚洲,尤其是东亚地区,我国大部分地区均有分布[1]。白薇性苦、咸,具有清热凉血、利尿通淋、解毒疗疮等功效,常用于治疗风湿性关节炎、胃肠炎、腹痛等疾病[2]。该属植物生物碱及甾体皂苷类成分是其主要活性成分[3-6],均有明确的抗肿瘤、抗炎及镇痛作用[7-10]。本研究中对白薇饮片95%乙醇提取物进行了研究,共分离得到8个单体成分,经过理化性质及核磁鉴定为 Glaucoside A(1),Glaucoside H(2),Cynatratoside A(3),Cynatratoside C(4),Cynatratoside E(5),Mooreanosid H(6), Sublanceoside L2(7), Sublanceoside H2(8),这些化合物均为首次分离得到。现报道如下。
1 仪器与试药
1.1 仪器
Bruker AV-400 FT型核磁共振波谱仪(TMS内标,Bruker Co.,Ltd.);Shimadazu LC - 6AD 型高效液相色谱仪(HITACHI,SPD -6A UV 检测器,Shimadazu Corporation);柱层析硅胶(100~200目,200~300目)和薄层色谱硅胶H均购于青岛海洋化工厂;Sephadex LH-20凝胶填料(北京绿百草科技发展有限公司),ODS柱色谱填料(月旭科技<上海>有限公司)。
1.2 试药
中药白薇购于沈阳辽河药房,经辽宁中医药大学附属第三医院田树成主任中药师鉴定为萝 科植物Cynanchum atratum Bunge的干燥根茎;所有有机试剂均购于天津科密欧化学试剂有限公司。
2 方法
2.1 提取与分离
白薇药材饮片10 kg,粉碎,加10倍量95%乙醇-水回流提取3次,每次2 h。合并提取液,减压浓缩后得到浸膏约1.2 kg,加适量水溶解,分别依次采用石油醚、乙酸乙酯、正丁醇进行萃取,合并不同极性萃取液,并进行减压干燥,得浸膏。乙酸乙酯层浸膏采用正相硅胶柱色谱分离,以不同比例二氯甲烷 -甲醇 (CH2Cl2∶MeOH,100∶1~1∶1)进行梯度洗脱,共得到 12个流分(Fr.1 ~ Fr.12),其中 Fr.3 ~Fr.5 部分依次采用 Sephadex LH-20柱色谱及ODS柱色谱并结合制备液相分离纯化得到化合物1(8 mg)、化合物2(12 mg)、化合物3(12 mg)、化合物 4(11 mg)、化合物 5(13 mg)、化合物 6(21 mg)、化合物7(16 mg)、化合物8(15 mg)。
2.2 结构鉴定
共分离得8个化合物,通过核磁共振光谱数据与文献[11 - 16]对比,确定为 Glaucoside A(1),Glaucoside H(2),Cynatratoside A(3),Cynatratoside C(4),Cynatratoside E(5), Mooreanosid H(6), Sublanceoside L2(7),Sublanceoside H2(8)。
Glaucoside A(1):无 定 形 粉 末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.86(3H,s,H - 19),1.51(3H,s,H -21),5.42(1H,m,H -6),6.46(1H,s,H -18),1.25(3H,d,J=6.2 Hz,H -6′),1.34(3H,d,J=6.2 Hz,H - 6″),1.40(3H,d, J = 6.2 Hz,H - 6苁 ),3.35(3H,s,C - 3′- OCH3),3.57(3H,s,C - 3苁 - OCH3),5.16(1H,d, J = 9.6,1.8 Hz,H -1′),5.21(1H,d, J =9.6,1.8 Hz,H - 1″),5.05(1H,d,J = 4.0,2.0 Hz,H - 1苁 )。
Glaucoside H(2):无 定 形 粉 末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.85(3H,s,H - 19),1.50(3H,s,H -21),5.41(1H,m,H -6),6.45(1H,s,H -18),1.24(3H,d, J=6.2 Hz,H -6′),1.30(3H,d, J=6.2 Hz,H - 6″),1.40(3H,d, J = 6.2 Hz,H - 6苁 ),3.40(3H,s,C -3′- OCH3),3.58(3H,s,C -3苁 -OCH3),5.35(1H,m,J=8.0 Hz,H - 1′),5.18(1H,dd,J =9.4,2.0 Hz,H - 1″),5.16(1H,d, J = 8.0 Hz,H - 1″″′),4.95(1H,d,J= 7.6 Hz,H - 1″″),4.92(1H,d,J = 3.6 Hz,H - 1苁)。
Cynatratoside A(3):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.80(3H,s,H - 19),1.51(3H,s,H -21),5.35(1H,m,H -6),6.42(1H,s,H -18),1.58(3H,d, J = 6.0 Hz,H - 6′),3.42(3H,s,C -3′-OCH3),4.82(1H,dd,J = 9.6,1.6 Hz,H - 1′)。
Cynatratoside C(4):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.80(3H,s,H - 19),1.52(3H,s,H -21),5.35(1H,m,H -6),6.42(1H,s,H -18),1.50(3H,d,J =6.2 Hz,H -6′),1.42(3H,d, J =6.0 Hz,H - 6″),1.42(3H,d, J = 6.0 Hz,H - 6苁 ),3.28(3H,s,C -3′-OCH3), 3.53 (3H, s, C - 3苁 -OCH3), 5.04(1H,dd, J=9.2,1.6 Hz,H -1′),5.50(1H,dd, J=9.2,1.6 Hz,H - 1″),5.21(1H,d, J = 3.5 Hz,H - 1苁 )。
Cynatratoside E(5):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.80(3H,s,H - 19),1.51(3H,s,H -21),5.41(1H,m,H - 6),6.43(1H,s,H -18),1.60(3H,d,J =4.7 Hz,H -6′),1.43(3H,d, J =4.7 Hz,H - 6″),1.42(3H,d, J = 5.2 Hz,H - 6苁 ),3.53(3H,s,C - 3′- OCH3),3.46(3H,s,C - 3苁 - OCH3),4.80(1H,dd, J = 9.2,1.6 Hz,H - 1′),4.70(1H,dd, J = 9.2,1.6 Hz,H - 1″),4.51(1H,dd, J = 11.2,2.4 Hz,H -1苁 ),5.07(1H,br.d,J = 7.8 Hz,H - 1″″)。
Mooreanosid H(6):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.87(3H,s,H - 19),1.52(3H,s,H -21),5.41(1H,m,H -6),6.45(1H,s,H -18),1.32(3H,d, J= 3.2 Hz,H - 6′),1.33(3H,d, J=3.2 Hz,H - 6″),1.68(3H,d, J = 6.5 Hz,H - 6苁 ),3.49(3H,s,C -3′-OCH3),3.49(3H,s,C -3″-OCH3),3.59(3H,s,C -3苁 -OCH3),4.76(1H,dd, J=9.2,1.6 Hz,H - 1′),5.20(2H,m, J = 9.6,1.2 Hz,H - 1″),5.00(2H,m,J=8.0 Hz,H - 1苁 )。
Sublanceoside L2(7):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.85(3H,s,H - 19),1.51(3H,s,H -21),5.41(1H,m,H -6),6.45(1H,s,H -18),1.24(3H,d, J= 6.0 Hz,H - 6′),1.36(3H,d, J=6.0 Hz,H -6″),1.51(3H,d, J=6.0 Hz,H -6苁 ),3.30(3H,s,C - 3′- OCH3),3.59(3H,s,C -3″- OCH3),5.34(1H,d, J =9.3 Hz,H -1′),5.21(1H,d, J=8.0 Hz,H - 1苁),5.15(1H,d,J = 9.2 Hz,H - 1″″),5.13(1H,d, J = 2.2 Hz,H - 1″)。
Sublanceoside H2(8):无定形粉末 (MeOH),Liebermann-Burchard(+),Keller-Kiliani(+)。1H-NMR(C5D5N,400 MHz)δ:0.85(3H,s,H - 19),1.50(3H,s,H -21),5.40(1H,m,H -6),6.45(1H,s,H - 18),1.24(3H,d, J=6.0 Hz,H -6′),1.39(3H,d, J =6.2 Hz,H - 6″),1.50(3H,d, J = 6.2 Hz,H - 6苁),3.30(3H,s,C - 3′- OCH3),3.58(3H,s,C - 3″- OCH3),5.31(1H,d, J=9.2 Hz,H -1′),5.22(1H,d, J=8.0 Hz,H -1苁 ),5.17(1H,d, J = 9.2 Hz,H - 1″″),5.16(1H,d, J =2.2 Hz,H - 1″)。
各化合物13C-NMR数据见表1。
3 讨论
鹅绒藤属植物在全球有200余种,我国境内分布有近50种。白薇作为鹅绒藤属植物的代表植物,在我国有上千年的应用历史,皂苷类成分是白薇的活性成分,但基于单体化学成分研究较少,尚有待开发。本研究中采用常规提取分离技术对白薇的乙醇提取物化学成分进行研究,共分离得到8个皂苷类成分,经过核磁共振光谱分析确定全部结构,均为从该植物中首次分离得到,且具有相似结构。同类结构的富集,对于其药用植物的质量评价及药理活性研究具有明确的指导意义,可为传统中药白薇的后续开发奠定坚实的基础。
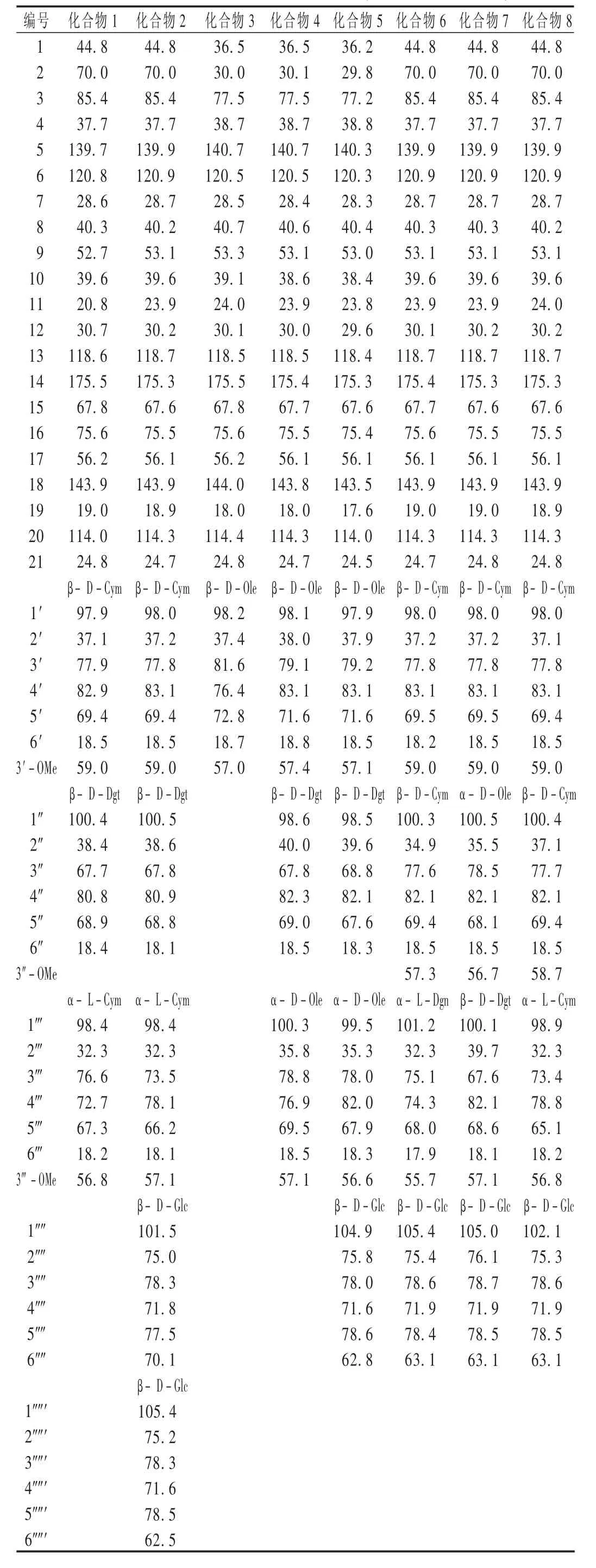
表1 各化合物13C-NMR数据(C5D5N,100 MHz)

