腹腔镜经腹入路和经腹膜外入路在肾下极水平以上原发性腹膜后肿瘤切除术中的应用
谢学海 陈依然 马永蔌 何志嵩 吴问汉
(北京大学第一医院普通外科,北京 100034)
腹膜后肿瘤是一类起源于腹膜后结缔组织中筋膜、脂肪、血管、神经及胚胎残留组织的肿瘤。除淋巴瘤外,大多数腹膜后肿瘤的治疗以手术切除为主[1]。传统开放手术切口大,术后疼痛明显。随着腹腔镜器械的发展和技术的提高,腹腔镜手术应用于原发性腹膜后肿瘤的治疗[2~6],且有2种入路,经腹入路和经腹膜外入路,后者也称为后腹腔镜技术。经腹膜外入路的主要优势是对腹腔脏器的影响小,但与经腹入路相比,存在缺少解剖标志、操作空间小等不足[7]。本文回顾性分析2013年1月~2018年10月我院2种入路腹腔镜手术治疗69例肾下极水平以上原发性腹膜后肿瘤的临床资料,探讨经腹入路和经腹膜外入路在原发性腹膜后肿瘤中的应用。
1 临床资料与方法
1.1 一般资料
本研究69例,男29例,女40例。年龄16~77岁,平均47岁。临床表现腹部疼痛9例,腰痛3例,可触及腹部肿物6例,余51例因体检或其他原因行腹部影像学检查发现腹部肿物就诊。术前均行腹部增强CT或MR检查,肿瘤长径3~14 cm,(6.0±2.3)cm,提示位于肾下极水平以上良性或边界清楚的恶性肿瘤。既往无腹部手术史。以下腔静脉为中线,将腹部分为左、右侧,医生根据经验选择入路,经腹入路35例(经腹入路组),经腹膜外入路34例(经腹膜外入路组),2组一般资料除肿瘤位置有差异外,其他指标差异无显著性(P>0.05),见表1。
病例选择标准:影像学上提示肾下极水平以上,边界清楚,包膜完整,未侵犯周围毗邻血管和器官的原发性腹膜后肿瘤,既往无腹部手术史,排除肾上腺来源肿瘤。
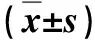
表1 2组一般资料比较
*4例囊性肿瘤长径分别为7、6、8、3 cm;实性肿瘤中,长径>7 cm共20例(经腹入路组13例,经腹膜后入路组7例)
1.2 方法
1.2.1 经腹入路 全身麻醉,平卧或平卧分腿位。脐周穿刺建立CO2气腹,气腹压力14 mm Hg,于左右侧腹部锁骨中线平脐和腋前线脐上3 cm处各放置1个trocar。肿瘤位于右上腹,术者站在患者左侧,主操作孔为左侧腋前线脐上处;肿瘤位于左上腹,术者站在患者右侧,主操作孔为右侧锁骨中线平脐处。对于右上腹的腹膜后肿瘤,经Kocher切口游离十二指肠,并游离结肠肝区,可显露右侧腹膜后间隙内的肾上腺、右肾静脉,以及下腔静脉。对于左上腹的腹膜后肿瘤,需游离结肠脾曲,并切开胃结肠韧带,进入胰后间隙,显露左肾上腺,左肾静脉以及腹主动脉。胰腺后方的肿瘤也可以通过切开胃结肠韧带或肝胃韧带进入小网膜囊,游离胰腺上下缘,显露肿瘤(图1A~C)。肿瘤显露后,采用超声刀或电钩逐步游离肿瘤侧方和后方组织,夹闭切断肿瘤滋养血管。肿瘤完整切除后(图1D)置入标本袋内,经脐周扩大切口或腹部戳孔延长后取出。创面冲洗后仔细止血,放置引流管1~2根(图1)。
1.2.2 经腹膜外入路 全身麻醉,健侧卧位,腰部垫高。第12肋下缘脐后线交点取长约3 cm斜行切口,止血钳钝性分离肌肉进入腰背筋膜内腹膜外脂肪,手指扩张腹膜后腔隙,放入手套,注入空气600~800 ml,扩张腹膜后间隙,置入10 mm trocar,术者手指引导下于腋中线髂嵴上2 cm和腋前线与11肋交界内下方3 cm处分别置入5、10 mm trocar,必要时可在2个trocar间中点处放置一5 mm trocar,维持后腹腔压力在14 mm Hg。辨认腰大肌等解剖标志,向内侧打开肾周筋膜,显露肾周间隙及肾上极,沿肾上极向肾脏腹侧分离,充分分离肾上腺周围脂肪。根据影像学定位了解肿瘤位置后,分离暴露肿瘤,沿包膜或假包膜内分离切除肿瘤,注意保护周围器官及血管。肿瘤滋养血管夹闭后切断,完整切除肿瘤,置入标本袋内取出标本。
图1 女,24岁,术前诊断原发性腹膜后肿瘤,术后病理为节细胞神经瘤 A,B.术前CT显示肿瘤大小约8 cm×6 cm×5 cm,位于胰腺后上方,肝左叶后下方,下方紧邻腹腔干,后方紧邻下腔静脉与腹主动脉;C.肿瘤位于胰腺后上方,与腹腔干关系密切;D.肿瘤切除后(Tumor:肿瘤,CA:腹腔干,P:胰腺,PV:门静脉,SMA:肠系膜上动脉,IVC:下腔静脉,AA:腹主动脉,LGA:胃左动脉)
1.3 观察指标
手术时间(放置第1个trocar至缝合全部切口)、术中出血量(麻醉单记录)、术后排气时间、术后住院时间(出院标准:患者恢复良好,进食可,拔除引流管)。
1.4 随访
术后定期(良性肿瘤术后每年随访1次;恶性肿瘤术后前2年每3个月随访1次,2年后每半年随访1次,5年后每年随访1次,超声、CT或MR检查)门诊和电话方式进行随访,了解肿瘤复发以及患者生存情况,随访截止2018年12月31日。
1.5 统计学处理
2 结果
联合脏器切除1例:1例左侧腹膜后高分化脂肪肉瘤经腹膜外入路行腹膜后肿瘤切除,见肿瘤累及左侧肾上腺,联合左肾上腺切除。中转开腹2例:1例经腹入路,肿物与腹主动脉及十二指肠关系密切,中转开腹,术后病理为Castleman病,透明血管型;1例经腹膜外入路,肿瘤与左肾动脉及腹主动脉关系密切,因术中左肾动脉损伤(出血量1500 ml)中转,术后病理为异位嗜铬细胞瘤。经腹膜外入路组术后乳糜漏1例,经禁食水、保持引流通畅等保守治疗后治愈。2组手术时间差异无显著性,经腹入路组出血量明显多于经腹膜外入路组(P<0.05),
经腹膜外入路组术后排气时间、术后住院时间明显短于经腹入路组(P<0.05),见表2。
术后病理良性肿瘤59例:异位嗜铬细胞瘤16例,神经鞘瘤12例,Castleman病5例,节细胞神经瘤6例,平滑肌瘤5例,副神经节瘤3例,脂肪瘤1例,淋巴管瘤2例,畸胎瘤1例,良性囊性黏液性肿瘤1例,良性囊性间皮瘤1例,良性囊肿1例,胃重复1例,神经纤维瘤1例,纤维来源肿瘤1例,肾上腺髓细胞脂肪瘤1例,血管周细胞肿瘤1例;恶性肿瘤10例:高分化脂肪肉瘤5例,平滑肌肉瘤3例,恶性嗜铬细胞瘤1例,分化不确定的软组织肉瘤1例。69例随访2~72个月(中位数36.5月),超声、CT或MR检查未见复发和转移,1例62岁神经鞘瘤术后30个月死于脑出血。
表2 2组手术效果比较
*Fisher精确检验
3 讨论
手术切除是原发性腹膜后肿瘤最有效的治疗方法。传统原发性腹膜后肿瘤切除多为开放手术,但原发性腹膜后肿瘤本身常呈膨胀性生长,多数有包膜或者假包膜,为腹腔镜手术切除提供可能。随着微创外科的发展,腹腔镜技术现已被广泛应用于原发性腹膜后肿瘤的手术切除。
在原发性腹膜后肿瘤切除术中,术前影像学检查和血管重建技术明确肿瘤本身与毗邻器官和血管的关系,是手术是否能够顺利进行的关键[8]。与传统开放手术一样,原发性腹膜后肿瘤的腹腔镜手术可分为经腹与经腹膜外入路。本研究2组年龄、性别、肿瘤良恶性、肿瘤囊实性、肿瘤长径无统计学差异(P>0.05),但经腹入路组肿瘤位于下腔静脉左侧26例(74.3%),经腹膜外入路组肿瘤位于下腔静脉左侧14例(41.2%),存在显著性差异(χ2=7.760,P=0.005),本研究结果显示2种入路手术时间差异无显著性(t=1.659,P=0.102),但出血量经腹入路组显著多于经腹膜外入路组(Z=-2.454,P=0.014),可能的原因是下腔静脉左侧存在腹主动脉以及腹腔干、肠系膜上动脉等重要血管,经腹入路操作空间大,容易处理腹膜后肿瘤与重要血管的关系。因此,提示与周围器官及血管毗邻的肿瘤更多采用经腹入路为宜。
经腹膜外入路操作直达腹膜后间隙,手术过程不受腹腔脏器的干扰,对腹腔的内环境影响较小,术后胃肠道功能恢复快[9]。本研究结果显示经腹膜外入路组术后排气时间、术后住院时间明显短于经腹入路组(P<0.05)。位于肾下极水平以上的原发性腹膜后肿瘤,经腹和经腹膜后入路都可以显露肿瘤。2种入路的选择取决于肿瘤与周围器官血管的毗邻,以及术者本身的经验。
牟一平等[10]认为直径≤6 cm良性肿瘤较为适合腹腔镜手术。我们认为边界清楚,包膜完整,未侵犯周围器官和血管的腹膜后肿瘤是腹腔镜手术适应证,即使较大的肿瘤,只要能够建立充分的操作空间,亦可以完成腹腔镜下手术。本研究实性肿瘤长径最大14 cm,为1例畸胎瘤,>7 cm实性肿瘤经腹入路组13例,经腹膜后入路组7例,均顺利完成腹腔镜下切除。肿瘤可通过延长切口至肿瘤短径取出。因此,本研究的病例选择标准时肿瘤大小无特别要求。
腹腔镜切除腹膜后恶性肿瘤[11]仍广受争议。Ahn等[6]建议对术前影像学检查提示为恶性肿瘤或者术中冰冻切片分析为恶性肿瘤者选择开腹或中转开腹手术。我们认为腹膜后恶性肿瘤是一类涵盖不同生物学行为和病理学特点肿瘤的宽泛定义。对于某些包膜完整未侵犯邻近脏器的恶性肿瘤,腹腔镜本身并不增加手术难度。本研究10例腹膜后恶性肿瘤行腹腔镜切除,随访期内未见复发或转移,但病例少,随访期短,腹腔镜手术对于腹膜后恶性肿瘤的有效性尚需大宗病例及长期随访结果。
总之,腹膜后肿瘤的手术切除较少涉及消化道重建,在掌握娴熟的腹腔镜操作技巧的基础上,腹腔镜腹膜后肿瘤切除安全、有效,具有微创优势,具体的手术入路选择取决于肿瘤的位置、毗邻关系以及术者的经验。

