再发性剖宫产瘢痕妊娠10例分析
姚 颖 王 超 曲·启明 杨 艳 卢 珊 梁华茂
(北京大学第三医院妇产科,北京 100191)
再发性剖宫产瘢痕妊娠(recurrent cesarean scar pregnancy,RCSP)指剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)患者成功治疗后(病灶完全清除、hCG降至正常),后续妊娠时再次出现CSP。近年来,CSP患病率不断升高,病因尚不明确,对于有再生育需求的剖宫产史孕妇而言,反复发生的CSP将严重影响妊娠质量及预后。目前,关于RCSP多为个案报道,治疗方案各不相同。本文对2002年1月~2018年10月我院诊治10例RCSP的临床资料进行分析,总结RSCP的临床特征、影像学特点以及处理选择,旨在为RCSP的诊治提供参考。
1 临床资料与方法
1.1 一般资料
本组10例。初次CSP情况:年龄26~35岁,平均29.5岁。4例阴道出血,5例无症状,1例腹痛。就诊时5~12孕周,平均7.9孕周。hCG水平3070~156 649 IU/L。6例既往2次剖宫产史,4例1次剖宫产史。既往剖宫产9例足月剖宫产,1例早产剖宫产;6例急诊剖宫产,4例择期剖宫产。CSP发生距离末次剖宫产1.5~8年,其中<2年1例,3~5年6例,>5年3例。既往2、1、0次人工流产病史分别为2、6、2例。治疗情况:1例(病例6)因清宫术中出血800 ml行球囊压迫后MTX保守治疗。余9例中,3例应用MTX后手术,6例直接手术;4例单纯宫腔镜妊娠病灶清除,5例行介入子宫动脉栓塞或经腹子宫动脉阻断后行宫腔镜手术,出血均<50 ml。
RCSP情况:年龄27~42岁,平均32.2岁。RCSP与前次CSP间隔0.5~8年,其中<1年1例,1~2年5例,3~5年3例,>5年1例。就诊时5~8孕周,平均6.3孕周。8例阴道出血,1例腹痛,1例无症状。hCG 11 502~284 260 IU/L。
10例一般资料见表1。第1~9例为剖宫产后初次及第2次CSP,其中RCSP均发生在2015年后;第10例首次CSP在当地医院清宫,第2、3次CSP在我院处理,发生于2013、2015年。除1例清宫术前超声未提示CSP,因术中出血多终止手术后完善MR诊断CSP,其余9例通过病史、血hCG、经阴道超声诊断CSP,MR及手术进一步确定CSP诊断。
参照《2016年剖宫产术后子宫瘢痕妊娠诊治专家共识》中的分型方法进行超声分型[1]。前后2次CSP均行盆腔MR检查,按照MRI进行瘢痕分型。主要测量指标:子宫瘢痕及妊娠囊着床显示最清楚的矢状位,测量瘢痕部位剩余肌层厚度(T)、瘢痕缺陷近宫腔面肌层缺失宽度(L1)、瘢痕缺陷近浆膜面肌层缺失宽度(L2),见图1。根据L1/L2值对剖宫产妊娠时瘢痕局部的形态进行剖宫产瘢痕形态分型:L1/L2<5时,剖宫产瘢痕的形态为梯型;反之,L1/L2>5时,瘢痕呈三角形。
年龄等左右分别是第1、2次CSP的临床资料(*第10例为第2、3次CSP)
a.2次CSP间剖宫产分娩1次;b. 2次CSP间人工流产1次;c.第2次CSP术后1年剖宫产分娩
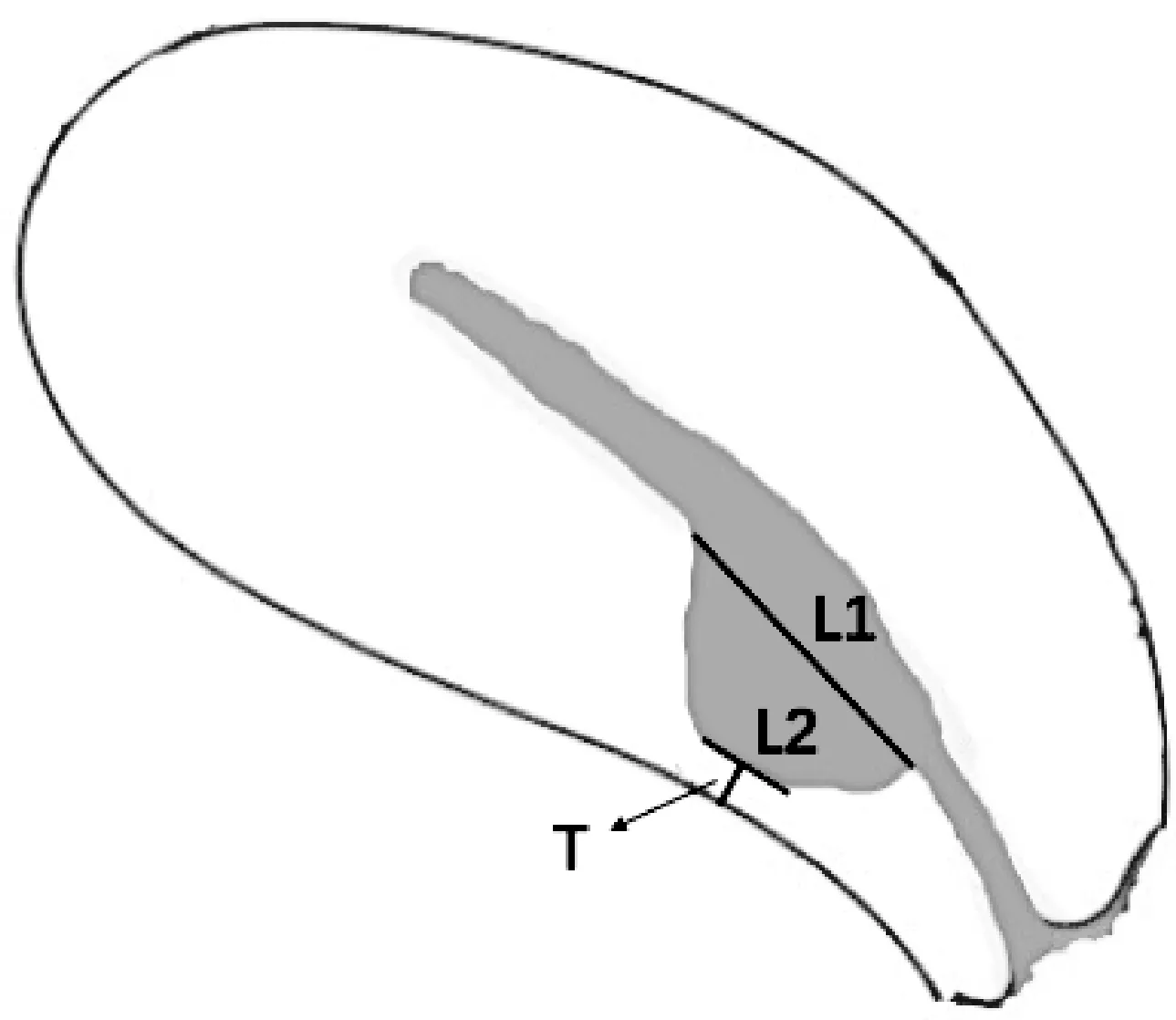
L1瘢痕缺陷近宫腔面肌层缺失宽度,L2瘢痕缺陷近浆膜面肌层缺失宽度,T瘢痕部位剩余肌层厚度图1 CSP形态分型MR测量示意图
1.2 方法
药物治疗主要为注射用甲氨蝶呤(50 mg/m2肌肉注射),手术治疗包括清宫术、子宫动脉栓塞术、腹腔镜子宫动脉阻断术、宫腔镜下妊娠病灶清除术,经阴道/开腹/腹腔镜剖宫产瘢痕部位切除、子宫修补等[1]。再次CSP主要根据患者hCG、瘢痕厚度、瘢痕部位肌层缺失的情况由主治医师进行治疗选择,如瘢痕缺失过大行瘢痕切除、子宫修补方法清除病灶,余直接行清宫术。
1.3 随访
术后定期监测hCG下降情况,术后2个月门诊常规复查,其后对10例进行门诊及电话随访月经及妊娠情况,末次随访时间2018年12月。
1.4 统计学处理

2 结果
2.1 RCSP妊娠特点
除1例(病例3)第1次CSP后成功妊娠,足月剖宫产分娩,1例(病例4)术后第1次妊娠为宫内妊娠行人工流产外,其余患者均在第1次CSP术后再次妊娠时妊娠组织再次种植于原剖宫产瘢痕处。RCSP确诊孕周比初次CSP早,但差异无显著性[(6.3±1.0)周vs.(8.0±1.8)周,t=2.055,P=0.070]。
2.2 影像学特点
初次CSP超声分型3例Ⅲ型,7例Ⅱ型。再次CSP 1例Ⅰ型,6例Ⅱ型,3例Ⅲ型,5例类型同前,5例发生变化。CSP和RCSP患者影像学特点见表2。
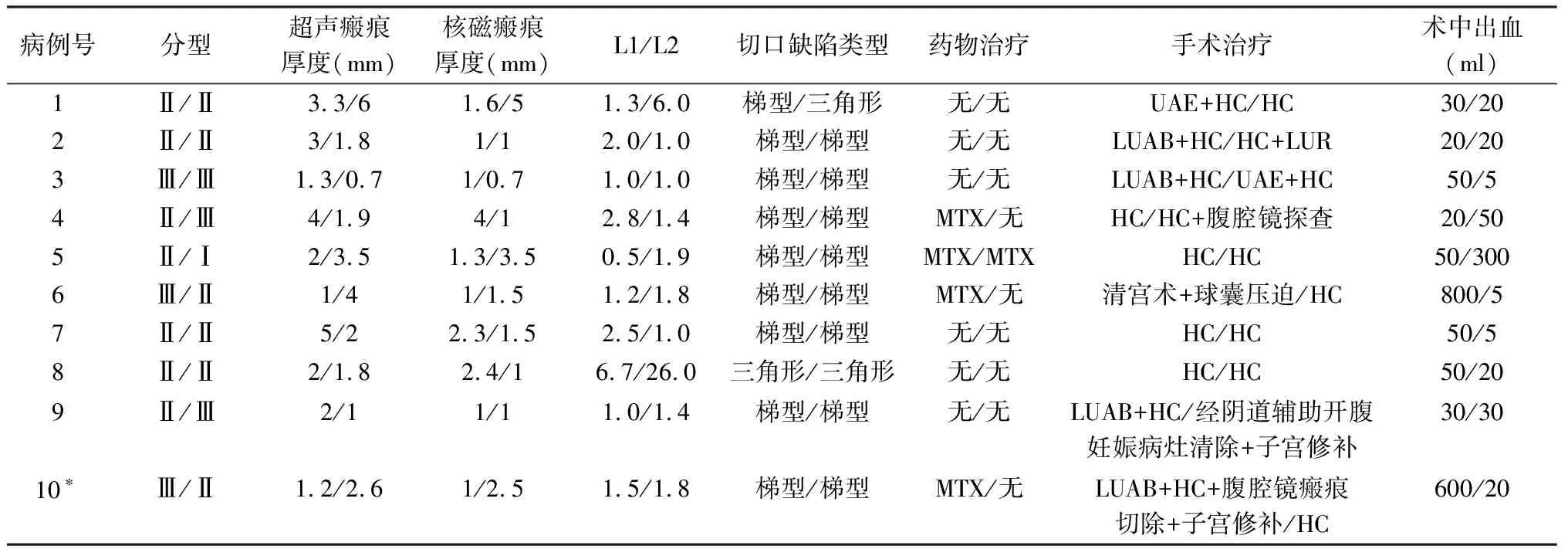
表2 10例RCSP影像学特征及手术情况
年龄等左右分别是第1、2次CSP的临床资料(*第10例为第2、3次CSP)
HC:宫腔镜妊娠病灶清除术( hysteroscopy and curettage);UAE:子宫动脉栓塞术(uterine artery embolization);LUAB:腹腔镜子宫动脉阻断术(laparoscopic uterine artery blockage);LUR:腹腔镜子宫修补术(laparoscopic uterine repair)
2.2.1 剖宫产瘢痕厚度 初次CSP时,超声测量剖宫产瘢痕部位厚度1~5 mm,平均2.48 mm,MR测量切口厚度1~4 mm,平均1.66 mm。再次CSP超声测量瘢痕部位厚度1~6 mm,平均2.53 mm,MR测量瘢痕部位厚度1~5 mm,平均1.87 mm。10例20次CSP中,19次MR测量的切口厚度比超声薄,超声测量厚度(2.50±1.42)mm,核磁测量切口厚度(1.76±1.18)mm,最大差值2.7 mm,平均0.74 mm,两者比较差异有显著性(t=3.774,P=0.001)。
2.2.2 剖宫产瘢痕部位形态 初次CSP和再次CSP时,剖宫产瘢痕缺陷均以梯型为主,且缺陷类型在2次CSP中基本不变。病例1初次CSP时瘢痕缺陷为梯形,RCSP时瘢痕缺陷为三角形。
2.3 治疗情况
1例因hCG>200 000 IU/L给予MTX注射,1例行子宫动脉栓塞预处理后手术,余8例直接手术。1例因肌层缺失过多(瘢痕缺陷类型梯形,缺失部分宽34 mm)行开腹瘢痕切除局部修补术,9例单纯行宫腔镜妊娠病灶清除(2例因可疑穿孔行腹腔镜探查,均因子宫前壁切口局部浆膜层渗血行腹腔镜下子宫修补术)。术中出血均小于50 ml(表2)。
病例10为4次CSP的特殊病例。24岁孕7个月因完全性前置胎盘出血急诊剖宫产,早期新生儿死亡。26岁孕5周CSP介入治疗后清宫。29岁孕8周CSP行腹腔镜双侧子宫动脉阻断、宫腔镜妊娠病灶清除,术中因出血多行腹腔镜下剖宫产瘢痕局部切除及修补,连续缝合切口两层。31岁时孕6周CSP行宫腔镜妊娠病灶清除。32岁因复查MR提示剖宫产瘢痕愈合不良行开腹剖宫产瘢痕切除修补,全层缝合切口1层,连续缝合浆肌层1层;术后1年复查MR提示子宫下段愈合良好,无瘢痕缺陷,肌层连续,瘢痕部位肌层厚6.5 mm。34岁妊娠仍为CSP,行宫腔镜下清宫手术。目前35岁,有妊娠要求。
2.4 随访情况
2次CSP术后hCG 1个月内降至正常,术后2个月内月经恢复。截止2018年12月,除病例10外,1例(病例6)术后1年妊娠足月剖宫产分娩一活婴,1例(病例1)术后1年复查MR瘢痕愈合良好,有妊娠计划,余7例RCSP后均无妊娠计划,月经规律,严格避孕中,未再妊娠。
3 讨论
既往报道CSP的发生率为1∶2216~1∶1800,占有剖宫产史妇女的1.15%[1,2]。近年来,我国剖宫产率不断升高,2014年达到54.47%[3]。2015年全面开放二孩政策后,大量剖宫产史女性再孕,剖宫产并发症之一CSP的患病率也因此不断升高。既往报道中CSP患者多为避孕失败后发生CSP,治疗后无再生育要求,因此,RCSP的相关报道较少。随着国家生育政策的不断调整,育龄女性对再生育需求的增加,RCSP的发生可能逐步增加,因此,其相关特征、处理及预后情况值得深入研究。
对于CSP患者成功治疗后再次出现CSP,国外文献多用recurrent cesarean scar pregnancy,国内文献资料多命名为复发性CSP或重复性CSP[4~6],我们认为“复发性”更倾向于疾病治疗后存在潜伏倾向,如恶性肿瘤等,“重复性”强调性质类似,“再发性”更能体现疾病再次出现,但与前一次发病并无绝对关联,故认为定义为再发性剖宫产瘢痕妊娠更为准确。
3.1 RCSP的病因
CSP的发病机制并不明确,一般认为与剖宫产瘢痕缺陷、瘢痕部位血管少符合滋养细胞侵入低氧条件、损伤后炎症细胞募集等有关[4]。胚胎着床位置较低时,子宫前壁下段手术瘢痕部位存在解剖缺陷,受精卵可通过内膜上的微小裂隙侵入子宫肌层着床在瘢痕上,从而形成CSP[7]。
CSP治疗后患者再次妊娠后发生RCSP的几率明显升高,文献[6~9]报道4.7%~40%。Qian等[10]报道RCSP的高危因素有农村或社区医院行剖宫产、初次CSP时有不规则出血或下腹痛、初次CSP终止妊娠时间≤孕56 d等。Chen等[11]研究显示人流≥4次以及CSP后再次妊娠间隔>2年者更容易发生RCSP。本组人工流产≤2次,初次CSP的症状、2次CSP之间的间隔没有显示规律性,但9例初次CSP时距离前次剖宫产≥3年,提示再次妊娠时距离剖宫产的时间≥3年需要警惕RCSP的发生。Rotas等[12]研究认为剖宫产次数不是CSP的高危因素,但本组6例2次剖宫产史,1例早产剖宫产后反复CSP,提示2次以上剖宫产及未足月剖宫产后出现RCSP的风险增加。
Yamaguchi等[13]研究8例CSP,其中1例发生RCSP,发现具有楔形瘢痕缺陷或憩室的CSP容易发生RCSP。Qian等[10]报道子宫下段瘢痕厚度<5 mm、初次CSP时妊娠囊突向膀胱反折腹膜容易发生RCSP。本研究中初次CSP中有9例瘢痕缺损为梯型,缺损宽度大,提示RCSP可能与多次剖宫产以及子宫下段形成不良时瘢痕愈合状态欠佳相关。1例初次CSP瘢痕缺损为梯形,RCSP时为三角形,是唯一瘢痕形态发生变化的,该例2次CSP间隔8年,提示初次CSP术后,由于某些因素包括手术本身的影响,是否随着时间延长,剖宫产瘢痕仍有自我修复和重塑的可能。
3.2 RCSP的诊断
RCSP、CSP与普通妊娠相比并无特异性临床表现,因此,早孕超声检查对诊断至关重要[4]。超声检查经济简便,可以定位妊娠囊的位置,判断妊娠囊与子宫前壁下段肌层及膀胱的关系,是CSP的首选检查。本研究结果表明,由于首次CSP行手术治疗时宣教充分,患者再次妊娠后均能及时就诊,尽早行超声检查,RCSP的诊断孕周比初次CSP妊娠平均早1.5周,从而使治疗能够及时进行。
MR对软组织分辨率高,能够清楚显示妊娠组织着床的位置和与瘢痕的关系,但因费用高,并未作为CSP诊断常规方法。本组显示核磁测量的瘢痕部位剩余肌层厚度几乎均比超声测量值低,且部分超声下瘢痕厚度>3 mm时核磁厚度仅1 mm或仅剩余浆膜层,差异有显著性(P=0.001),说明超声测量子宫肌层厚度可能出现误差。另外,通过核磁还能更好的对切口的形态进行判断,如果局部瘢痕缺陷为梯型,提示发生RCSP的几率升高,应该充分交代再妊娠时发生RCSP的风险。因此,建议有条件的医院将核磁作为CSP的常规检查,并且建议建立基于核磁的CSP分型。
3.3 治疗选择
由于受胚胎存活情况、胚胎着床位置、瘢痕局部种植情况、瘢痕部位肌层厚度、hCG水平等因素影响,CSP的治疗方式多样,无统一标准,主要包括药物和手术治疗。
甲氨蝶呤常被用于Ⅱ、Ⅲ型CSP患者手术前的预处理,以阻止妊娠的进一步发展,降低术中出血的风险。我们认为只要不是局部妊娠病灶向膀胱明显突出、不存在局部血流信号极其丰富、hCG超高的情况,在CSP妊娠周数较小时,绒毛与瘢痕附着相对不紧密的情况下直接宫腔镜手术更为容易。本研究中绝大部分RCSP为Ⅱ、Ⅲ型,hCG均值80 000 IU/L,9例术前并未用MTX,术中出血不多,术后亦未出现hCG下降不良,说明术前用药并不是处理Ⅱ、Ⅲ型RCSP的必要步骤。
尽管7例RCSP为瘢痕厚度<3 mm的Ⅱ~Ⅲ型RCSP,除1例瘢痕缺陷过宽(超过30 mm)的RCSP术前采用栓塞术外,其余9例宫腔镜手术均能完整清除病灶,术中出血均不超过50 ml,提示RCSP可能并不是出血多及清宫不全的高危因素。但需要注意2例RCSP术中可疑穿孔均为肌层厚度为1 mm梯形切口,提示临床上对于RCSP患者,如果核磁提示梯型切口,瘢痕局部肌层菲薄,单纯宫腔镜手术/清宫手术有较高的穿孔风险。但这2例首次手术并未出现类似情况,是否与瘢痕局部菲薄,反复CSP后瘢痕更薄弱有关,尚需要扩大样本观察。
曾经认为对于有再妊娠要求的CSP患者,建议同时行瘢痕切除及修补[14,15]。然而Maheux-Lacroix等[16]回顾11篇文献显示,腹腔镜或经阴道瘢痕切除及修补并没有降低RCSP的发病率。本组第10例也证实了这一点,即使是开腹修复双层缝合,复查MR不存在瘢痕部位缺陷,肌层厚度足够的情况下,患者仍然发生RCSP。说明瘢痕切除及修补可能无法降低RCSP的发病率,也进一步提示CSP的发生不单单与瘢痕缺陷相关。
综上所述,建议将MR作为CSP的常规评估方法。对瘢痕缺陷进行形态学分型可能有助于预测发生RSCP的风险。RCSP术前药物预处理不是必要步骤;梯型切口瘢痕部位剩余肌层菲薄的RCSP如果单纯行宫腔镜手术,术中应警惕子宫穿孔。剖宫产局部瘢痕切除可能无法降低RCSP发生率。
本研究为回顾性分析,样本量较少,且大部分RCSP患者放弃再次妊娠,因此,缺乏RCSP术后再妊娠的资料。由于单中心的RCSP数量有限,需要多中心合作以获得更大样本量的数据资料,并对有妊娠需求的患者进行长期随访,以充分探索RCSP临床处理及再妊娠结局,为此类疾病的规范诊治提供更多依据。

