DeBakeyⅠ型主动脉夹层术后急性肾损伤的危险因素分析
急性主动脉夹层是一种危及生命的严重心血管疾病,分为DeBakeyⅠ、Ⅱ、Ⅲ型,开放性外科手术是胸主动脉夹层的主要手术方法[1]。急性肾损伤是心脏外科手术后常见的并发症,占手术患者的5%~30%[2],可增加患者术后致死性心血管疾病的发生率和死亡率[3-4]。明确急性主动脉夹层术后肾损伤的危险因素有助于针对性观测患者临床指标,为预防和减少术后急性肾损伤的发生提供干预依据,有助于改善患者预后,减少早期和远期死亡率。
1 对象与方法
1.1 病例资料
回顾性分析海军军医大学附属长海医院胸心外科2000年7月至2018年5月手术治疗的365例急性DeBakey Ⅰ 型主动脉夹层患者,其中男性272例,女性93例,年龄19~78岁,平均(49.46±12.81)岁,年龄>55.5岁124例(34%),年龄≤55.5岁241例(66%)。患者术前合并马凡综合征34例(9.3%),糖尿病15例(4.1%),高血压224例(61.3%),冠状动脉粥样硬化性心脏病(冠心病)11例(3.0%),术前肾功能异常66例(18.1%);有吸烟史104例(28.4%)。手术中心肺转流时间(CBPT)150.91(21~195)min,主动脉阻断时间(ACCT)90.91(37~184)min。术后二次开胸止血21例(5.8%)。
1.2 分组和相关定义
根据术后急性肾损伤发生情况将患者分为急性肾损伤组和无急性肾损伤组。参照RIFLE分类标准[5],术后血肌酐水平在7 d内较术前上升≥2倍或者肾小球滤过率下降50%以上即可诊断为术后急性肾损伤。术前肾功能异常是指术前检查中血肌酐或尿素氮水平高于正常值。住院死亡定义为术后住院期间死亡或经随访确定在转院后30 d内死亡。
1.3 统计学分析
采用SPSS 20.0软件对数据进行统计学分析。呈正态分布的计量资料使用均数±标准差表示,非正态分布的计量资料使用中位数和四分位间距表示,分别采用t检验或Mann-Whitney检验。计数资料以例数和百分比表示,采用卡方检验或Fisher精确检验。绘制年龄的受试者工作特征曲线(ROC曲线),选取单因素分析中P<0.05的变量对术后肾损伤的危险因素进行多因素条件logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般临床特征
在365例DeBakeyⅠ型急性主动脉夹层患者中,发生急性肾损伤者55例(急性肾损伤组),未发生急性肾损伤者310例(无急性肾损伤组),其中1例患者术后发生肾损伤,22 d后肾功能恢复。两组性别、身高、体质量、体质量指数(BMI)、吸烟史、动脉氧分压<95%的比例,合并症(高血压、糖尿病、冠心病),血小板-淋巴细胞比值(PLR)、中性粒细胞-淋巴细胞比值(NLR)、红细胞分布宽度(RDW)的差异均无统计学意义。 ROC曲线中约登指数=灵敏度+特异度-1,最大的约登指数所对应的临界值对于诊断试验具有较高的灵敏度及特异度。通过分析年龄诊断术后急性肾损伤的ROC曲线,约登指数最大时的临界值为55.5岁,可以作为最佳的诊断界值,见图1。急性肾损伤组年龄>55.5岁(P<0.001)、术前肾功能异常(P=0.002)、术前心包积液(P=0.005)、术前冠状窦撕裂(P=0.004)、合并马凡综合征(P=0.038)的比例均明显高于无急性肾损伤组,术前左室射血分数(LVEF)(P=0.037)明显低于无急性肾损伤组,见表1。
2.2 术后一般情况及单因素分析
365例患者术后死亡56例(15.3%),其中急性肾损伤组42例(75%),无急性肾损伤组14例(25%),两组术后死亡率的差异有统计学意义(P<0.001)。与无急性肾损伤组相比,急性肾损伤组术后并发脑卒中和感染的比例明显升高,ICU监护时间和住院时间明显延长,心肺转流时间(CBPT)、主动脉阻断时间(ACCT)、术中输注红细胞量、术中输注血小板量和术后24 h胸腔积液引流量均明显增加,而术后PLR明显降低(P均<0.05)。见表2。根据ROC曲线,术后24 h胸腔积液引流量诊断术后急性肾损伤的最佳诊断界值为745 mL。
2.3 多因素条件logistic回归分析
多因素条件logistics回归分析发现,急性主动脉夹层术后发生肾损伤的独立危险因素为年龄>55.5岁(OR=4.292,95%CI:2.069~8.900,P<0.001)、术前肾功能异常(OR=3.601,95%CI:1.632~7.945,P=0.002)、心包积液(OR=2.230,95%CI:1.113~4.469,P=0.024)、术后24 h胸腔积液引流量>745 mL(OR=3.023,95%CI:1.484~6.158,P=0.002)及术后PLR降低(OR=1.004,95%CI:1.001~1.006,P=0.018)。见表3。

图 1 年龄诊断术后急性肾损伤的ROC曲线

表1 两组术前变量的单因素分析
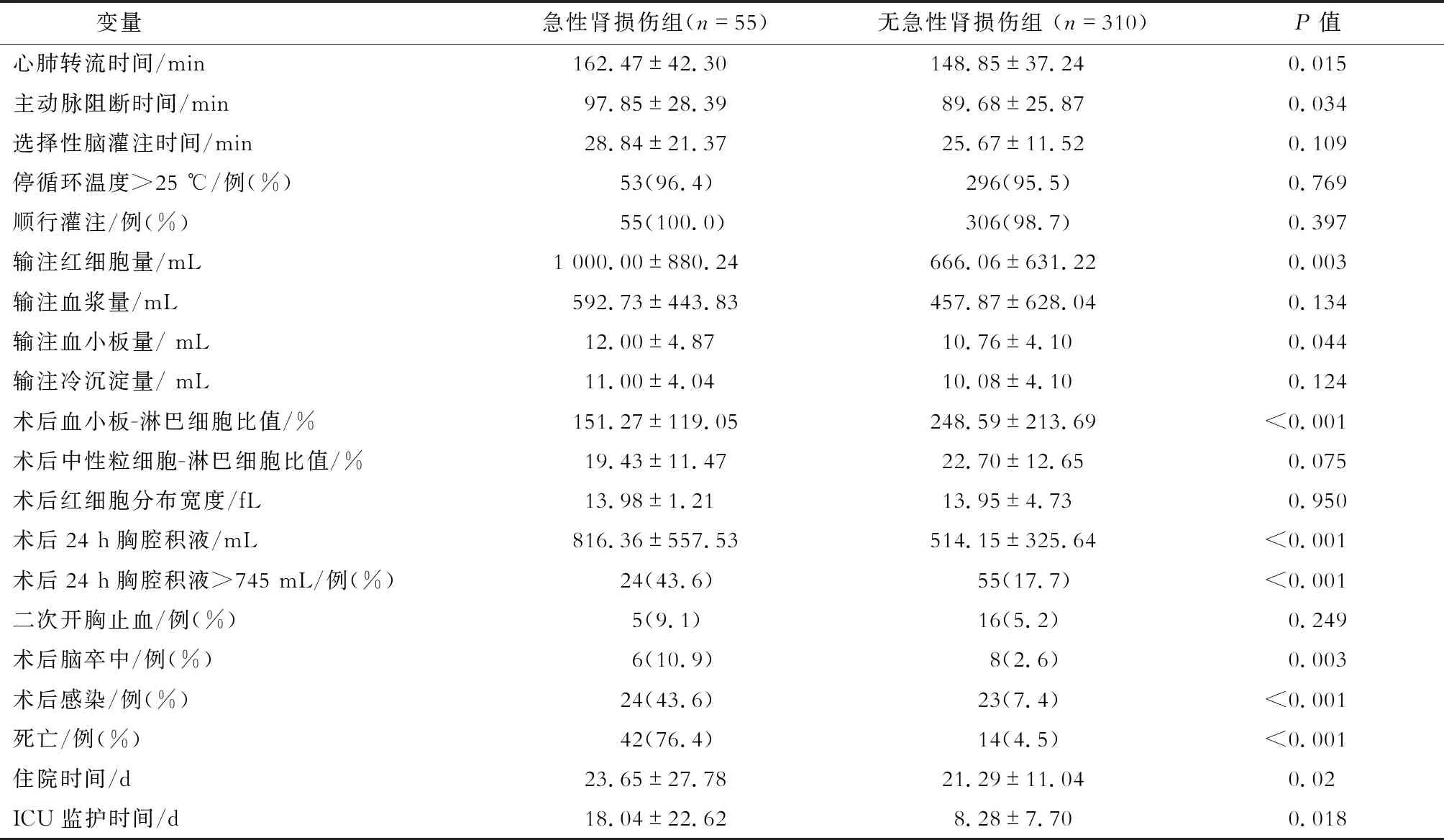
表2 两组术中与术后变量的单因素分析

表3 术后发生肾损伤的危险因素的多因素logistic回归分析
3 讨论
随着主动脉夹层手术方法、插管策略、脑灌注和温度管理等方面的改进,急性主动脉夹层患者的生存率有所提高[6-8]。主动脉无钳夹技术、深低温停循环技术(DHCA)以及心肺转流术后的顺行灌注进一步改善了主动脉夹层患者的长期预后[9]。尽管如此,主动脉夹层术后死亡率依然较高,影响 Ⅰ 型主动脉夹层手术患者预后的一个主要并发症是术后急性肾损伤[10]。目前认为心脏手术后发生急性肾损伤的主要危险因素包括高龄、高血压、术前肾功能异常、LVEF≤55%、术前血红蛋白<100 g/L、白蛋白<40 g/L、心肺转流时间≥180 min、手术时间>7 h以及大量输入红细胞等[8,11-14]。
随着年龄的增长,肾单位的减少、肾小球毛细血管压的增加等病理改变使急性主动脉夹层患者肾功能下降,耐受力降低[15]。主动脉夹层手术过程中低温、停循环、主动脉阻断等手术创伤可对肾功能造成损伤。已有研究表明年龄>70岁是急性主动脉夹层术后发生急性肾损伤的重要危险因素[13]。本研究发现,年龄>55.5岁是Ⅰ 型主动脉夹层术后发生肾损伤的独立危险因素,这可能与统计病例中患者高血压、冠心病等基础疾病的年轻化有关。
术前肾功能异常与心脏术后急性肾损伤的发生密切相关[14]。本研究也证实了术前肾功能异常是术后急性肾损伤的独立危险因素。急性主动脉夹层患者术前肾功能异常的发生主要是由于炎性反应、主动脉撕裂和心包积液引起肾脏灌注不全,而术中的体外循环导致肾脏灌注方式的改变和进一步的缺血再灌注损伤[16]。因此,术前肌酐、尿素氮水平的检测对预测急性肾损伤的发生具有一定的价值。
术前心包积液是主动脉夹层患者死亡的重要危险因素[17]。心包积液会引起心输出量和血压的下降,进而降低肾灌注量。有研究显示,单纯心包积液引起的急性肾损伤较为罕见[18],但本研究提示术前合并心包积液是Ⅰ型急性主动脉夹层患者术后肾损伤的独立危险因素,但心包积液量与急性主动脉夹层术后急性肾损伤的关系有待进一步研究。
胸腔积液在心脏手术后较为常见,原因包括各种临床因素如心力衰竭、心律失常和抗凝剂的使用,而且术前合并胸腔积液的患者术后并发症的发生率增加[19]。本研究提示术后24 h胸腔积液量的增加是Ⅰ型急性主动脉夹层患者术后发生急性肾损伤的独立危险因素,对于提示术后急性肾损伤的发生具有重要意义。
非内皮化的假腔和管腔湍流在术前激活了急性主动脉夹层患者的凝血系统[20],而术中体外循环和低温环境会加剧血小板的消耗和功能障碍[21]。研究表明,PLR与急性主动脉夹层的诊断有显著相关性。本研究提示术后PLR是急性主动脉夹层患者术后发生急性肾损伤的独立危险因素,原因可能是炎性细胞,如巨噬细胞、自然杀伤细胞、淋巴细胞和中性粒细胞浸润并破坏肾脏组织[22]。PLR可提示全身的炎性反应,并可预示心血管疾病的不良预后[23]。
本研究为回顾性研究,有一定局限性:选取的病例数量有限,时间跨度较大,术者和术式有差异。通过相关统计学分析,本研究得出DeBakeyⅠ型主动脉夹层术后出现急性肾损伤的患者并发脑卒中、感染和死亡的比例,ICU治疗时间和住院时间显著增加。急性主动脉夹层术后发生急性肾损伤的危险因素很多,除了年龄、心肺转流时间等因素外,术前冠状窦撕裂、合并心包积液、术后24 h胸液量以及术后PLR的降低均是术后发生急性肾损伤的相关危险因素,这对于围手术期预估DeBakeyⅠ型主动脉夹层术后急性肾损伤的发生具有重要意义,同时为尽早通过肾脏替代治疗或者其他相关措施干预术后急性肾损伤的发生提供了临床依据。

