烘烤过程中水分分布和蛋白变性对猪肉脯质构的影响
曹叶萍 郇延军 高 静
(江南大学食品学院,江苏 无锡 214122)
猪肉脯是猪肉经腌制、烘烤的片状肉制品,因食用方便、风味独特、口感细腻、营养丰富、携带和食用方便等特点倍受青睐[1]。但目前猪肉脯普遍存在口感坚韧、弹性不够、切片性能差、硬度大、易损伤牙齿等问题,其市场销售也因此受到一定影响。
影响肉脯质构的因素有很多。从宏观角度讲,原料肉的组织形态、肥瘦比、水分含量等都存在很大影响[2]。从微观角度讲,胶原蛋白含量、蛋白质的变性程度、蛋白质的凝胶结构、不易流动水所占比例等则是重点考察因素。刘晶晶等[3]通过水浴加热牛肉使其达到不同的中心温度来探究胶原蛋白特性对嫩度的影响,结果发现,胶原蛋白含量以及可溶性胶原蛋白的溶解变性很大程度上影响了牛肉的嫩度。马纪兵等[4]在研究风干牦牛肉加工过程中水分状态变化及质构相关性分析中发现,牦牛肉在自然冷冻风干过程中不易流动水不断向外扩散蒸发,引起牦牛肉肌纤维收缩和聚集,导致其质构特性发生变化。姜秀丽等[5]探讨了烘干时间对猪肉脯水分分布与品质相关性,发现烘干时间对猪肉脯品质的影响主要是由肉中水分的迁移引起的。然而,目前针对猪肉脯烘烤过程中水分存在形式及蛋白变性程度对质构特性影响的研究尚未见报道。
本研究拟围绕猪肉脯烘烤过程中水分分布及蛋白的变性情况来探讨其与产品质构之间的相关性,研究了烘烤温度对猪肉脯质构的影响,并结合氢质子低场核磁共振来测定猪肉脯烘烤过程中水分的分布及组成特点,利用傅立叶红外光谱技术解析烘烤过程中肉蛋白变性情况,为传统猪肉脯生产工艺的完善与质构改良提供新的思路。
1 材料和方法
1.1 材料和仪器
猪后腿肉、白砂糖、鸡精、特级酱油、鱼露:市售;
红曲红、乙基麦芽酚:食品级,市售。
质构分析仪:TA-XT plus型,英国 Stable Micro Systems公司;
低场核磁共振成像分析仪:MesoMR23-060V-I型,瑞士布鲁克公司;
傅立叶红外光谱仪:IS10型,美国Nicolet公司。
1.2 试验方法
1.2.1 猪肉脯基本配方 原料肉100 g,蔗糖20 g,复合磷酸盐[焦磷酸钠∶三聚磷酸钠∶六偏磷酸钠(质量比)=2∶1∶1]0.6 g,白胡椒粉0.348 g,特级酱油2 g,鱼露2 g,鸡精0.581 g,味精0.767 g,乙基麦芽酚0.1 g,红曲红0.023 g。
1.2.2 猪肉脯加工工艺
原料修整(去除可见脂肪)→切片(厚度约2 mm)→混料→腌制(4 ℃/0.5 h)→摊筛→烘干(55,60,65,70,80 ℃/5 h)→烤制(上下火均为220 ℃/1 min)→冷却,真空包装[6]
1.2.3 猪肉脯中水分含量测定 按GB 5009.3—2016中的恒温干燥法执行
1.2.4 低场核磁共振试验 肉片烘烤至不同水分含量时,取出,放置室温25 ℃后再称取2 g肉脯样品放入核磁管内进行核磁共振测定。试验参数为:磁场强度(0.50±0.08) T,共振频率20 MHz,采样频率100 kHz,采样点数179 996,重复等待时间3 500 ms,重复累加次数32,回波时间0.6 ms。
1.2.5 质构测定 根据文献[7]修改如下:将烤制完成的猪肉脯剪成长2 cm,宽1 cm的长方形,探头使用P/35R,测试前速度1 mm/s,测试速度3 mm/s,测试后速度3 mm/s,压缩比60%,触发力5 g。
1.2.6 剪切力测定 根据文献[8]修改如下:将猪肉脯切割成3 cm×2 cm的长方形,用于剪切力的测定。探头使用A/CKB,测试前速度1 mm/s,测试速度1 mm/s,测试后速度10 mm/s,压缩比90%,触发力5 g,测试模式压缩。
1.2.7 傅立叶红外光谱分析 使用傅立叶红外光谱仪,通过KBr压制盘法进行FTIR光谱测量。根据文献[9]修改如下:收集每个烘烤至不同含水量肉脯的光谱,分辨率为4 cm-1,扫描64次,光谱扫描4 000~500 cm-1区域。用干燥氮气连续吹扫该系统。使用解卷积、二阶导数和曲线拟合来分析结果。
1.2.8 统计分析 采用Excel 97—2003及Origin 2016软件绘图,采用SPSS Statistics 19.0软件对数据进行相关性及显著性分析;红外光谱高斯拟合使用PeakFitv 4.12软件、Omnic软件处理数据;每个试验重复3次。
2 结果与分析
2.1 烘烤温度对猪肉脯质构的影响
2.1.1 干燥曲线 干燥曲线分为两个阶段,在干燥初期有个短暂的快速期,后期干燥速率下降变得缓慢。烘烤温度越高,干燥所经历的时间越短,因为高温加速水分子的扩散,蛋白质发生凝聚,存储水分的空间(肌原纤维内)变小,水分流出,使得干燥速率明显增大[10]。55 ℃和60 ℃ 干燥所需要的时间差值大,而在60 ℃和65 ℃条件下干燥所花费的时间差值小,即同样的温度差,干燥结果却相差很大,此现象与蛋白的变性有关,肌球蛋白在55~60 ℃时开始变性,胶原蛋白在60~65 ℃遇热发生收缩,因此推测60~65 ℃是影响猪肉嫩度的关键热处理温度。
另外,从图1可以看出,在烘烤温度80 ℃条件下,干燥起始的30 min内,含水量直线下降,随后曲线趋于平缓,含水量降低缓慢,这是因为起始阶段温度很高,表面水分快速脱除,但是随着烘烤继续,肉脯表皮内肌原纤维及结缔组织收缩使得肉脯表面形成一层硬壳,不利于内部水分转移至表面脱除,所以后期干燥速率降低。

图1 烘烤温度下猪肉脯的干燥曲线Figure 1 Drying curve of pork chop at different baking temperatures
2.1.2 烘烤温度对猪肉脯剪切力的影响 由图2可知,55 ℃ 烘烤组猪肉脯剪切力值最小,这是因为温度越低,失水量越少。烘烤温度升高至60 ℃时,剪切力增大,这与肌原纤维蛋白变性有关,主要是肌动球蛋白凝聚,导致肌肉保水性降低。烘烤温度与剪切力不是正相关关系,这是由于温度升高至65 ℃时,胶原蛋白发生溶解,可溶性增加并形成凝胶,提高了肉的嫩度[11],与本试验65 ℃烘烤组剪切力减小结果相符。温度继续升至70~80 ℃时,由胶原蛋白组成的肌内膜和肌束膜变性而引起的收缩导致剪切力的第二次增加,证实65 ℃是影响猪肉嫩度的关键加热温度。
2.1.3 烘烤温度对猪肉脯质构的影响 通过质地多面剖析法(texture profile analysis,TPA)测量猪肉脯在不同烘烤温度下质构特性的变化,结果见表1。硬度表示是物体变形所需要的力,硬度越小,肉质越软[12]。由表1可知,烘烤温度越低,硬度越小,这与含水量有关。李真[13]在研究熏马肉干的制备时发现,含水量越大,硬度越小,其变化的趋势与本研究结果一致。当温度升高至65 ℃时,硬度又呈下降趋势,这是因为此时胶原蛋白溶解发生凝胶化,提高了肉的嫩度。咀嚼性反映了从开始咀嚼肉脯到下咽的整个过程中消耗的热值,它的数值越小说明肉脯质地越柔软。从表1还可以看出,烘烤温度为65 ℃时,其咀嚼值最小。另外,随着烘烤温度升高,猪肉脯内聚性呈显著上升趋势(P<0.05),弹性和回复性均显著减小(P<0.05)。

图2 烘烤温度对猪肉脯剪切力的影响Figure 2 Effect of different baking temperatures on shear strength of pork chop

表1 烘烤温度对猪肉脯质构的影响†Table 1 Effect of different baking temperatures on the texture of pork mash
† 同列字母不同表示差异显著(P<0.05)。
综上所述,烘烤温度对猪肉脯剪切力及质构影响显著,其中65 ℃烘制的产品咀嚼性最低,剪切力值和硬度较小,适宜烘烤猪肉脯,以下试验均在最佳烘烤温度65 ℃ 条件下进行。
2.2 肉脯烘烤过程中水分变化
图3为肉脯烘烤过程中含水量从65%降至18%的核磁共振图谱,揭示了其水分分布及组成特点。试验中发现样品一般会出现3个峰,可以把猪肉脯的横向弛豫时间分为3个部分:T21(1~10 ms)、T22(11~100 ms)和T23(100~1 000 ms)。其中T21表示与蛋白质结合紧密的水,即结合水。T22代表存在于肌原纤维内的水,即不易流动水。T23则是存在于肌原纤维外的水,即自由水[14]。
由表2可知,烘烤过程中,这3种状态水分的弛豫时间都显著降低。本研究中T21变化表明烘烤过程中水—蛋白相互作用的改变[15]。因为长时间的烘烤,促使蛋白发生变性和聚集,水分和蛋白中的质子实现了交换,从而影响了肉脯中结合水的横向弛豫时间及峰面积。
从烘烤开始到含水量下降至18%时,A21变化无规律,烘至含水量35%时达到最大值,占总峰面积约2.27%。而A22逐渐降低,A22所占总峰面积从92.14%下降到了87.10%。A23总体呈下降趋势,所占总峰面积3.14% 下降到了1.74%。因此,在整个烘烤过程中,不易流动水变化显著,而结合水和自由水变化不显著。
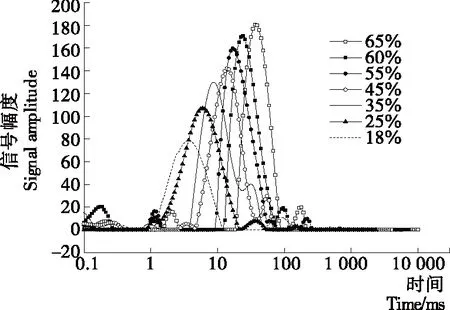
图3 烘烤过程中T2弛豫分布Figure 3 T2 relaxation distribution during baking
2.3 烘烤过程中猪肉脯的质构特性变化
由图4可知,肉脯在烘烤过程中硬度、内聚性、咀嚼性及剪切力都显著增加(P<0.05),而弹性和回复性则显著下降(P<0.05),其中硬度、咀嚼性和剪切力是消费者评价肉脯品质优劣的重要指标[16]。本研究肉脯在烘烤过程中硬度最终达到了8 542.482 g 左右,增加了约6 915.856 g;咀嚼性最终达到了5 424.984 g 左右,增加了约4 601.510 g;剪切力最终达到了2 682.434 g 左右,增加了约1 684.092 g,三者均在35%~25%变化差异显著(P<0.05)。
2.4 烘烤过程中猪肉脯蛋白二级结构变化
蛋白质的二级结构包括α-螺旋、β-折叠、β-转角、无规卷曲等结构。不同的二级结构信息叠加在酰胺I带上,而且酰胺I带的二级导数谱图保留吸收峰的积分面积[17]。通过对谱图的曲线进行高斯拟合,确定各子峰与各二级结构的对应关系,再根据面积来计算每个二级结构所含的相对百分含量。谱带处于1 600~1 642 cm-1的为β-折叠结构的特征吸收峰; 1 643~1 650 cm-1的对应无规卷曲结构;1 650~1 660 cm-1的对应α-螺旋;1 676~1 700 cm-1的为β-转角。
图5(a)~(g)中包含了在烘烤温度65 ℃条件下,猪肉脯烘干至不同水分含量下的蛋白二级结构信息,其中含水量65%为对照组,揭示了从猪肉中提取的结缔组织蛋白(胶原蛋白)的酰胺I带中波数1 700~1 600 cm-1(图中上部黑线)和高斯拟合曲线(图中下部黑线)的ATR光谱图。
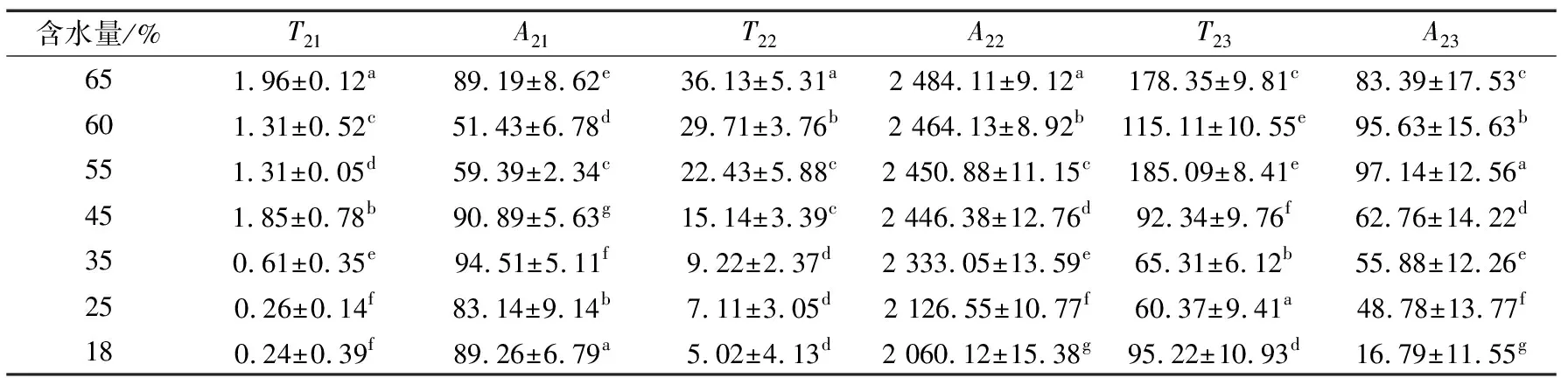
表2 烘烤过程中肉脯弛豫时间及峰面积的变化†Table 2 Changes in relaxation time and peak area of meat emulsion during baking
† 同列字母不同表示差异显著(P<0.05)。
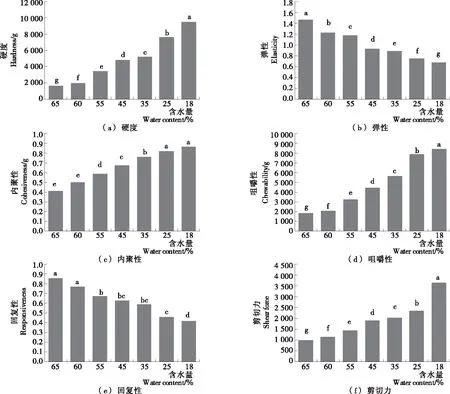
字母不同表示差异显著(P<0.05)图4 肉脯烘烤过程中质构的变化Figure 4 Changes in texture during roasting of meat emulsion
由图5和表3可以看出,与对照组相比,猪肉结缔组织蛋白的二级结构均发生了变化:
(1) 随着加热时间的延长,α-螺旋结构含量显著下降(P<0.05),说明烘烤过程中的热处理导致维持α-螺旋结构的氢键减弱,促进了蛋白质分子结构的展开,并且蛋白质的结构稳定性下降。

图5 猪肉肌原纤维蛋白和结缔组织蛋白的酰胺I带中波数1 700~1 580 cm-1和高斯拟合曲线的ATR光谱图Figure 5 ATR spectra of wave number 1 700 to 1 580 cm-1 and Gaussian fitting curve in the amide I band of pork myofibrillar protein and connective tissue protein
(2) 对照样品蛋白结构以β-折叠为主,占45.74%。当加热时间延长,蛋白质变性程度增加,导致β-折叠结构含量降低,β-折叠的含量由45.74%下降到38.44%,这是由于长时间的热处理导致通常处于自然状态的蛋白质结构内部的疏水区域暴露所致。
(3)β-转角含量和无规卷曲含量也显著增加(P<0.05),这是因为温度引起的变性和聚集,使β-折叠结构很容易转变成β-转角结构。
2.5 烘烤过程中猪肉脯水分存在形式、蛋白二级结构与质构相关性分析
由表4得知:
(1) 肉脯含水量与硬度、内聚性、咀嚼性和剪切力呈极显著负相关关系(P<0.01),与弹性、回复性则呈极显著正相关关系(P<0.01),与贾艳华等[18]在探讨软烤扇贝质构与水分含量的相关性分析时得到的结果一致,水分含量越低,硬度、内聚性、回复性反而越大,而弹性、胶黏性及咀嚼性越小。
(2) 蛋白二级结构的4种变化与质构各指标呈极显著相关关系(P<0.01),与邓丽等[11]在研究热加工过程中鲍鱼腹足蛋白间作用力及其质构特性中得到的结果一致。
(3) 不易流动水的弛豫时间和峰面积与质构各指标呈极显著相关(P<0.01),说明肉脯在烘烤过程中,不易流动水由水分通道不断向外扩散至肉干表面的过程中,肌纤维横向开始不断地收缩,连接肌纤维的结缔组织也因水分的散失产生皱缩,从而增加了其硬度、内聚性、咀嚼性及剪切力。与此同时,肌纤维纵向也发生收缩,因而降低了肉脯的弹性和回复性。崔宏博等[19]也认为虾蒸制过程中不易流动水的变化与硬度变化相关性显著,且与回复性呈显著负相关。
3 结论
试验探讨了传统猪肉脯加工过程中的质构变化规律,结果表明,烘烤温度对猪肉脯剪切力及质构影响显著,65 ℃是影响猪肉嫩度的关键热处理温度,烘制的产品咀嚼性最低,剪切力值和硬度较小,适宜烘烤猪肉脯;水分的流失和蛋白的变性是影响质构最主要的两个因素,不易流动水含量越低,肉脯硬度、剪切力和咀嚼性越大,与马纪兵[4]、姜秀丽[5]等的研究结果一致;蛋白变性程度越高,肉脯硬度、剪切力和咀嚼性越大。
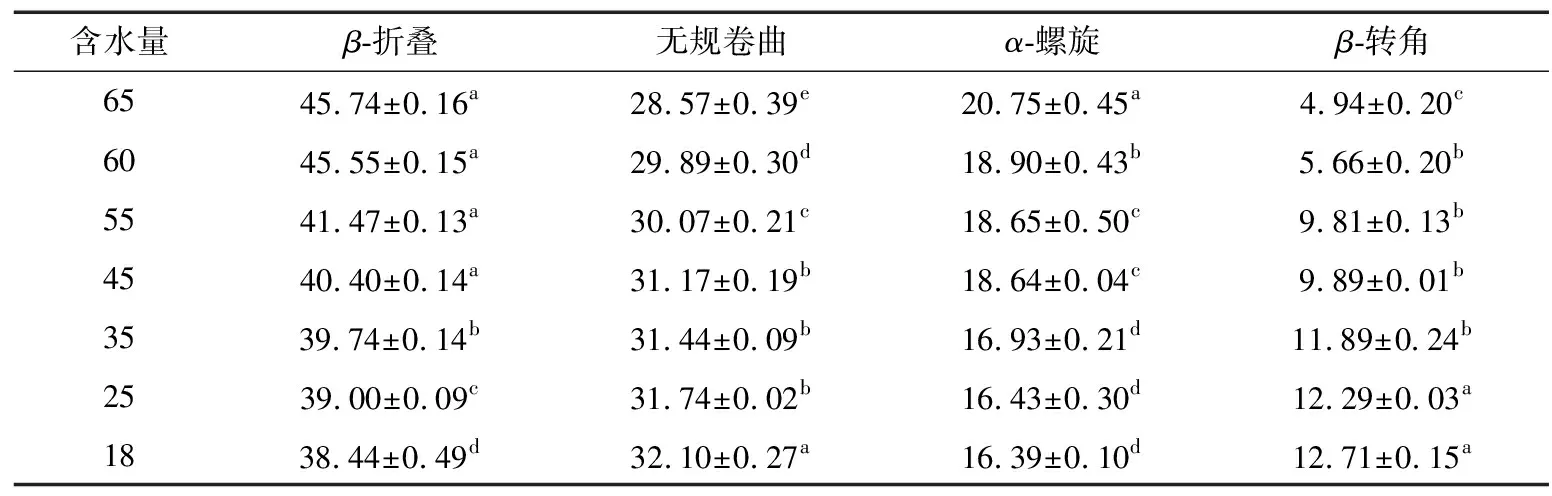
表3 烘烤过程中肉脯蛋白二级结构的变化†Table 3 Changes in the secondary structure of meat emulsion protein during baking %
† 同列字母不同表示差异显著(P<0.05)。
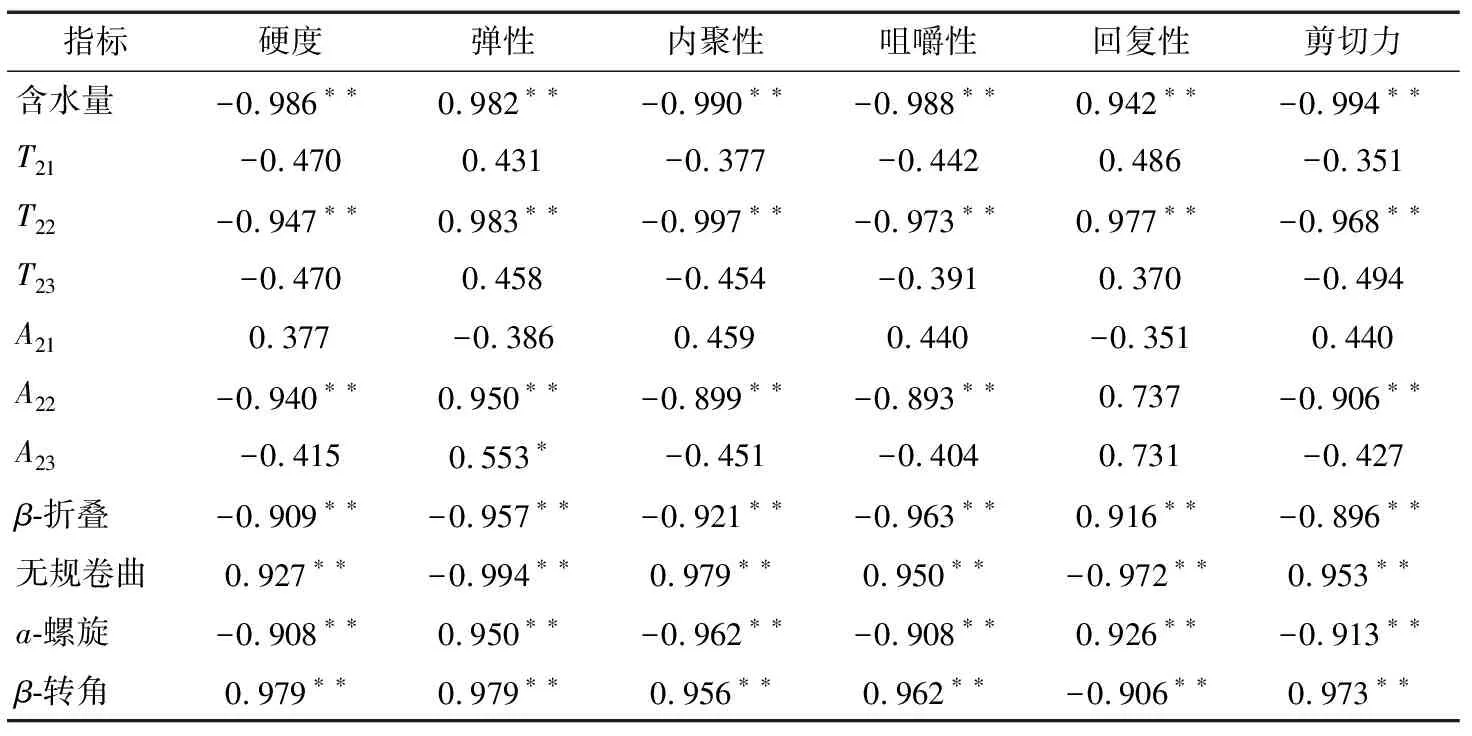
表4 各指标间的Pearson 相关系数†Table 4 Pearson correlation coefficient between indicators
† *表示相关性显著(P<0.05);**表示相关性极显著(P<0.01)。
本试验仅涉及猪肉脯加工过程中质构的变化规律,并未对其口感硬、难咀嚼等质构问题进行改善,因此有待进一步研究,其中不易流动水的损失可以依靠添加羟基醇,利用羟基与水分子以氢键的形式结合,达到一定的保水作用;其次可以通过添加蛋白酶降解肉脯中的蛋白,改善其质构。

