不同方法提取荷花蜂花粉可溶性膳食纤维的多酚含量及对微生物生长的影响
郑 慧 杨 勇 曾艺琼 梁倩倩 单 硕 李顺祥
(1. 湖南中医药大学药学院食品药品工程系,湖南 长沙 410208;2. 湖南省中药活性物质筛选工程技术研究中心,湖南 长沙 410208)
蜂花粉被誉为“微型营养库”,在中国其药食兼用历史可追溯到两千年前。依托中国丰富的蜂花粉资源,近年来中国蜂花粉相关研究日益升温,主要集中在细胞壁破壁,总黄酮、总多酚、多糖等成分的研究上,其中多酚类组分因其较强的抗氧化性,已成为蜂花粉的特征性功效成分[1-3]。前期研究[4]表明蜂花粉纤维类组分含量丰富,可溶性膳食纤维(soluble dietary fiber,SDF)含量为4%~9%。且纤维组分的提取工艺势必会影响蜂花粉的蛋白致敏源,可能降低蜂花粉致敏性,同时解决含杂含砂、口感独特等制约其进一步开发利用的难题。
近年来膳食纤维因其良好的生理功能[5-6],已成为产品开发的研究热点,其中SDF因其良好的溶解性,被广泛地应用于乳制品、饮料等食品中[7-8];同时研究[9-10]多认为膳食纤维的抗氧化性、降血糖、减肥、减少慢性胃肠道紊乱等功效与其中含有的多酚类紧密有关。研究[11]表明蜂花粉中含有丰富的多酚类化合物,则其纤维组分也可能含有一定量的多酚类物质。目前,蜂花粉纤维类组分的研究刚刚起步,提取方法对蜂花粉可溶性膳食纤维(bee pollen soluble dietary fiber,BPSDF)中多酚含量影响的相关研究暂未有报导。本试验拟在前期研究基础上,分别采用纤维素酶酶解提取、酸溶液提取、碱溶液提取3种方法制备BPSDF,探究提取方法对BPSDF游离酚、结合酚及总酚含量,以及对常见致病菌、有益菌生长的影响,为后期蜂花粉纤维组分的深入研究及产品的开发利用提供参考。
1 材料与方法
1.1 材料与主要仪器
1.1.1 材料与试剂
荷花蜂花粉:2017年产自湖南,长沙蜂舞人间生物科技有限公司;
原儿茶酸:分析标准品,上海跃腾生物技术有限公司;
纤维素酶:国药集团化学试剂有限公司;
丙酮、福林酚、乙酸乙酯、盐酸、氢氧化钠、碳酸钠、乙醇等:分析纯;
LB培养基(用于培养大肠杆菌和金黄色葡萄球菌)、SDA培养基(用于培养白色念珠球菌)、MRS培养基(用于培养双歧杆菌和嗜酸乳杆菌):杭州百思生物技术有限公司;
大肠杆菌、金黄色葡萄球菌、白色念珠球菌:上海鲁微科技有限公司;
嗜酸乳杆菌冻干粉:广东省菌种保藏中心;
双歧杆菌:由湖南中医药大学药学院食品科学与工程教研室保存。
1.1.2 主要仪器设备
生化培养箱:MJX-150BX型,天津泰斯特仪器有限公司;
立式压力蒸汽灭菌器:LDZM-60KCS型,上海申安医疗器械厂;
净化工作台:SW-CJ-2FD型,北京中兴伟业仪器有限公司;
恒温振荡器:ZHWY-200D型,上海智诚分析仪器制造有限公司;
电子分析天平:AV1120型,日本岛津仪器有限公司;
电子恒温水浴锅:DZKW-4型,北京中关伟业仪器有限公司;
pH计:STARTER3100/F型,奥豪斯仪器有限公司;
紫外可见分光光度计:UV 2450型,日本岛津仪器有限公司;
高效液相色谱仪配紫外检测器:Agilent 1260型,美国安捷伦公司。
1.2 试验方法
1.2.1 BPSDF提取
(1) 纤维素酶酶解提取:准确称取100 g蜂花粉置于pH 4.0水溶液中,加入2.5 g纤维素酶,50 ℃振摇2 h,85 ℃ 水浴10 min灭酶。3 500 r/min离心10 min后取上清液,用4倍体积的95%乙醇醇沉,5 ℃静置过夜,3 500 r/min 离心10 min 取沉淀,置于真空干燥箱60 ℃干燥10 h得到酶提BPSDF[12]。
(2) 酸溶液提取:准确称取100 g蜂花粉置于pH 4.3水溶液中,50 ℃振摇2 h。3 500 r/min离心10 min取上清液,其后按酶解提取中后续方法进行,得到酸提BPSDF[13]。
(3) 碱溶液提取:准确称取100 g蜂花粉置于pH 10.0 水溶液中,50 ℃振摇2 h。3 500 r/min离心10 min取上清液,其后按酶解提取方法进行,得到碱提BPSDF[14]。
1.2.2 游离态多酚的提取 参照Adom等[15]的方法,稍作修改。准确称取4.000 g BPSDF于离心管中,加入80%冷冻丙酮溶液16 mL,5 ℃振摇1 h,于3 500 r/min 离心10 min,取上清液。残渣重复提取2次,合并上清液,抽滤后45 ℃旋转蒸干,用甲醇定容,-5 ℃保存备用。
1.2.3 结合态多酚的提取 BPSDF游离酚提取后的残渣加入2 mol/L NaOH溶液4 mL,充分搅拌后避光消化1 h,用浓盐酸调至pH 2。加入8 mL乙酸乙酯并充分搅拌提取10 min,3 500 r/min离心10 min,取上清液。重复提取5 次,合并上清液。抽滤后45 ℃旋转蒸干,用甲醇定容,-5 ℃ 保存备用。
1.2.4 多酚含量的测定 准确称取原儿茶酸标准品,定容后得原儿茶酸标准溶液。准确量取原儿茶酸标准溶液0.0,0.1,0.2,0.3,0.4,0.5 mL于10 mL容量瓶中,各加6 mL 水,摇匀,再加0.5 mL福林酚试剂,充分摇匀。1 min 之后,加入20% Na2CO3溶液1.5 mL,混匀后定容。在室温下反应10 min,于765 nm波长下测定吸光值,以原儿茶酸浓度为横坐标,吸光值为纵坐标,得原儿茶酸标准曲线回归方程:y=102.54x+0.005 1 (R2=0.999 2)。BPSDF多酚含量测定的操作同标准曲线制备。
1.2.5 多酚的HPLC分析 BPSDF多酚提取液经0.45 μm 微孔滤膜过滤后待用。色谱条件[16]:Ultimate XB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:纯水—甲醇(体积比50∶50);柱温:25 ℃;检测波长:280 nm;流速为1.0 mL/min;进样量:20 μL。
1.2.6 BPSDF对有益菌、有害菌生长的影响
(1) 菌悬液的制备:供试菌种活化后,挑取斜面培养基上的菌苔,用无菌水采用梯度法稀释,依次得到不同浓度的供试菌菌悬液。
(2) 试验培养基的配制:分别称取BPSDF于适量蒸馏水中,50 ℃振摇5 h,充分溶解后备用。各基础培养基配置、密封后,于高压灭菌锅121 ℃灭菌30 min,取出后将各BPSDF水溶液按比例添加到基础培养基中,得到含有BPSDF分别为 1,3,5 g/L 3个浓度的试验培养基,同时以不添加BPSDF的基础培养基作对照。
(3) 菌体生长试验、计数统计:在无菌操作台上进行无菌操作,准确移入1 mL受试菌菌悬液于无菌培养皿中,再趁热分别移入10 mL含有BPSDF 1,3,5 g/L 3个浓度的试验培养基以及对照培养基,振荡摇匀,待培养基凝固后移入培养箱中,在受试菌规定的温度、时间下进行培养,观察不同提取方法、不同浓度BPSDF对各受试菌生长的影响。采用平板菌落计数法,对受试菌的培养结果按式(1)进行活菌落计数,将结果换算成lgN进行统计分析[17]。
N=n×m×10,
(1)
式中:
N——活菌数,CFU;
n——细菌菌落数,CFU;
m——稀释倍数。
1.2.7 统计分析 每个试样重复3次。试验数据采用SPSS 22.0软件进行统计分析,结果采用平均数±标准差表示。
2 结果与分析
2.1 不同方法提取BPSDF的游离酚、结合酚和总酚含量
由表1可得,在提取过程中蜂花粉原料中的多酚类物质除溶于水、乙醇溶液而流失外,还有部分被残留在BPSDF中。多酚在食品基质中可能以单体的形式被物理吸附或截留成为游离态多酚,或与基质通过化学键的结合而成为结合态多酚[18]。游离态多酚多通过胃、小肠消化吸收而发挥功效;结合态多酚则能到达大肠,在肠道微生物的作用下实现游离化而发挥其功效[19-20]。
从表1还可知,不同方法提取BPSDF的游离酚、结合酚和总酚含量均差异显著,游离酚为0.309~0.435 mg/g,结合酚含量为0.092~0.135 mg/g,总酚含量为0.444~0.536 mg/g。纤维素酶酶解提取、酸溶液提取、碱溶液提取BPSDF游离酚分别占其总酚的81.16%,80.34%,69.59%,可推知BPSDF中多酚主要以游离酚的形式存在。同时,酶提BPSDF游离酚、总酚含量较高,分别为碱提的1.41,1.21倍;碱提BPSDF结合酚含量较高,为酸提的1.47倍。不同的提取方法可能导致蜂花粉细胞壁裂解组分、同一组分裂解方式不同,得到的BPSDF组成成分、分子量大小、碳链长短不同[12],从而影响BPSDF中残留多酚的含量及多酚存在形式。
表1 BPSDF游离酚、结合酚和总酚含量†
Table 1 Contents of free polyphenols, binding polyphenols and total polyphenols in BPSDF mg/g
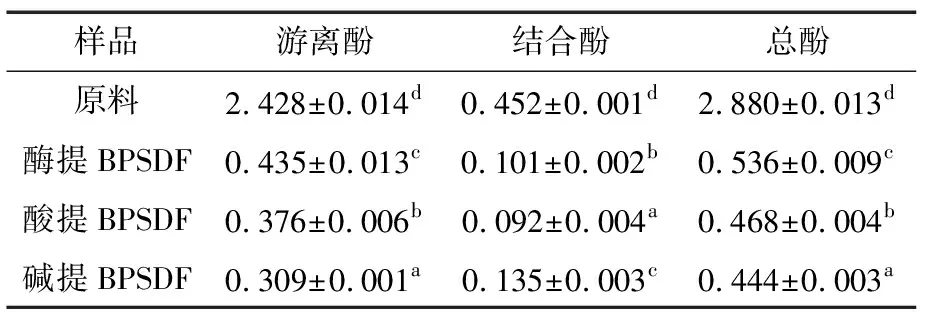
† 同列不同字母表示差异显著(P<0.05)。
2.2 不同方法提取BPSDF游离酚、结合酚的HPLC图谱
3种方法提取BPSDF的游离酚、结合酚HPLC叠加图谱如图1所示,游离酚、结合酚HPLC图谱峰形相似,出峰时间相近,出峰面积略有差异。其中,BPSDF游离酚在3.775 min附近均出现较大吸收峰,结合酚在3.775,4.256 min 附近均出现较大吸收峰。从HPLC图谱初步推之,提取条件虽对蜂花粉多酚含量有一定影响,但对保留在BPSDF中各游离酚、结合酚中主要的多酚组分影响较小,其具体差异性还需进一步研究确定。
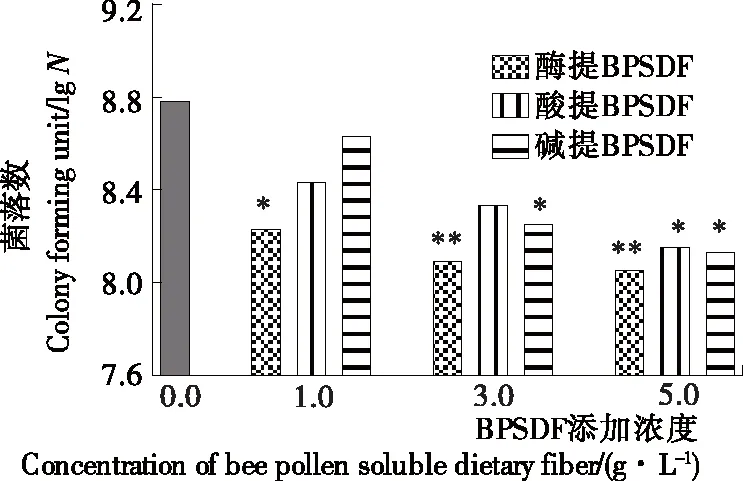
2.3 不同方法提取BPSDF对大肠杆菌生长的影响
如图2所示,与空白对照组相比,不同方法提取的BPSDF对大肠杆菌均有一定的抑制作用;且随着试验培养基中BPSDF浓度增加,抑制能力增加。同时,同种浓度下添加酶提BPSDF供试培养基的大肠杆菌菌落数最低,与空白对照组相比在1 g/L浓度下即有极显著差异,抑制作用最强;其次,酸提BPSDF 1 g/L浓度下与空白对照组相比差异显著,5 g/L浓度达到差异极显著;碱提BPSDF对大肠杆菌的抑制作用相对较低,在5 g/L浓度下与空白对照组相比差异显著。3种方法提取的BPSDF对大肠杆菌的抑制能力与其含有游离酚、总酚含量高低的趋势一致。
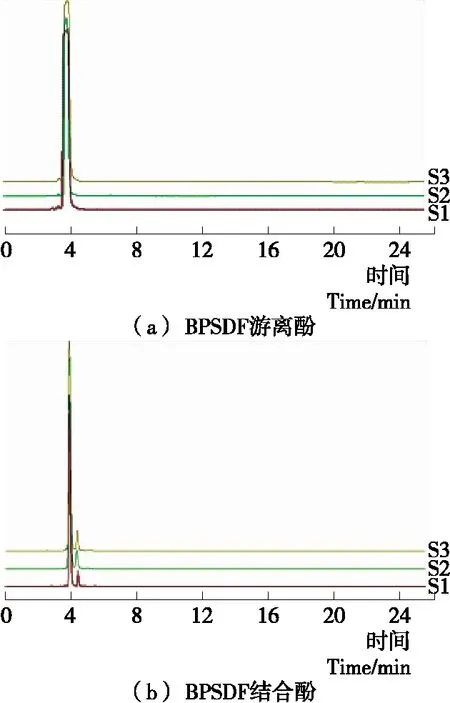
S1. 酶提BPSDF S2. 酸提BPSDF S3. 碱提BPSDF图1 BPSDF游离酚、结合酚HLPC图谱Figure 1 HPLC chromatograms of free polyphenols,binding polyphenols in BPSDF

*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01)
图2 BPSDF对大肠杆菌菌落数的影响
Figure 2 The influence of BPSDF onE.colicolonies
2.4 不同方法提取BPSDF对金黄色葡萄球菌生长的影响
如图3所示,与空白对照组相比,3种方法提取的BPSDF对金黄色葡萄球菌均有一定的抑制作用;且随着试验培养基中BPSDF浓度增加,抑制能力增加。同时,同种浓度下添加酶提BPSDF供试培养基的金黄色葡萄球菌菌落数最低,与空白对照组相比在1 g/L浓度下差异显著,在3 g/L 浓度下达到差异极显著,抑制作用最强。其次,碱提BPSDF在3 g/L浓度下与空白对照组相比差异显著,酸提BPSDF在5 g/L浓度下与空白对照组相比差异显著。
*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01)
图3 BPSDF对金黄色葡萄球菌菌落数的影响
Figure 3 The influence of BPSDF on Staphylococcus aureus colonies
2.5 不同方法提取BPSDF对白色念珠球菌生长的影响
如图4所示,与空白对照组相比,3种方法提取的BPSDF对白色念珠球菌均有一定的抑制作用;随着试验培养基中BPSDF浓度增加,抑制能力增加。同时,同种浓度下添加酶提BPSDF供试培养基的白色念珠球菌菌落数最低,与空白对照组相比在1 g/L浓度下差异显著,3 g/L 时差异极显著,抑制作用最强。其次,酸提BPSDF在3 g/L 浓度下与空白对照组相比差异显著,5 g/L浓度达到差异极显著。碱提BPSDF对白色念珠球菌的抑制作用相对较低,在5 g/L浓度下与空白对照组相比差异显著。3种方法提取的BPSDF对白色念珠球菌的抑制能力与其含有游离酚、总酚含量高低的趋势一致。
2.6 不同方法提取BPSDF对双歧杆菌生长的影响
如图5所示,与空白对照组相比,3种方法提取的BPSDF对双歧杆菌均有一定的促进作用;且随着试验培养基中BPSDF浓度增加,促进能力增加。同时,同种浓度下添加酶提、酸提BPSDF供试培养基的双歧杆菌菌落数较高,与空白对照组相比均在3 g/L浓度下差异显著,5 g/L 时差异极显著,促进作用较强。碱提BPSDF对双歧杆菌的促进作用相对较低,在5 g/L浓度下与空白对照组相比差异显著。
*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01)
图4 BPSDF对白色念珠球菌菌落数的影响
Figure 4 The influence of BPSDF on Candida sporogenes colonies

*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01)
图5 BPSDF对双歧杆菌菌落数的影响
Figure 5 The influence of BPSDF on Bifidobacterium colonies
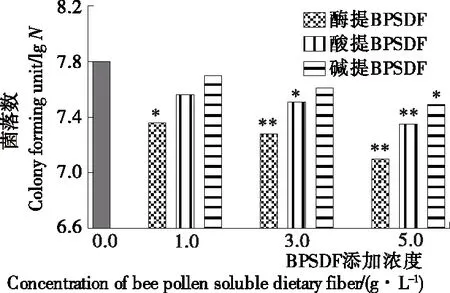
2.7 不同方法提取BPSDF对嗜酸乳杆菌生长的影响
如图6所示,与空白对照组相比,3种方法提取的BPSDF对嗜酸乳杆菌均有一定的促进作用;且随着试验培养基中BPSDF浓度增加,促进能力增加。同时,同种浓度下添加碱提、酸提BPSDF供试培养基的嗜酸乳杆菌菌落数较高,与空白对照组相比均在1 g/L浓度下达到差异极显著,促进作用相对较强。相同浓度下酶提BPSDF供试培养基的嗜酸乳杆菌菌落数较低,在5 g/L浓度下与空白对照组相比差异极显著,对嗜酸乳杆菌的促进作用相对较低。
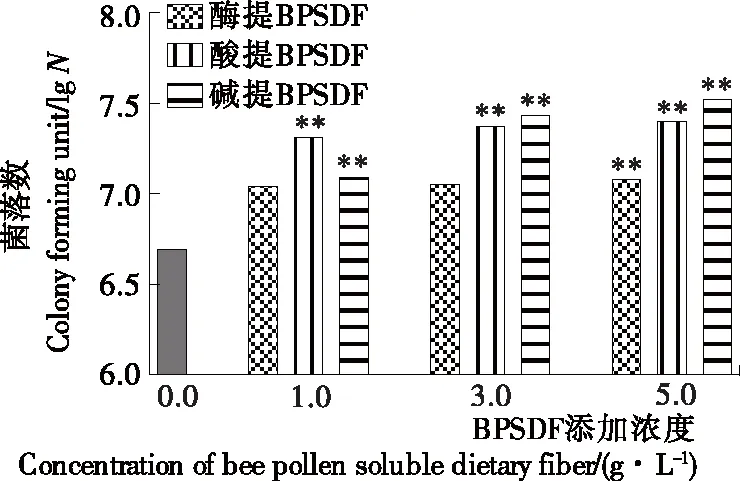
*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01)
图6 BPSDF对嗜酸乳杆菌菌落数的影响
Figure 6 The influence of BPSDF on Lactobacillus acidophilus colonies
3 结论
本研究探讨了3种方法提取的BPSDF中多酚存在形式及其含量,BPSDF对常见有害菌、有益菌的影响。结果表明,BPSDF中多酚主要以游离酚的形式存在;提取方法对其保留的游离酚、结合酚的多酚组分影响较小。3种方法提取的BPSDF对大肠杆菌、金黄色葡萄球菌、白色念珠球菌有较好的抑制作用,对双歧杆菌和嗜酸乳杆菌有一定的促进作用。从抑制有害菌、促进有益菌生长的百分率对比分析,BPSDF对供试有害菌的抑制作用优于对供试有益菌的促进作用。并且,BPSDF中总酚、游离酚含量与其对供试有害菌抑制作用的趋势相符,采用纤维素酶酶解提取BPSDF其总酚、游离酚残留较高,对3种供试有害菌的抑制作用较好。
另外,糖份作为微生物生长所需的养分。BPSDF对微生物生长的影响不仅与其所含多酚相关,也应与其所含糖相关。故后续将对不同方法提取的BPSDF中糖的组成做进一步研究。

