腰椎后路长节段手术加速康复外科实施流程专家共识
孙浩林 越雷 王诗军 张蕾 宋琳琳 蔡思逸 陈峰 张志成 孟浩 孙维 郭航 周非非 毛海青 丁琛 殷国勇 贺宝荣 刘浩* 杨惠林* 孙宇* 李淳德 沈建雄* 孙天胜* 邱贵兴*
(北京大学第一医院1.骨科,2.麻醉科,北京 100034;3.中国医学科学院北京协和医学院北京协和医院骨科,北京 100730;中国人民解放军总医院第七医学中心4.骨科,5.麻醉科,北京 100700;6.北京大学第三医院骨科,北京 100191;7.苏州大学附属第一医院骨科,江苏苏州 215006;8.四川大学华西医院骨科,成都 610041;9.南京医科大学第一附属医院骨科,南京 210029;10.西安交通大学附属红会医院脊柱外科,西安 710054)
加速康复外科(enhanced recovery after surgery,ERAS)是基于循证医学而采用一系列的围手术期优化措施,以减少围手术期的生理和创伤应激,减少术后并发症,达到加速康复的目的[1]。在脊柱外科领域,越来越多的患者因腰椎退行性变而接受手术治疗。而多节段的腰椎退行性变患者症状常表现为腰背部疼痛及下肢神经根性症状,可伴有不同程度的腰椎管狭窄、椎间盘突出、腰椎旋转和腰椎滑脱等结构性病变,经常涉及多节段的减压融合内固定,甚至截骨矫形,因此手术难度较高,围手术期风险较大,术后并发症发生概率也较高。经过全国脊柱外科专家组多次讨论,结合循证医学证据及众多学科专家临床经验制定出脊柱外科医师、麻醉医师、康复医师、病房护士及手术室护士等多学科参与的腰椎后路长节段手术ERAS方案及各相关学科ERAS实施表单(表1~5),供脊柱外科及相关学科人员参考。
1 腰椎后路长节段手术的定义
腰椎后路长节段手术主要指适用于腰椎间盘突出症、腰椎管狭窄症、腰椎滑脱症、腰椎退行性侧弯/后凸的后路3个及以上节段的手术。本ERAS方案适用的手术主要包括:3 个及以上节段的减压/内固定/融合/椎体畸形矫正(撑开、加压、去旋转等)术,伴或不伴截骨矫形。
2 腰椎后路长节段手术的特点和围手术期ERAS进程主要问题
腰背痛、下肢痛、神经功能障碍及脊柱畸形常是患者接受腰椎后路长节段手术的主要原因[2]。由于腰椎后路长节段手术客观上出血量多、手术时间长、椎旁肌肉和小关节破坏多、潜在硬膜神经损伤风险较高、手术花费也较高,且术后并发症特别是术后邻近节段病变(adjacent segmental disease,ASD)发生概率高[3,4],因此腰椎后路长节段手术的决策不仅要基于患者的临床表现和影像学结果,同时也要将患者年龄、合并症、既往手术史、经济情况、心理健康状态及生活预期等因素综合考虑。
加速康复外科的目的在于减轻围手术期生理和心理的创伤应激、减少并发症和加速康复,这对于腰椎后路长节段手术有重要意义。腰椎后路长节段手术主要涉及以下几个问题:①术前精确诊断、全面评估、手术方式选择、术前宣教、饮食管理和疼痛管理;②手术的准备、麻醉管理、正确的手术决策及规范化的手术操作;③术后呼吸道管理、消化道管理、医用管路管理、血栓预防、抗生素管理及康复锻炼。
3 腰椎后路长节段手术的精确诊断
多节段腰椎退行性变患者接受腰椎后路长节段手术的精确诊断不仅体现在腰椎疾病本身诊断的准确程度,也应该对患者的骨质情况、脊柱的稳定性和矢状位参数做出评估以最优化手术方案;同时进行必要的鉴别诊断,特别是对于难以确定症状责任病灶的患者应进行诊断性封闭等技术,避免发生漏诊、误诊甚至误治。在腰椎后路长节段手术术前进行精确而全面的诊断可使治疗更为精准、更有利于术后康复。
对于拟行腰椎后路长节段手术的患者需确保病史、体格检查、影像学检查相一致,同时了解患者最想解决的症状和对治疗的期望,对于影像学资料注意阅读影像科报告单以防漏诊误诊;术前建议完善骨密度检查以评估患者的骨质情况、脊柱全长正侧位片和脊柱全长过伸过屈位片评估患者矢状位平衡参数及全脊柱的稳定性,对于合并脊柱侧弯患者应完善左右Bending 相片及下肢全长位片以排除下肢不等长或骨盆倾斜引起的脊柱侧弯;建议常规进行骶髂关节、双侧髋关节、双下肢足背动脉搏动检查,红细胞沉降率、C 反应蛋白、肿瘤标志物等检查以排除其他可能病因;当影像学无法解释症状和体征或需要判断责任病灶时,需采取选择性神经根封闭、小关节封闭、椎间盘造影等技术协助诊断[5,6]。
4 腰椎后路长节段手术术前评估
腰椎后路长节段手术术前应该对患者的一般情况和手术专项情况进行全面而详实的评估,目的是充分完善术前准备,最小化围手术期麻醉风险,降低手术并发症的发生率和加快患者术后康复。
4.1 脊柱外科手术基本评估
4.1.1 美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级评估:根据ASA 分级对患者全身健康情况与疾病严重程度进行评估,初步判断患者围手术期发生严重并发症和死亡的风险[7]。
4.1.2 心肺功能评估:采用美国纽约心脏病学会(New York Heart Association,NYHA)心功能分级和代谢当量(metabolic equivalent of task,MET)评估患者心功能。因接受腰椎后路长节段手术患者年龄通常偏大,特别是退行性侧弯患者由于生理结构的改变,会引起不同程度的呼吸功能障碍,因此术后发生并发症的风险更高。评估方法包括患者呼吸困难程度、气道炎症、吸烟指数、肺功能检查等[8,9]。术前应及时发现围手术期呼吸系统并发症的高危因素,并常规检查胸部X 线片,动脉血气判断有无呼吸系统合并症。对于疑有呼吸功能异常患者通过肺功能检查判断有无通气及换气功能障碍。通过屏气试验来评估患者的心肺储备能力,预测其对缺氧的耐受性。
4.1.3 凝血功能评估:通过病史采集、体格检查及术前实验室凝血功能检查可发现患者是否存在可能增加围手术期出血的相关疾病。术前因房颤或心血管手术需要华法林抗凝的非急诊手术建议术前5 d 停用华法林,并在停用华法林第2天起开始使用低分子肝素(low molecular weight heparin,LMWH)进行桥接治疗,最后一次低分子肝素注射应在术前12~24 h内进行。术前因冠心病或冠心病支架植入术需抗凝的患者,心血管事件评分低危患者建议术前5~7 d 停药,术后24 h 恢复;对于中高风险评分患者则不建议停药,但是围手术期抗血小板治疗的管理应由外科医师、麻醉师、心脏病专家和患者共同决定以权衡出血的相对风险和预防血栓事件[10,11]。
4.1.4 血糖评估:糖化血红蛋白反映采血前3 个月的平均血糖水平,推荐术前筛查糖化血红蛋白。既往已有明确糖尿病病史的患者,糖化血红蛋白≤7%提示血糖控制满意,围手术期风险较低;糖化血红蛋白≥8.5%建议考虑推迟择期手术。合并糖尿病酮症酸中毒、高渗综合征是非急诊手术的禁忌。ERAS理念下的血糖控制不必过于严格,空腹血糖应控制在10.0 mmol/L 以内,随机血糖控制在12.0 mmol/L 以内即可[12]。高龄、有严重合并症、频繁发作低血糖的患者,血糖目标值也可适当放宽,原则上血糖最高不宜超过13.9 mmol/L。
4.1.5 高血压评估:术前了解患者高血压病因、病程、程度、靶器官受累情况。建议术前中年患者血压控制<130/85 mmHg,老年患者<140/90 mmHg 为宜。合并糖尿病的高血压患者,血压应降至130/80 mmHg以下[8]。必要时请心内科医师会诊并指导治疗。
4.1.6 营养评估:术前采用NRS2002表评估手术患者是否存在营养风险。有风险的患者,术前给予营养支持。
4.1.7 术后恶心呕吐(postoperative nausea and vomiting,PONV)风险评估:对于女性、不吸烟、晕动症或既往有恶心呕吐病史,及术后应用阿片类药物的患者[13],注意识别并采取相应的防治措施。
4.1.8 术后谵妄(postoperative delirium,POD)易感因素评估:接受腰椎后路长节段手术患者年龄普遍较高,患者围手术期可能存在认知功能下降、抑郁状态和谵妄等。美国老年医学会和中华医学会老年医学分会的术后谵妄干预指南均强调通过跨学科团队,对于认知能力下降、抑郁、谵妄中2种或3种情况共存者,可请老年精神心理专科医师会诊,共同制定综合干预措施;对于围手术期疑似出现谵妄的患者采用意识模糊评估表(confusion assessment method,CAM)等工具进行初步筛查,以便识别高危患者并及早干预[14,15]。
4.1.9 尿潴留风险评估:对于年龄>50 岁、男性、术前存在尿道梗阻症状和与尿潴留相关的神经性疾病及围手术期应用如抗胆碱能药物、β受体阻滞剂的患者可采用国际前列腺评分表(international prostate symptoms score,IPSS)评估术前前列腺功能,并预测术后尿潴留的风险[16,17]。
4.1.10 静脉血栓风险评估:术前推荐采用Wells血栓风险评分表进行评估,对于瘫痪、高龄、肥胖、静脉曲张、脑梗塞、血栓病史及家族史、D二聚体增高等有深静脉血栓及肺栓塞高危因素的患者应警惕血栓事件发生[18,19]。
4.2 腰椎后路长节段手术专项评估
4.2.1 腰腿痛及功能评估:可采用视觉模拟评分(visual analogue score,VAS)、腰椎日本骨科协会评分(Japanese Orthopaedic Association score,JOA)、Oswestry 功能障碍指数(Oswestry disability index,ODI)、腰椎僵硬功能障碍指数(lumbar stiffness disability index,LSDI)等对腰腿疼痛、生活功能及腰椎僵硬程度进行评估,对于合并退行性侧弯的患者可通过脊柱侧凸研究学会22 项(Scoliosis Research Society-22,SRS-22)问卷进行相关评估[20,21]。
4.2.2 影像学评估:腰椎后路长节段手术患者术前应该常规完善脊柱全长正侧位检查,测量脊柱矢状位参数、冠状位参数、矢状位骨盆参数。对于退行性侧弯患者则在冠状位用Cobb法评估畸形程度及仰卧位摄片以评估无重力时的脊柱自行矫正程度。术前完善脊柱全长动力位X线片(过伸过屈位、左右侧Bending相)检查评估椎体在动力位的稳定性、退行性侧弯柔韧性和邻近节段的代偿能力。术前建议常规完善CT三维重建和MRI检查以评价骨性结构形态及硬膜囊和神经根受压程度[22]。通过矢状位参数评判是否有矢状位失衡,如果有矢状位失衡,需判断为功能性失衡还是结构性失衡。功能性失衡一般表现为:伴有明显腰椎管狭窄,责任病灶明确,畸形常以责任病灶为中心;腰背肌肉萎缩不明显;骨盆无明显代偿,即骨盆倾斜角(pelvic tilt,PT)<10°,骨盆腰椎前凸无明显不匹配,即骨盆投射角(pelvic incidence,PI)-腰椎前凸角(lumbar lordosis,LL)<20°,胸腰段无明显后凸畸形,即胸腰段斜坡角(thoracolumbar slope,TLS)≤10°。结构性失衡一般表现为:不伴有明显腰椎管狭窄或责任病灶不明确;腰背肌肉萎缩明显;骨盆代偿显著,即PT>30°,骨盆腰椎前凸不匹配,即PI-LL>30°,多合并脊柱三维畸形。对于合并脊柱侧弯的患者在冠状位需考虑颈7铅垂线(C7 plumb line,C7PL)和骶骨中垂线(center sacral vertical line,CSVL)的差值,C7PL-CSVL<3 cm 可考虑腰段融合,而C7PL-CSVL>3 cm 融合可考虑延长融合节段至胸椎。上固定椎(upper instrumented vertebra,UIV)选择通常避免在顶椎区域,UIV 下终板与UIV 上方2 个椎体的上终板间的后凸角度(proximal junctional angle,PJA)应<10°;同时下固定椎(lower instrumented vertebra,LIV)选择需考虑远端节段失败风险。
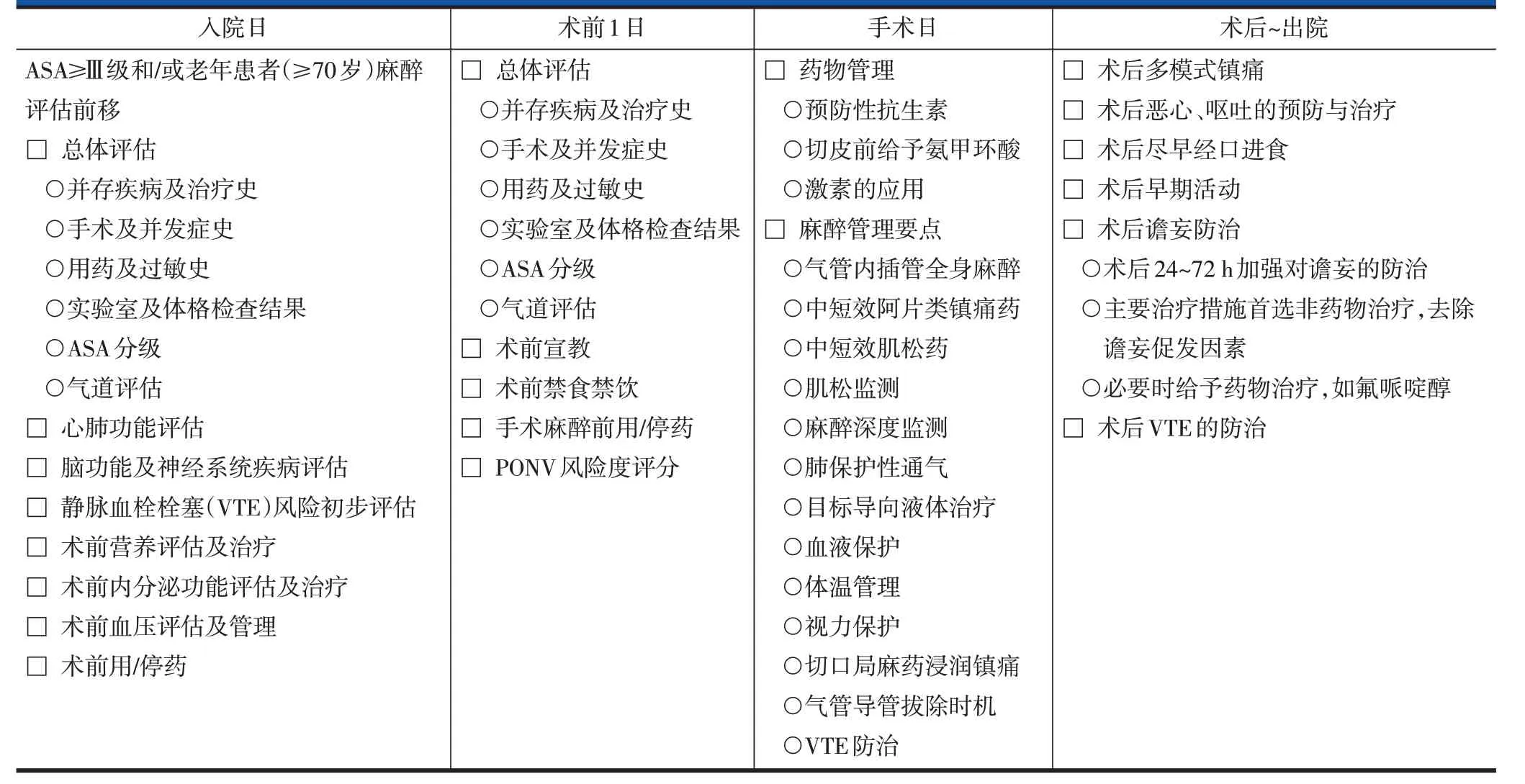
表2 腰椎后路长节段手术ERAS实施流程——麻醉医师表单
4.2.3 骨密度:对于绝经后妇女和65 岁以上男性,需在围手术期进行骨密度测量。对于骨质疏松的治疗,可参考2017版原发性骨质疏松症诊疗指南[23]。
4.2.4 心理评估:对于术前腰腿痛持续时间>3 个月,既往存在焦虑和抑郁病史的患者,可采用医院焦虑抑郁情绪(hospital anxiety and depression scale,HAD)量表进行心理评估与干预。
4.2.5 康复评估:对于所有患者都应进行康复评估,目的是制定分阶段、个体化的康复治疗方案。评估内容包括:疼痛、下肢力量、平衡功能、日常生活能力、步态及辅助器械评估、腰围类型评估等[24-26]。
5 医疗团队术前宣教
腰椎后路长节段手术围手术期ERAS 倡导由外科医师、麻醉医师、病房与手术室护士、康复医师组成的多学科协作诊疗。
外科医师将手术方案与患者充分沟通并告知患者疾病进程,了解患者最想解决的问题,明确手术方式和措施及可能获得的收益是否与患者的预期一致;重点宣教超前镇静镇痛,根据评估结果进行的术前、术中、术后处理等围手术期诊疗过程,缓解其紧张情绪,获取患者及其家属的理解、配合,包括术后早期进食、早期下床活动等。
病房护士在患者入院后进行常规入院护理工作之外,还要对患者进行充分护理评估、指导患者术前咳嗽咳痰训练、床上排便训练及老年患者的肺功能训练;指导患者饮食结构;术前还要告知患者准备物品、进行皮肤准备、完成禁食水准备等。
术前康复科医师应尽早介入,要求患者术前学会VAS自评、床上排便、呼吸及咳嗽排痰训练、正确的姿势、正确翻身和起床、腰部支具的穿戴、卧床期间四肢锻炼方法。通过这7 个“学会”提高患者参与诊疗过程的积极性,增加围手术期加速康复的可行性。
麻醉医师尽早参与到术前评估中,了解患者病史。对于ASA分级≥Ⅲ级或≥70 岁的患者,外科医师应尽早请麻醉科介入,对麻醉风险进行评估和建议。在充分麻醉评估后,应向患者介绍麻醉方案、麻醉过程及麻醉后的注意事项,缓解其紧张情绪并获得患者最大程度的配合。
6 饮食管理
除合并胃排空延迟、胃肠蠕动异常和急诊手术等患者外,目前提倡禁饮时间延后至术前2 h,之前可口服无渣、不含奶、无酒精的清饮料,但总量应<400 ml;禁食时间延后至术前6 h,之前可进食淀粉类固体食物(牛奶等乳制品的胃排空时问与固体食物相当),但不包括油炸、脂肪及肉类食物[27]。
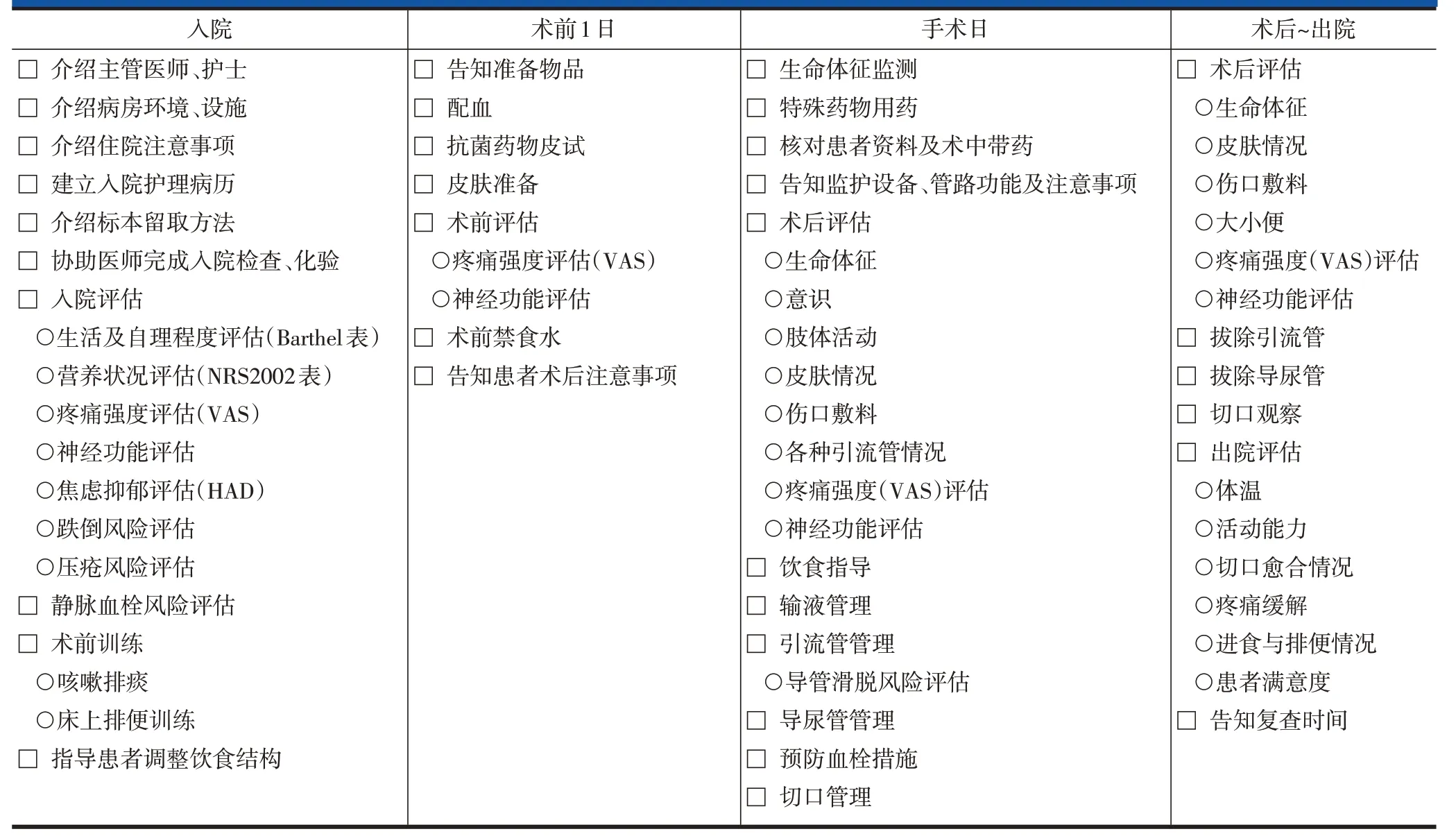
表3 腰椎后路长节段手术ERAS实施流程-病房护士表单
7 疼痛管理
术前采用VAS评分进行疼痛评估,包括腰痛、腿痛、静息和活动时疼痛。预防性镇痛使疼痛感觉中枢脱敏化并防止疼痛慢性化。多项研究表明术前开始多模式镇痛药物能够减轻患者术后疼痛和患者对于镇痛药的依赖并可使患者尽快康复[28-30]。术前应该针对患者的疼痛情况、用药史、目前的用药和既往药物的反应方面作出评估后,针对性使用镇痛药物。非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)类联合阿片类等镇痛药物联合使用规律镇痛;对于急性严重神经痛,可使用静脉NSAIDs药物,如结合肌松药物、脱水药物、消神经根水肿药物处理;术前使用普瑞巴林或加巴喷丁亦可抑制中枢和外周疼痛敏化作用以减轻围手术期疼痛[8]。
腰椎后路长节段手术切口长、组织破坏相对较严重、肌肉组织剥离切割较多,因此术后疼痛一般较重。多模式镇痛联合使用不同种低于常规剂量的镇痛药可减轻各种镇痛药物的副作用。术后常规进行疼痛评分,采用多模式镇痛。以NSAIDs为基础用药,加用中枢性镇痛、抗惊厥药(加巴喷丁、普瑞巴林等)。尽量减少阿片类药物的应用,以减少消化道不良反应的发生。使用患者自控镇痛(patient controlled analgesia,PCA)的患者需注意预防阿片类药物引起的恶心、呕吐。镇痛泵中除阿片类药物外可加入NSAIDs 药物加强镇痛。在足量规律使用NSAIDs类药的基础上,联合使用中枢性骨骼肌松弛剂(盐酸乙哌立松)和神经修复剂(甲钴胺)来进行神经根性疼痛管理。手术结束前用长效麻醉药罗哌因行局部切口浸润可明显缓解术后切口12 h疼痛情况[31,32]及减少常规镇痛药物使用。患者术后若对镇痛药物反应不佳,且有固定痛点,可酌情进行局部痛点阻滞治疗。
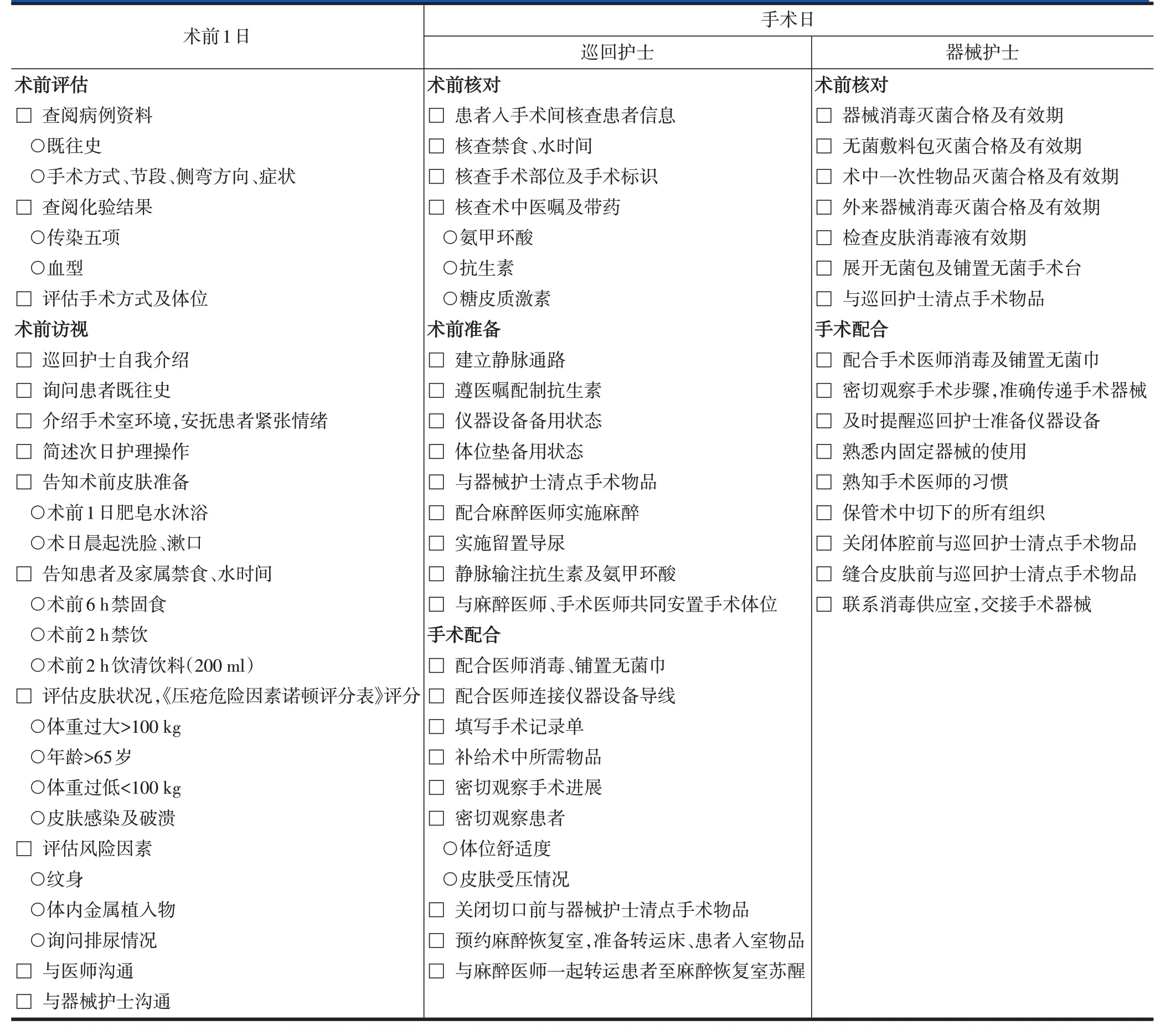
表4 腰椎后路长节段手术ERAS实施流程——手术室护士表单
8 麻醉管理
腰椎后路长节段手术常选用全身麻醉,ERAS 理念下的麻醉管理要求全面的麻醉监测、气道和呼吸道的管理、液体管理、体温监测和肌松监测。
8.1 麻醉监测
手术麻醉中除常规无创监测外应加强肌松监测、麻醉深度监测,如脑电双频指数(bispectral index,BIS)、有创血流动力学监测和凝血功能监测[8]。
8.2 气道管理及肺保护性通气策略
采用低潮气量(6~8 ml/kg),中度PEEP 5~8 cm H20,FiO2尽可能<60%,吸呼比1∶(1.5~2.0)。间断性肺复张性通气为防止肺不张的有效方法,应该至少在手术结束、气管拔管前实施1次。术中调整通气频率维持PaCO235~45 mmHg。
8.3 术中液体及循环管理
提倡以目标导向液体治疗(goal-directed therapy,GDT)的理念及措施指导液体治疗。ERAS液体管理目标为尽量减少机体体液量的改变。术中应用平衡液维持出入量平衡,避免输液过度引起的心功能不全和外周组织水肿,避免输液不足引起的隐匿性低血容量和组织低灌注,辅助应用血管收缩药物以防止术中低血压,降低低血压相关急性心肌损伤、急性肾损伤及术后肠梗阻的发生率。具体方法参考中华医学会外科学分会《外科病人围手术期液体治疗专家共识(2015)》及中华医学会麻醉学分会《中国麻醉学指南与专家共识》[8,9]。当预计出血量达到总血容量10%或>400 ml 时,建议予氨甲环酸等止血药和采用各种血液保护措施,如等容血液稀释、自体血回输和血液分离。
8.4 术中体温管理
多项研究表明手术中避免低体温可降低感染概率、降低出血量和缩短麻醉苏醒时间[33,34]。术中应常规进行体温监测并采取必要的保温措施,维持核心体温不低于36℃,预防发生低体温,如室温保持在21℃以上,使用温毯等加温措施;冲洗伤口的液体须加温至37℃;静脉输液需加温;尽量减少患者的身体暴露;使用保温毯或充气加温毯等措施,维持核心体温不低于36℃,也须注意防止体温过高。
8.5 肌松监测
腰椎后路长节段手术常要求深度肌松状态。行肌松监测以指导肌松药物的使用。长效肌松药物及术中低体温可延迟神经肌肉的功能恢复。术后应严格掌握拔管时机,避免肌松残留所致的呼吸无力及低氧血症,可常规予以肌松拮抗。
9 手术要点
腰椎后路长节段手术的重点在于解除神经压迫、恢复脊柱正常序列和矫正畸形[35],核心在于合适的体位摆放、合适的融合节段、安全的内固定位置、减少出血、避免神经损伤和正确的切口闭合。
腰椎后路长节段手术时间长,范围广,且患者可能存在不同程度的脊柱畸形。利用俯卧位垫悬空胸部和腹部或使用全碳纤维手术床,避免压迫胸腹影响呼吸和大血管受压影响循环;俯卧位注意受力点棉垫或琼脂垫保护以防压疮,同时确保男性生殖器和女性乳腺避免受压。
腰椎后路长节段手术的近端和远端固定椎都应选在中立椎体,避免选择旋转半脱位椎体;为了避免近端交界性后凸(proximal junctional kyphosis,PJK)和近端交界性失败(proximal junctional failure,PJF),近端椎应避免选择T5~T10。远端椎在以下情形建议延长至骶骨:①近端椎选择在T12及以上;②L5/S1椎间盘退行性变(L5-S1 矢状位Cobb≥15°);③L5/S1 椎间盘压迫硬膜囊神经根征象[36]。
建议术者术前仔细阅读患者影像学资料,了解目标手术节段的形态特点并及时发现可能存在的变异[37]。对于合并脊柱侧弯的患者,需警惕退行性变常导致副突与关节突关节之间距离减少,从而增加常规置钉侵入关节囊的可能。探针探及钉道时应全程触及,而非单纯的前部,尤其要注意距离进钉点2 cm左右区域的骨壁情况;定位针透视时,应尽量获取椎体的正侧位,定位针不突破侧位椎弓根上下缘,正位针尖一般位于椎弓根应内壁与棘突中央,若与棘突重叠,应仔细评估椎弓根内壁情况;完成置钉后应及时进行正侧位的术中透视;对于第2 骶椎骶髂螺钉(sacral-2 alar iliac,S2AI)固定应加以斜位片透视;对于畸形明显的患者,术中CT、导航或脊柱手术机器人可作为提高内固定准确率的备选方法[38,39]。
腰椎后路长节段手术出血主要源于分离软组织和肌肉损伤及椎管内的静脉丛损伤。减少出血应从关注俯卧位体位摆放开始,使胸腹部悬空避免受压,以降低椎管内静脉丛压,椎管内静脉前丛紧贴椎间盘,在切除椎间盘时易损伤导致出血,同时椎管侧隐窝减压及椎间融合[40,41]时应该警惕严重出血的发生,可使用双极电凝进行止血,邻近神经根周围使用双极应将功率控制15 W之内[42]。双极电凝控制不佳的静脉丛出血,可使用明胶海绵填塞和脑棉片压迫方法来控制。术前使用氨甲环酸能明显降低术中、术后的出血量,切皮前开始用10~20 mg/kg 的氨甲环酸负荷剂量序贯1 mg/(kg·h)的持续静脉滴注可有效减少失血且耐受性较好[43]。
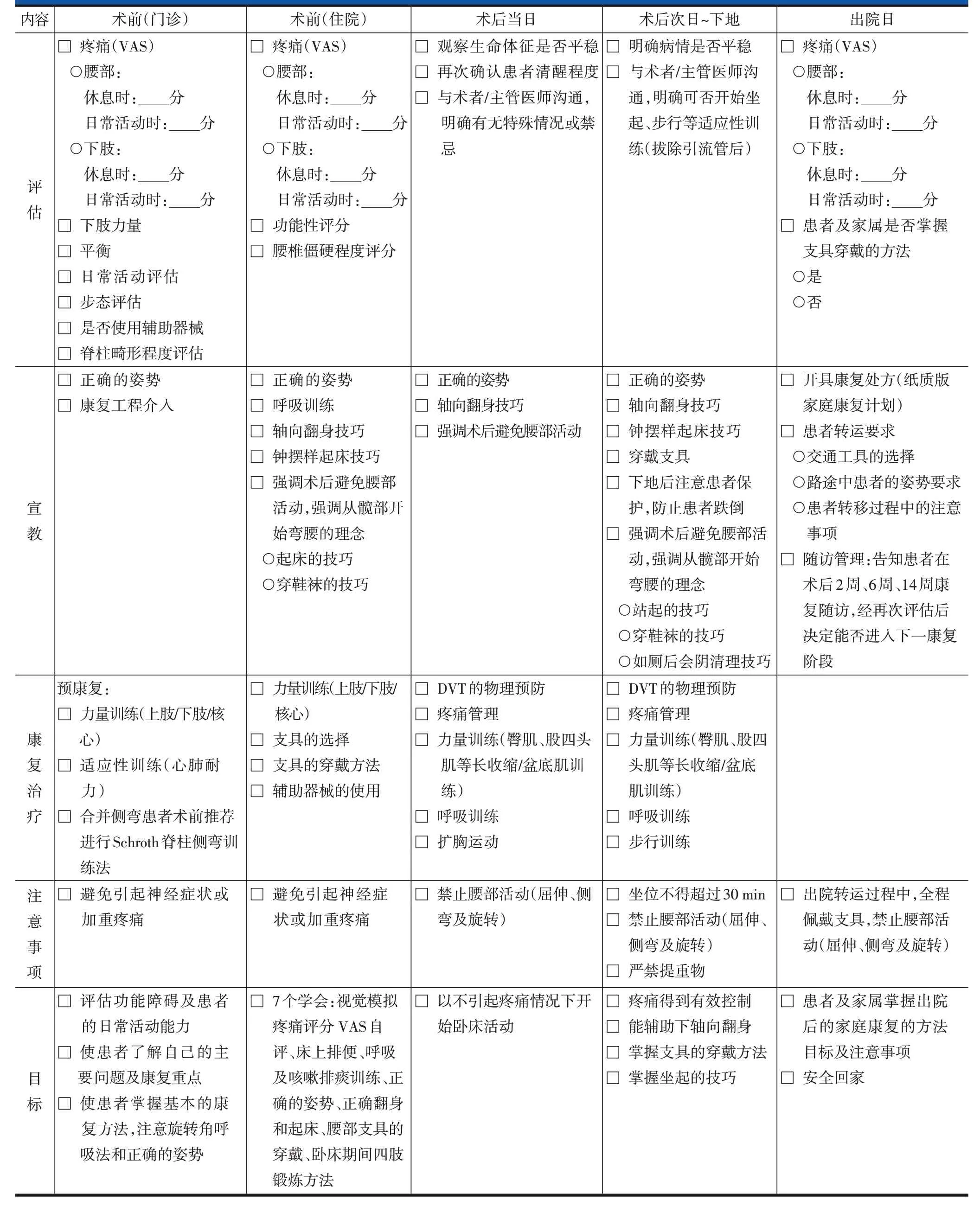
表5 腰椎后路长节段手术ERAS实施流程——康复医师表单
术中应强调规范操作,仔细分离,助手在减压、融合器植入等关键步骤应注意保护好神经根和硬膜囊。可使用显微镜辅助技术或佩戴头戴式手术放大镜以放大手术视野、增强术区光源及减少硬膜囊、神经根损伤[44-47]。若不慎造成硬膜囊损伤导致脑脊液漏,应调整体位,还纳神经,争取一期缝合硬膜囊,腹侧硬膜囊或神经根周围硬膜等无法缝合的部位,应使用脂肪、肌肉、明胶海绵等组织进行填塞覆盖,切口严密缝合并接无负压引流[48]。
在反复冲洗、仔细止血、确认器械纱布无遗漏之后,进行分层缝合。腰背筋膜层的严密缝合是减少切口并发症的基础,需严密缝合至棘突中线结构,保持一定的抗张力强度,要求头尾段不留死角。皮下组织层活动度大,缝合时需注意对合,同时避免脂肪组织切割,以此保证皮肤在闭合的过程中没有明显的张力,降低瘢痕形成的概率。采用可吸收倒刺缝线进行各层次的缝合,节约切口关闭时间,从而减少间断缝合切口内操作时的污染概率[49,50]。采用含三氯生涂层可吸收缝线进行缝合可减低术后伤口感染的概率[51]。对于有条件的单位可在手术切口使用新型带网片的皮肤胶,可有效减少由于摩擦而引起的愈合不良[52,53]。
10 术后呼吸道管理
术后对于呼吸功能平稳的患者,在有效镇痛治疗下,鼓励并协助患者尽早进行深呼吸及有效咳嗽,采用体位引流、胸背部拍击等方法,保持呼吸道通畅,促进痰液排出及肺复张。避免支具过紧以影响患者呼吸。医师亦应注意监测胸部体征,如有异常则需对症处理。术后高浓度(FiO2>80%)吸氧能够明显降低术后恶心、呕吐、肺不张和伤口感染的发生概率[54],对于无禁忌的患者可考虑使用。
11 术后消化道管理
11.1 PONV管理
PONV 的危险因素包括年龄(<50 岁)、女性、非吸烟者、晕动病或术后恶心呕吐病史及术后予阿片类药物。腰椎后路长节段手术有PONV 风险的患者应预防性使用止吐药,如5-HT3受体拮抗剂、地塞米松和氟哌利多,围手术期阿片类药物用量最小化;如果患者发生恶心、呕吐时,可以联合使用这些药物。对于顽固性PONV 可合并使用小剂量吩噻嗪类药物或静注小剂量丙泊酚[55]。
对于腰椎后路长节段患者术后出现持续腹痛、恶心呕吐不缓解应警惕畸形矫正术后肠系膜上动脉综合征(superior mesenteric artery syndrome,SMAS)的可能。如发生矫形术后可疑SMAS应行上消化道造影检查,确诊后经禁食水、静脉补液、药物止吐和体位改变等治疗一般均可好转,通常无需进一步腹部手术[56]。
11.2 术后胃肠道及营养管理
腰椎后路长节段术后提倡限制输液,待患者血压平稳、恢复进食后可停止输液。此外应减少使用阿片类镇痛药,鼓励患者早期恢复口服进食,早期下地活动等。术后2~4 h 无恶心呕吐,可鼓励患者口服常温流质食物,进食量不超过200 ml。初次进食3~4 h后可根据胃肠耐受量增加进食次数和进食量。使用胃肠动力药物治疗术后腹胀。
12 医用管路管理
12.1 导尿管
留置尿管患者女性麻醉清醒后拔管,男性术后第2 天清晨拔除导尿管。对于具有尿潴留高危因素的患者(男性、高龄、麻醉时间>200 min),可适当延长拔管时间[57]。
12.2 术区引流
脊柱术后常规留置切口引流管以缓解术区肿胀,但也增加了感染和失血增加的风险。然而目前对于脊柱术后是否应该常规留置引流管虽未形成共识,但留置引流管可预防切口血肿,对于可能发生的脑脊液漏有治疗作用,目前仍然建议术后常规留置引流管。建议每日观察引流,早期拔除引流管,24 h 引流量<50 ml拔除引流管。对于术后发现出现硬膜撕裂的患者,早期拔除引流管或延长置管时间均有良好的治疗效果,对严重脑脊液漏者可行腰大池引流[48]。
13 抗生素管理
建议常规应用第1 至第2 代头孢菌素预防性抗感染治疗,头孢菌素过敏者建议使用万古霉素和克林霉素;应在切开皮肤前30 min至1 h输注完毕抗生素,手术时间超过3 h 或超过使用药物半衰期2 倍以上,或成人术中出血量超过1500 ml,术中应追加1次;多数指南推荐术后预防性抗生素使用不建议超过24 h[58-60],但是应当具体结合患者情况合理预防性使用抗生素。若出现呼吸系统感染、泌尿系感染等其他系统感染则建议常规留取标本培养,培养结果出来之前请相关科室医师会诊共同决定抗生素的使用,培养结果出来后针对性合理使用抗生素。
14 术后血栓预防方案
术后采用基础预防结合物理预防(间歇充气加压装置及梯度压力弹力袜等)的方式预防下肢深静脉血栓。有高出血风险的脊柱后路手术患者,推荐采用物理预防,不推荐抗凝药物预防[61]。
15 术后康复锻炼
建议术后患者麻醉清醒后即可开始进行简单的康复锻炼,踝泵运动和股四头肌锻炼可促进机体血液循环预防下肢深静脉血栓等并发症;进行深呼吸和有效咳嗽有助于呼吸功能的恢复[62]。腰椎后路长节段手术术后早期下地能够明显降低术后并发症发生率并缩短患者的术后住院时间[63],术后应结合患者的引流量、疼痛程度、PONV的发生情况,鼓励患者尽早佩戴支具下地,如不能下地则建议患者尽早在床上进行肢体活动锻炼、翻身练习等。
出院后患者多数已经恢复一些简单的日常生活活动,此期间患者主要通过个性化康复锻炼增强腰背肌力,提高脊柱的稳定性(肚脐内缩、腹肌绷紧、骨盆后倾训练),进而改善腰背肌功能,后期根据个体情况结合评估可指导患者逐渐增加步行训练、下肢及核心力量训练[64]。
专家组成员(按姓氏笔画)
丁 琛 马亚群 王思亮 王诗军 毛海青 刘西芳 刘 浩 刘 楠 闫 航 孙天胜 孙 宇 孙浩林
孙 维 杜 培 李 放 李 莉 李淳德 李 静 杨惠林 邱贵兴 邹叶芳 沈建雄 宋琳琳 张志成
张 蕾 陈 峰 苑 垒 周非非 周谋望 郑林宏 郑博隆 孟 浩 郝定均 洪 瑛 贺宝荣 殷国勇
郭 航 唐 帅 越 雷 韩 彬 嵇富海 蔡思逸
说明:本共识为《脊柱手术加速康复外科实施流程专家共识》系列共识之一,为方便读者阅读,系列共识中的部分段落有重复,不属于学术不端范围,特此说明。

