椎体成形术和椎体后凸成形术加速康复实施流程专家共识
毛海青 周非非 蔡思逸 陈峰 孙浩林 越雷 张志成 孟浩 孙维 郭航 丁琛 殷国勇 贺宝荣 刘浩* 杨惠林* 孙宇* 李淳德* 沈建雄* 孙天胜* 邱贵兴*
(1.苏州大学附属第一医院骨科,江苏苏州 215006;2.北京大学第三医院骨科,北京 100191;3.中国医学科学院北京协和医学院北京协和医院骨科,北京 100730;4.北京大学第一医院骨科,北京 100034;中国人民解放军总医院第七医学中心5.骨科,6.麻醉科,北京 100700;7.四川大学华西医院骨科,成都 610041;8.南京医科大学第一附属医院骨科,南京 210029;9.西安交通大学附属红会医院脊柱外科,西安 710054)
骨质疏松性椎体压缩骨折(osteoporotic vertebral compression fracture,OVCF)通常是指由于原发性骨质疏松症导致脊柱椎体骨密度和骨质量下降,骨强度减低,在轻微外伤甚至没有明显外伤的情况下发生的椎体压缩骨折[1]。OVCF 保守治疗效果不佳[2,3],经皮椎体成形术(percutaneous vertebroplasty,PVP)和经皮椎体后凸成形术(percutaneous kyphoplasty,PKP)是治疗OVCF 常用微创手术方法[4,5]。加速康复外科(enhanced recovery after surgery,ERAS)通过多学科协作,对围手术期各项措施进行优化,能有效减少患者围手术期的应激反应和相关并发症,促进患者康复[6,7],但临床实际应用中仍面临各种困难[8,9]。经全国脊柱外科专家组多次讨论,在循证医学的基础上,针对这两种常用手术的ERAS实施流程达成共识,供脊柱外科医师及相关学科人员在临床应用中参考。该流程的实施需脊柱外科医师、麻醉医师、康复医师、病房护士及手术室护士等多学科团队配合完成。为了便于临床操作,制定了各科室成员在围手术期各个阶段的任务表单,详见表1~5。
1 PVP/PKP手术的定义
PVP/PKP 手术主要指适用于胸腰椎OVCF 的经皮椎体强化手术。手术入路和方式包括经椎弓根途径及椎弓根外途径;直接骨水泥灌注、球囊扩张后骨水泥灌注、骨填充网袋扩张灌注等。
2 PVP/PKP手术目的及围手术期ERAS进程主要问题
OVCF使骨折椎体高度丢失,导致后凸畸形,产生顽固性背痛,使患者活动减少,骨量进一步丢失,再骨折的概率增加[10],从而陷入恶性循环,许多患者最终因并发症而死亡[2]。PVP/PKP手术的目的是强化骨折椎体,缓解疼痛,使患者早期下床活动,恢复日常生活。
由于OVCF患者多为高龄老人,除了罹患严重的骨质疏松症外,通常合并各种内科疾病。PVP/PKP手术虽然能有效强化骨折椎体,但存在一定的手术风险和手术并发症。如何减少围手术期患者心理、生理的应激反应,帮助患者加速康复,将涉及到以下几个主要问题:OVCF 的诊断;疼痛责任椎的判定;OVCF 骨折不愈合的评估;术前内科合并症的评估;术中骨水泥渗漏的预防和处理;术后规范的抗骨质疏松治疗和再骨折预防。
3 OVCF的诊断
大多数OVCF 患者无明显外伤或仅有轻度外伤史,如扭伤、坐车颠簸或平地滑倒,有些甚至因为咳嗽、喷嚏、弯腰等日常动作引起骨折。一般以急性或慢性腰背部、胸背部疼痛为主要症状。疼痛通常在卧床休息时减轻,但在改变体位或脊柱承担负荷时加重。严重的OVCF 特别是多节段骨折可导致脊柱后凸畸形[11]。查体如果发现与影像学表现一致的脊柱节段压、叩痛,结合骨密度检查,通常可以确诊OVCF。患者入院后检查血、尿常规,肝肾功能,血钙、磷、碱性磷酸酶等,可选择性检查红细胞沉降率、C反应蛋白、性腺激素、血清25羟基维生素D、1,25二羟维生素D、甲状旁腺激素、24 h尿钙和磷、甲状腺功能、皮质醇、血气分析、血尿轻链、肿瘤标志物、放射性核素骨扫描、骨髓穿刺或骨活检等,结合病椎X线、CT 和MRI 影像学检查,有助于发现和排除转移性骨肿瘤、胸腰椎结核、多发性骨髓瘤、甲状旁腺功能亢进、类风湿性关节炎等导致的继发性骨质疏松及各种先天或获得性骨代谢异常疾病[12,13]。
4 疼痛责任椎的判定
OVCF患者常有多个椎体压缩改变,但并非每个压缩改变的椎体,都需行手术治疗。陈旧的压缩骨折,椎体外形虽有压缩改变,但骨折已愈合,无需行手术治疗;相反,部分椎体骨折虽无压缩改变,但实为新鲜骨折[14]。因此,对于老年骨质疏松患者,X 线片上椎体的压缩程度与病史长短常不能判断该椎体是否导致疼痛,即是否为疼痛责任椎[15]。疼痛责任椎体的判定需结合患者的症状、体格检查及核磁共振检查[16]:①患者有明确的腰背痛症状;②体格检查相应节段有压、叩痛;③MRI 显示相应节段椎体内有水肿信号,表现为T1加权像低信号、T2加权像高信号或等信号及脂肪抑制序列成像高信号;MRI检查有禁忌证者,应行核素骨扫描,并显示相应节段核素浓集。
5 评估
加速康复措施的个体化,应以患者的全面评估为基础。OVCF 围手术期ERAS 实施策略应“从评估开始,以评估结束”。
5.1 脊柱外科手术基本评估
5.1.1 美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级评估:根据ASA 分级对患者全身健康情况与疾病严重程度进行评估,初步判断患者对围手术期应激反应的耐受力[17]。
5.1.2 心肺功能评估:采用美国纽约心脏病学会(New York Heart Association,NYHA)心功能分级和代谢当量(metabolic equivalent of task,MET)评估患者心功能。常规检查胸片判断有无呼吸系统合并症。对于疑有呼吸功能异常患者通过肺功能检查判断有无通气及换气功能障碍。通过屏气试验来评估患者的心肺储备能力,预测其对缺氧的耐受性。
5.1.3 凝血功能评估:通过病史采集、体格检查及术前实验室凝血功能检查可发现患者是否存在可能增加围手术期出血的相关疾病。
5.1.4 血糖评估:建议将空腹血糖控制在5.6~10.0 mmol/L 之间,随机血糖控制在12.0 mmol/L 以内[18]。术前应将原有降糖方案过渡至胰岛素,并根据禁食情况减去控制餐后血糖的胰岛素剂量。糖尿病患者手术当日停用口服降糖药和非胰岛素注射剂,停药期间监测血糖,使用常规胰岛素控制血糖水平[19]。
5.1.5 高血压评估:术前了解患者高血压病因、病程、程度、靶器官受累情况。建议择期手术前,中青年患者血压控制<130/85 mmHg,老年患者<140/90 mmHg 为宜。合并糖尿病的高血压患者,应降至130/80 mmHg以下[18]。必要时请心内科医师会诊并指导治疗。
5.1.6 营养评估:术前进行营养风险筛查,采用欧洲肠内肠外营养协会营养风险筛查量表(nutrition risk screening,NRS)2002 评估手术患者是否存在营养风险。以NRS 评分≥3 分者为存在营养风险,请营养科介入,制定营养治疗计划。
5.1.7 术后恶心呕吐(postoperative nausea and vomiting,PONV)风险评估:对于女性、不吸烟者、晕动症患者或既往有恶心呕吐病史者,以及术后应用阿片类药物的患者[20],注意识别并采取相应的防治措施。
5.1.8 术后谵妄(postoperative delirium,POD)易感因素评估:高龄、认知功能障碍、合并多种内科疾病、摄入减少、生理功能储备减少、多种药物应用、酗酒为术后谵妄的易感因素[21],对于此类人群应识别并采取相应的预防措施。
5.1.9 尿潴留风险评估:对于年龄>50 岁、男性、术前存在尿道梗阻症状和与尿潴留相关的神经性疾病及围手术期应用抗胆碱能药物、β 受体阻滞剂的患者,可采用国际前列腺症状评分(international prostate symptom score,IPSS)评估术前膀胱功能,并预测术后尿潴留的风险[22,23]。
5.1.10 静脉血栓风险评估:对于瘫痪、高龄、肥胖、静脉曲张、脑梗塞、血栓病史及家族史、D二聚体增高等具有深静脉血栓及肺栓塞高危因素的患者可采用Wells血栓风险评分表进行评估[24,25]。
5.2 PVP/PKP手术专项评估
5.2.1 腰腿痛及功能评估:可采用视觉模拟评分(visual analogue score,VAS)和Oswestry功能障碍指数(Oswestry disability index,ODI)等对腰腿疼痛及功能进行评估[26]。
5.2.2 骨质疏松评估:骨密度检查:目前国际公认的检查方法为双能X线吸收法(dual energy X-ray absorptiometry,DXA),参照WHO推荐的诊断标准,DXA测定T 值≥-1.0 SD 为正常;-2.5 SD<T 值<-1.0 SD 为骨量低下或骨量减少;T 值≤-2.5 SD 为骨质疏松[27,28]。DXA常见检查部位为腰椎(L1~L4)和股骨颈,其精确性受局部骨组织增生、软组织钙化、患者体位、仪器精准度及检查者操作规范等影响,因此诊断仍需结合临床情况全面分析。骨代谢检查:骨转换生化标志物是在骨重塑的不同阶段由成骨细胞和破骨细胞产生、释放的蛋白质或基质降解产物,分为骨形成标志物和骨吸收标志物。测定骨转换标志物有助于骨转换类型、骨丢失速率、骨折风险评估,为了解患者骨质疏松病程进展、指导用药及疗效评定提供客观依据。推荐Ⅰ型原胶原N-端前肽和Ⅰ型胶原交联C-端肽这两个特异性较好的骨形成和骨吸收标志物[13]。
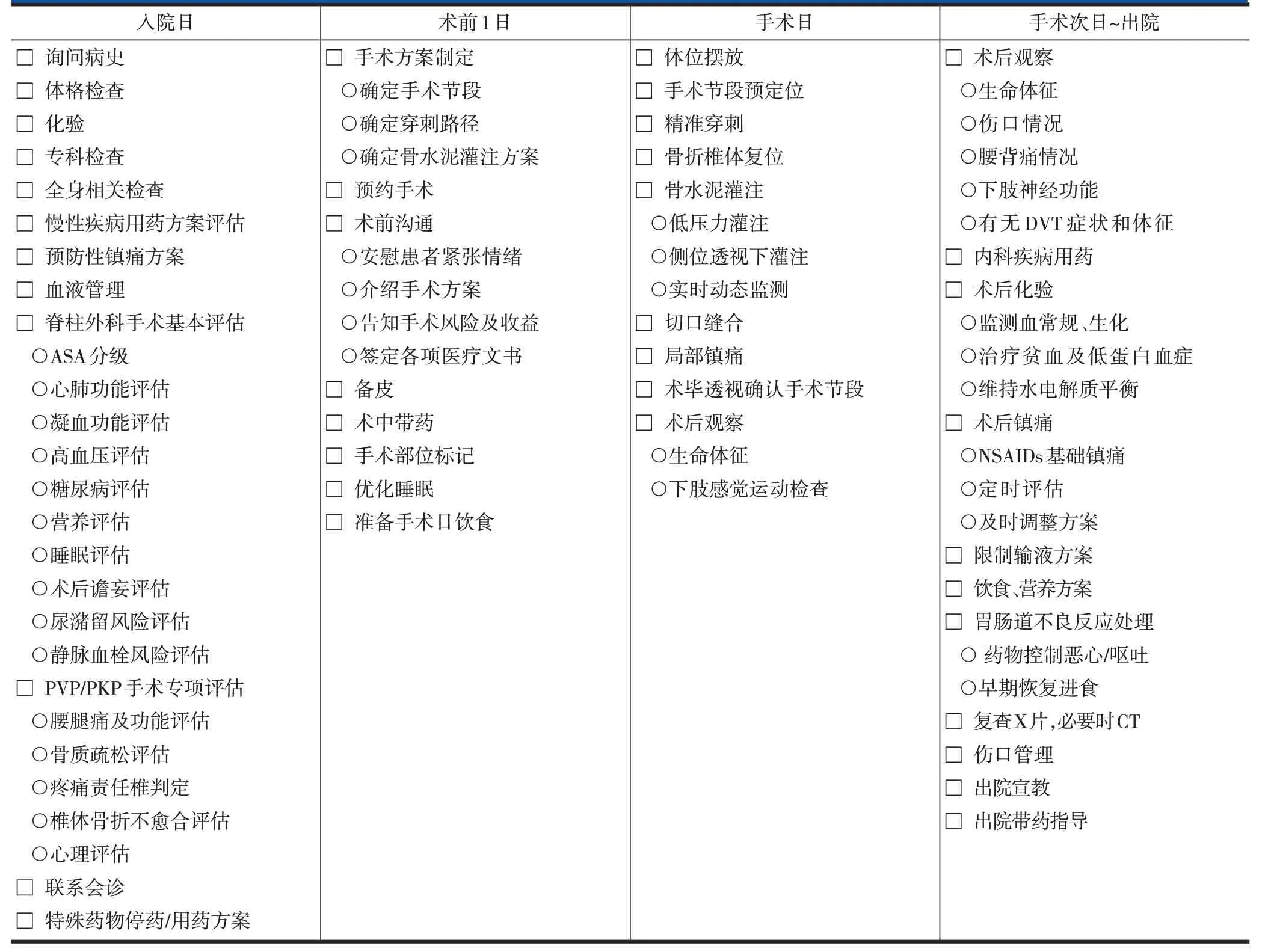
表1 椎体成形术和椎体后凸成形术ERAS实施流程——外科医师表单
5.2.3 骨折不愈合的评估:OVCF患者骨折愈合能力弱,易发生骨折不愈合,术中骨水泥渗漏发生率达75%[29]。如OVCF患者术前评估满足如下条件,可诊断为骨折不愈合[30]:①常无明显外伤史或轻微外伤史后出现腰背部疼痛数月,脊柱承载负荷或改变体位时疼痛加重;②查体可见棘突叩击痛明显;③CT或MRI可见椎体内“真空征”或“裂隙征”,动力位X线片可见骨折椎体前缘高度变化,椎体异常活动,有假关节形成。
5.2.4 心理评估:OVCF不仅导致患者疼痛、残疾和生活质量下降,且由于疼痛及对跌倒的畏惧,患者长期卧床,不愿活动,与社会隔离,容易产生心理问题。入院后可采用患者健康状况问卷-9(patient health questionnaire-9,PHQ-9)[31]和广泛性焦虑自评量表-7(generalized anxiety disorder-7,GAD-7)进行抑郁和焦虑自评,如果发现中度以上的焦虑和抑郁,需要采用汉密尔顿抑郁量表(Hamilton depression rating,HAM-D)[32]和汉密尔顿焦虑量表(Hamilton anxiety rating scale,HAMA)进行他评,需咨询精神科医师,进行干预。
5.2.5 康复评估:对于所有患者都应进行康复评估,目的是制定个体化的康复治疗方案。术前评估的重点应放在现有疼痛程度(VAS评分)、伤前的日常生活活动能力评估[改良Barthel 指数(modified Barthel index,MBI)]及身心健康状况评估(SF-36),用以了解患者伤前的日常生活状态;术后评估主要包括疼痛程度(VAS评分)及跌倒风险评估[起坐试验(Sit-to-Stand test,STS)[33]、功能伸展测试(functional reach test,FRT)[34]、起立行走试验(timed up-and-go test,TUG)[35]],以便有针对性的指导康复锻炼,防止再次受伤或跌倒。
6 宣教
PVP/PKP 围手术期ERAS倡导由外科医师、麻醉医师、病房与手术室护士、康复医师组成的多学科协作诊疗,应从患者入院后的综合宣教开始。通过宣教使患者了解骨质疏松症发生的原因、OVCF的疾病特点和导致疼痛的机制、患者所患基础疾病,如高血压、糖尿病、脑血管疾病的相关知识,微创手术的必要性及优缺点,积极规范的抗骨质疏松治疗及预防跌倒和再次骨折的重要性等。熟悉手术、麻醉、护理、康复过程,了解可能遇到的困难及相应预案,从而调整患者的期望值,提高患者的依从性[36]。
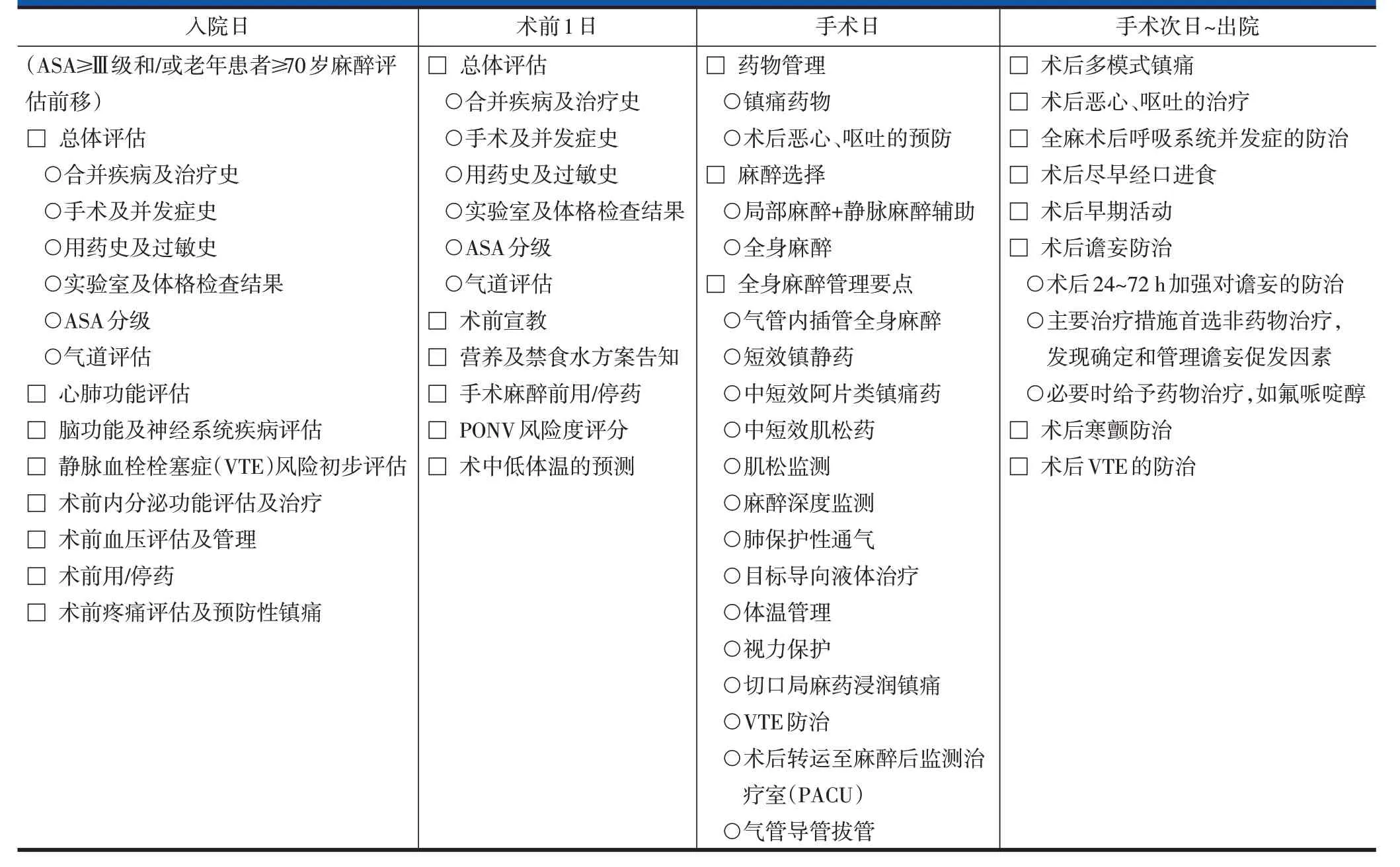
表2 椎体成形术和椎体后凸成形术ERAS实施流程——麻醉医师表单
入院后让患者掌握自我评估方法和正确的康复锻炼方法,学会疼痛自评、床上排便、有效呼吸和咳嗽排痰、腰围的穿戴、床上进行下肢功能锻炼、床上轴线翻身、床上移动、上下床、行走和坐的正确动作等。通过健康宣教,树立患者的自信心,提高患者参与诊疗过程的积极性,建立对加速康复的愿景。
7 麻醉要点
PVP/PKP手术可选用局部麻醉或全身麻醉。优化围手术期麻醉管理策略有利于减少全身应激,对于提高围手术期安全性、舒适性,降低围手术期并发症至关重要[37,38]。对于ASA 评分≥Ⅲ级和/或≥70 岁的患者,临床医师有必要请麻醉医师提前介入,进行围手术期手术麻醉风险评估及建议,降低围手术期手术麻醉风险。
由于PKP/PVP手术患者年龄较大,如果采用全身麻醉,宜采用保护性肺通气策略,低Vt(6~8 ml/kg),中度PEEP(5~8 cm H20),FiO2<60%,吸呼比1∶2.0~2.5,呼吸频率8~12 bpm。间断性肺复张性通气为防止肺不张的有效方法,应该至少在手术结束、气管拔管前实施1次[37]。高龄患者给予有创循环监测,必要的麻醉深度监测,如脑电双频指数(bispectral index,BIS)等。
PKP/PVP 手术时间短,术中出血极少,因此术中输液以晶体液为主,输液速度1~2 ml/kg/h,避免因容量负荷过多导致组织水肿[39]。对于心肺功能不全的患者,在维持重要器官有效灌注的前提下,应适当减少液体量。在骨水泥灌注时应严密观测,保持患者生命体征平稳。
术中常规监测体温及采取必要的保温措施。患者进入手术室前30 min 调节室温至23℃~25℃,及时加盖棉被,减少患者皮肤暴露时间。可使用充气式保温毯,在术前30 min预保温,并根据术中温度监测及时调整加温设备的温度[40]。在骨水泥调制和灌注时手术室室温较低,此时应加强保暖。使用输液加温仪对静脉输注的液体进行加温。
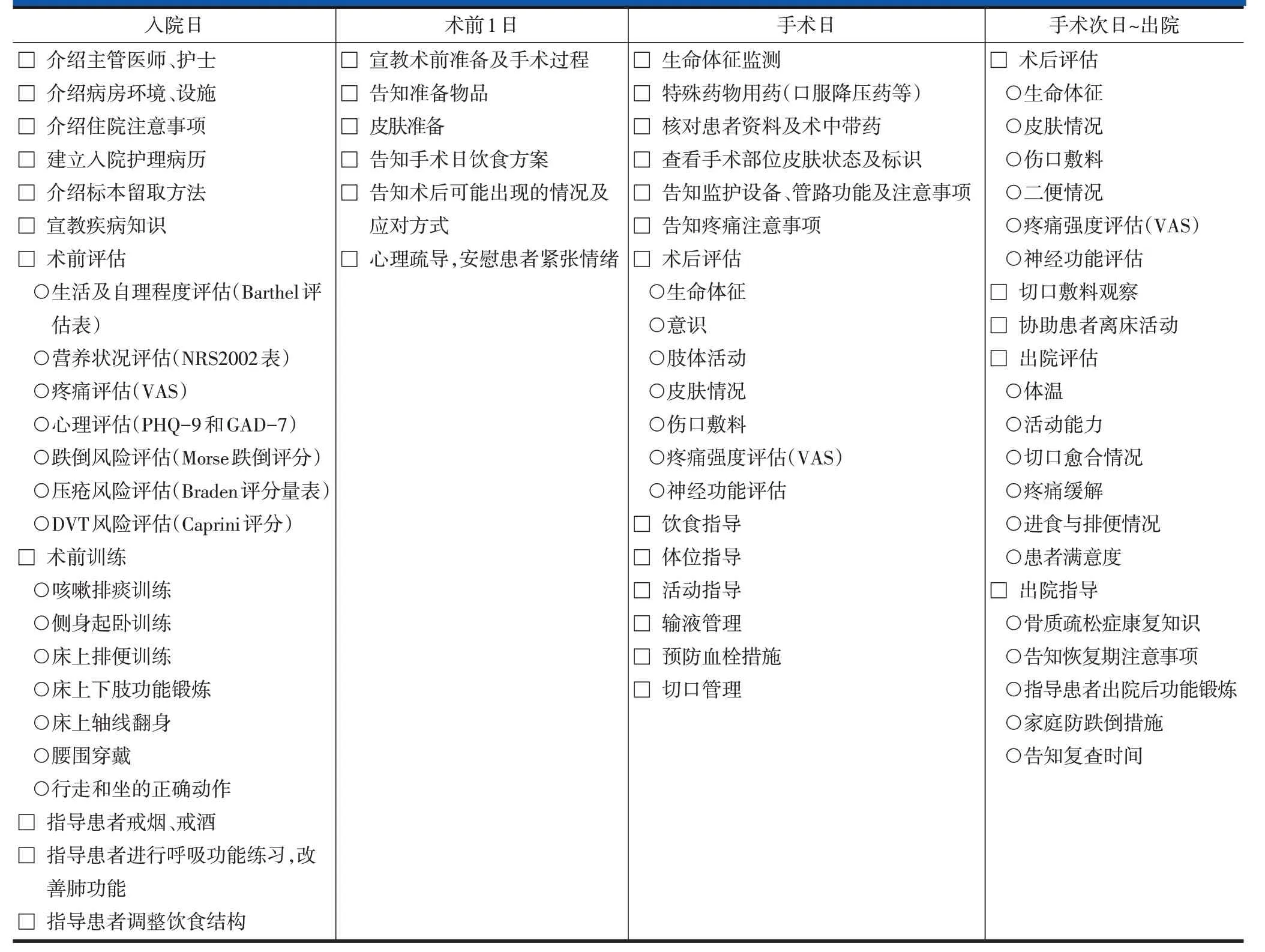
表3 椎体成形术和椎体后凸成形术ERAS实施流程-病房护士表单
8 手术要点
患者通常取俯卧位,如果选用局部麻醉,患者应能俯卧不少于1 h且不感到明显疼痛或呼吸困难。极少数患者由于肋骨骨折、肋软骨炎导致胸壁疼痛,或因心肺功能不好,不能耐受完全俯卧位,可根据具体情况采取其他体位,如侧卧或侧俯卧位,但须注意侧卧或侧俯卧位时术中患者可能改变体位影响穿刺准确性。
8.1 标准化的安全穿刺技术
穿刺前行“一线影”基准定位是安全穿刺的基础。调整C型臂X线机X线投照方向,使手术椎体终板、椎体后缘均呈“一线影”,正位像两侧椎弓根对称并与棘突距离相同,侧位像椎弓根影完全重合。穿刺时,建议采用锤击进针技术,可控的进行穿刺,防止穿刺针轻易穿破椎体前方、椎弓根下壁或内侧壁的皮质,避免穿刺损伤[41]。应在正位透视下穿刺进针,当穿刺针针尖接近椎弓根影的内缘时,侧位透视针尖应达椎体后缘。
球囊应尽量置于伤椎的前中部,位于塌陷终板的下方或上下终板的中间位置。此时,球囊扩张既能有效地抬高终板,又能减少球囊撑破椎体终板的风险。此外,球囊扩张所产生的空腔位于椎体的前中部,空腔与椎体后缘之间有骨质相隔,减少了骨水泥向后渗漏进入椎管的风险。
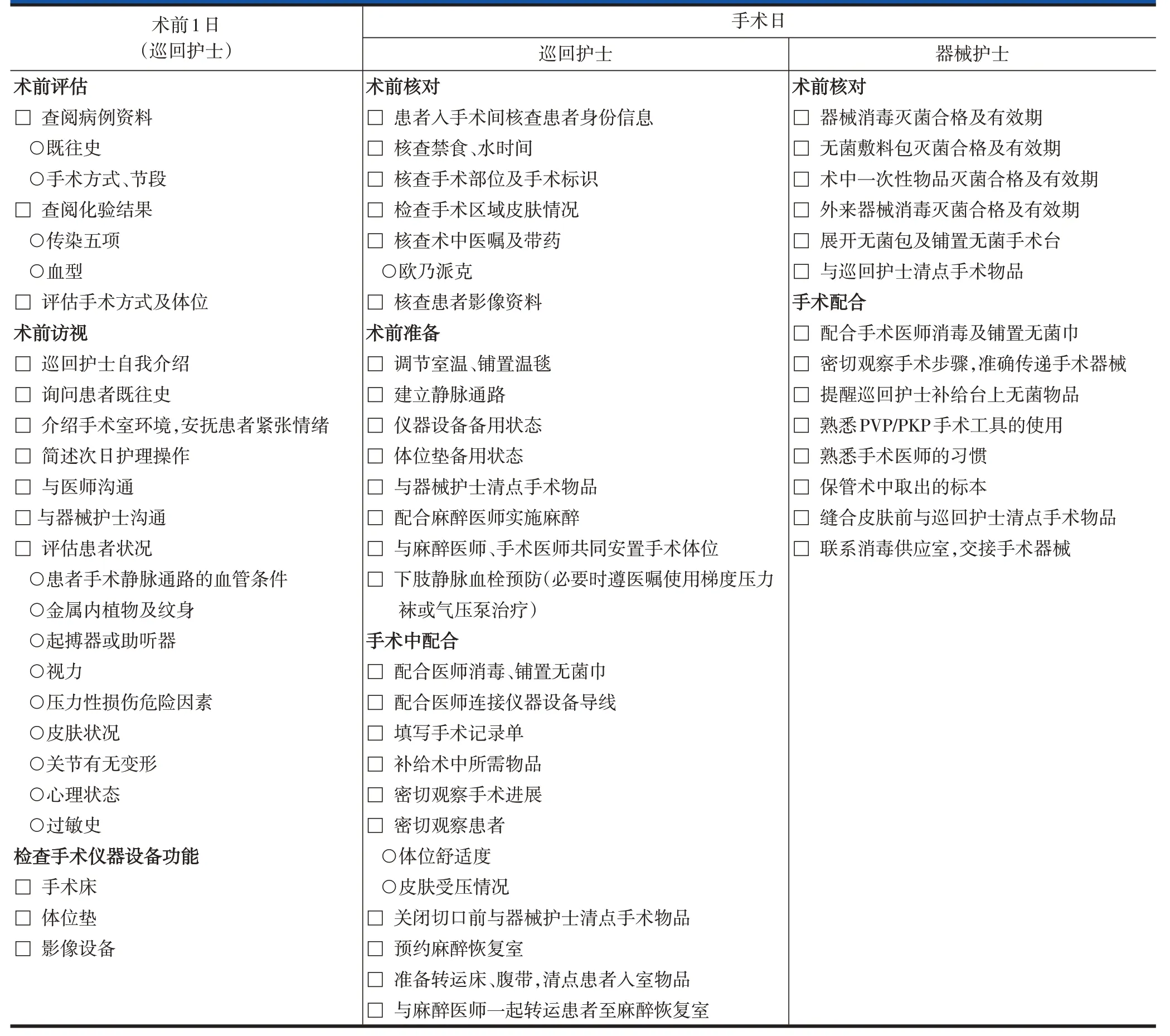
表4 椎体成形术和椎体后凸成形术ERAS实施流程——手术室护士表单
骨水泥应在侧位透视实时监测下,缓慢、低压的状态下注入椎体。根据骨折类型及椎体周壁破损情况,采用不同的骨水泥灌注技术,避免术中骨水泥渗漏,特别是通过椎体后壁渗漏进入椎管。
8.2 骨水泥渗漏的预防和处理
采用如下技术可有效防止骨水泥渗漏:①穿刺过程中,应全程采用锤击步进进针技术,以使工作通道与周围骨质紧密接触,防止灌注过程中骨水泥反向渗漏;②灌注的骨水泥应为拉丝后期或团状早期,既可防止过早注射导致骨水泥渗漏,又避免了注射太晚而使骨水泥推注困难,或骨水泥局限于球囊扩张的空腔内,不与周缘松质骨形成牢固锚合;③灌注过程要全程保持低压、缓慢灌注,如果灌注压力过高、灌注速度过快,会使得骨水泥在椎体内流动速率过快、流动强度过高,容易发生渗漏[42]。
骨水泥渗漏的处理:①骨水泥椎管内渗漏无明显神经症状时,可予以观察,不需特殊处理;②若出现骨水泥压迫脊髓症状,尽早使用激素、脱水药物,减轻脊髓水肿,防止继发性损伤,同时行CT或MRI检查明确压迫位置和程度,并急诊行椎管内减压术;③骨水泥渗漏出现神经根受压表现时,根据压迫症状的严重程度,选择药物治疗或神经根减压术;④对于骨水泥椎旁软组织内、椎间盘内渗漏,一般均不引起特殊临床症状,不需特殊处理,若有软组织酸痛等不适,可予以非甾体抗炎药对症处理。
8.3 特殊骨折的处理
OVCF骨不愈合患者椎体内存在空腔裂隙,裂隙周缘常伴硬化、疤痕覆盖,椎体周壁常伴较大缺损,因此采用常规的PKP治疗,骨水泥极易渗漏,甚至骨水泥整体脱出。对于此类特殊病例的治疗,应采用骨水泥-骨锚合技术[30],用PKP 专用刮匙对硬化的周壁进行点状处理,形成粗糙锚合面,再行骨水泥灌注,可使骨水泥在椎体内充分弥散,与周围骨质有效锚合。部分伴椎体内巨大空腔的OVCF骨不愈合患者,骨水泥灌注结束前可残留部分骨水泥拖尾在椎弓根内,以增加锚合面积,防止术后骨水泥松动、移位。
部分OVCF 骨折严重,椎体内骨折裂隙大,并与椎体周壁连通。对于此类患者,可采用温度梯度灌注技术[43],即先向椎体内注入20℃调制的骨水泥,当骨水泥沿骨折线流至椎体周壁时,暂停1~2 min,待椎体周壁处的骨水泥先凝固,再继续灌注,可有效防止骨水泥沿骨折线渗漏。
对于周壁存在较大缺损的OVCF,可采用骨水泥二次调制灌注封堵技术。首次调制骨水泥,将处于团状期中期的骨水泥注入,在椎体缺损处形成一堵墙,实现缺损封堵,第二次调制骨水泥,将处于拉丝晚期或团状早期的骨水泥,低压、缓慢地注入骨折椎体内,实现骨锚合[44]。
9 防栓管理
由于OVCF患者多为高龄老人,加之腰背疼痛限制活动,部分患者卧床时间较长,使静脉血栓形成的风险增高。应对患者进行血栓风险评估,如Caprini评分,Wells评分或Autar评分[45]。进行下肢深静脉彩超和D-二聚体筛查,必要时行血栓弹力图(thrombelastography,TEG)对凝血状态进一步评估。术前应对患者及家属进行预防深静脉血栓的知识教育,训练患者床上锻炼下肢功能。术后大多数患者疼痛迅速缓解,患者如能离床进行康复锻炼,可以不使用物理预防措施。但对于高危患者,术后仍继续应用足底静脉泵、间歇充气加压装置及梯度压力弹力袜等措施预防血栓形成;对于合并数个危险因素的患者,在无出血风险情况下,可采用低分子肝素联合使用充气加压装置/弹力袜预防,药物预防(主要为低分子肝素)于术后24~36 h 内开始应用[45,46]。
10 疼痛管理
提倡预防性镇痛的理念[47],对患者术前、术中和术后全程进行疼痛管理,预防外周和中枢敏化,降低术中应激和炎症反应,降低术后疼痛强度,减少急性疼痛向慢性疼痛的转化。术前采用以非甾体抗炎药为基础的多模式镇痛方案[48]。选择性COX-2抑制剂可发挥抗炎、抑制中枢和外周敏化作用,具有良好的胃肠道安全性[49],与其他非甾体抗炎药相比,并不增加心血管风险[50]。由于大多数患者术后疼痛得到迅速缓解,可以减少甚至停用镇痛药物,通常不需要应用镇痛泵和阿片类药物。如果患者术后腰背疼痛无明显缓解或出现下肢放射痛,应积极查找原因,排除疼痛责任椎判断失误、术中骨水泥渗漏、脊柱病理性骨折等可能因素。
11 康复
虽然目前尚没有获得循证支持的针对OVCF 患者康复的有效方案[51],但多项研究证实康复训练可以改善OVCF患者的活动和平衡能力,提高患者的生活质量[33,52,53]。建议采用术前和术后分阶段康复的方案,术前康复指导包括利用垫子保持正确的仰卧及侧卧位姿势;正确的翻身、起床、床椅转移。由于PKP/PVP 可以迅速缓解疼痛,即刻恢复脊柱负重能力,因此术后早期患者即可在医师指导下开始适量的活动和锻炼。术后康复方案主要包括正确的姿势及转移方法、核心稳定性训练(下腹部稳定性训练、下斜方肌改善)、四肢力量训练、平衡训练[54](静/动态平衡、手膝支撑前后摆动)[55,56]。
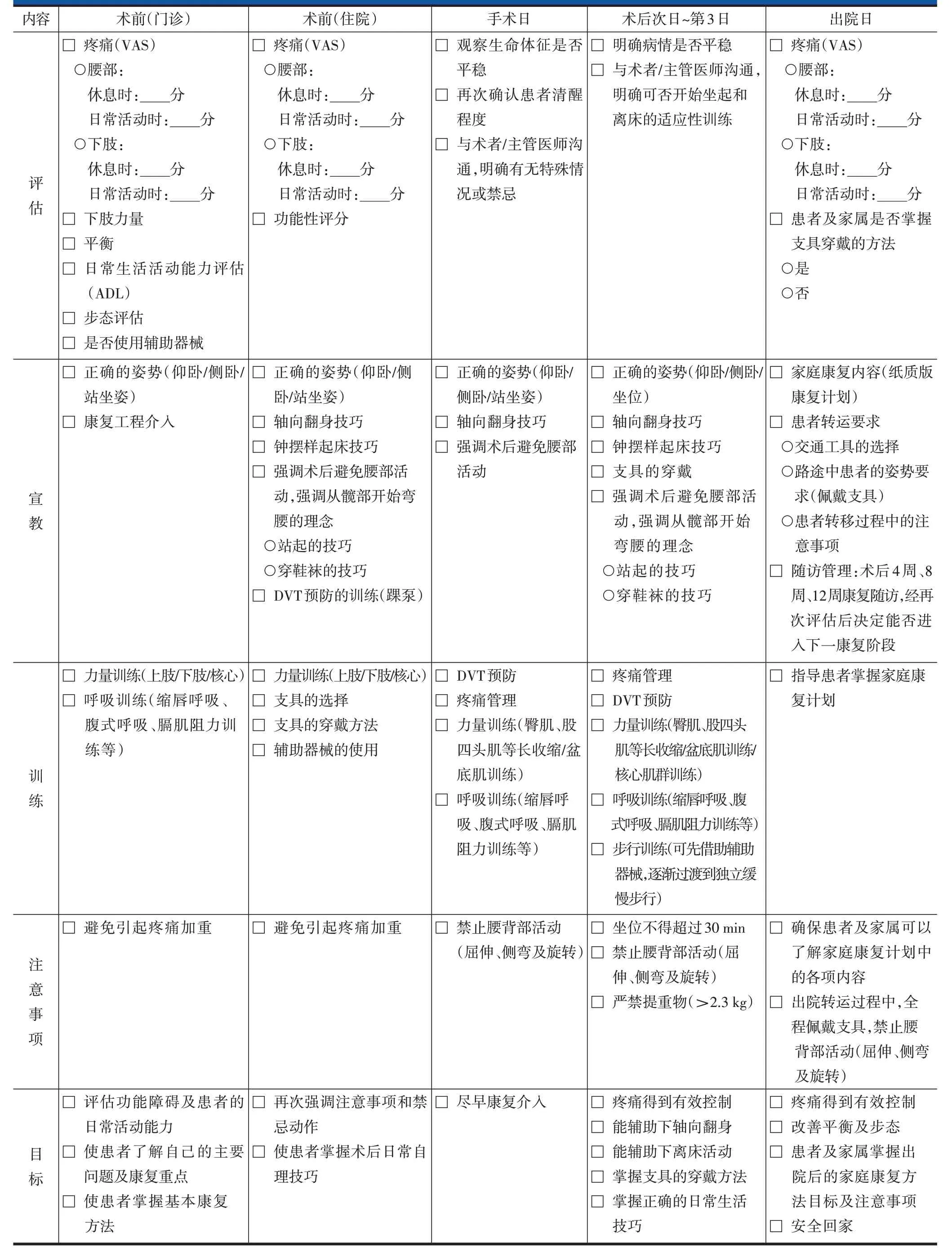
表5 椎体成形术和椎体后凸成形术ERAS实施流程——康复医师表单
12 术后规范的抗骨质疏松治疗和再骨折预防
微创手术只强化已经发生骨折的椎体,全身骨质疏松的状况并未改变,应采取规范的、个体化的、长期的抗骨质疏松治疗方案,从源头上预防再骨折的发生[1,57,58]。①改变不良的生活方式,戒烟、酒,多摄入高钙、低盐食物,避免长期使用激素,避免久坐久站、大幅度弯腰等动作;②积极康复锻炼,加强腰背肌锻炼,适度体育活动,多进行户外活动,多接受阳光照射;③需加强骨质疏松症基础补充剂,如钙剂和维生素D,活性维生素D(骨化三醇)因不需要肝、肾羟化醇羟化就有活性,故更适用于老年人、肾功能减退等患者[59];④根据患者个体情况选择合适的抗骨质疏松药物,如双膦酸盐类药物,甲状旁腺素类药物,酌情选用其他抗骨质疏松药物,如降钙素、维生素K2等。定期复查骨密度和骨代谢指标,根据疗效调整治疗方案[1,60]。平地跌倒是导致骨质疏松性骨折的重要因素,应采取以下措施预防跌倒:①治疗自身疾病;②药物干预,补充活性维生素D,如骨化三醇等[61];③适当锻炼,提高肌力及平衡能力[62];④改善家居环境,如地面防滑处理、增加扶手、减少障碍物等;⑤专业的平衡测试和能力训练。
专家组成员(按姓氏笔画)
丁 琛 马亚群 王思亮 毛海青 刘西芳 刘 浩 刘 楠 闫 航 孙天胜 孙 宇 孙浩林 孙 维
杜 培 李 放 李 莉 李淳德 李 静 杨惠林 邱贵兴 邹叶芳 沈建雄 宋琳琳 张志成 张 蕾
陈 峰 苑 垒 周非非 周谋望 郑林宏 郑博隆 孟 浩 郝定均 洪 瑛 贺宝荣 殷国勇 郭 航
唐 帅 越 雷 韩 彬 嵇富海 蔡思逸
说明:本共识为《脊柱手术加速康复外科实施流程专家共识》系列共识之一,为方便读者阅读,系列共识中的部分段落有重复,不属于学术不端范围,特此说明。

