非布司他治疗慢性肾脏病合并高尿酸血症患者的肾脏保护作用:一项随机对照研究
谭 昭, 李文歌
慢性肾脏病(chronic kidney disease, CKD)是一种源于多种异质性疾病通路引起的不可逆的肾脏功能或结构损伤的肾脏疾病,其发病率及患病率在全球持续升高[1-3]。CKD常伴随高尿酸血症(hyperuricemia, HUA),HUA可以促进尿酸沉积于肾脏,导致肾脏损伤、尿酸结石等,从而诱导或者加重CKD病情[4]。研究显示:血清尿酸(serum uric acid, SUA)水平与CKD发病风险、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)、尿蛋白水平等均显著正相关[5-7]。而降尿酸治疗(uric-acid lowering therapy, ULT)可以延缓患者肾脏的损伤[4, 8]。非布司他是一种黄嘌呤氧化酶抑制剂,具有显著的降尿酸效果,是ULT的重要选择之一[9]。研究显示,非布司他在降尿酸效果上优于传统药物别嘌呤醇,并且其不良反应也略低于别嘌呤醇[10-11]。本研究旨在评估非布司他和别嘌呤醇治疗CKD合并HUA患者对于肾脏保护作用的差别。
1 对象与方法
1.1对象 收集2015年2月—2016年12月于笔者医院肾内科就诊的78例CKD合并HUA患者。纳入标准:(1)年龄>18岁;(2)符合2012年KDIGO定义的CKD诊断标准;(3)血尿酸水平男性≥7 mg/dL,女性≥6 mg/dL;(4) eGFR为30~60 mL·min-1·1.73 m-2。排除标准:(1)急性肾损伤、肾病综合征、梗阻性肾病等不稳定患者;(2)已接受血液透析、腹膜透析或肾移植患者;(3)可能引起肾功能快速下降的合并疾病,例如血管炎、狼疮等;(4)肝功能不全[天冬氨酸转氨酶和(或)丙氨酸转氨酶超过正常水平2倍以上];(5)患者处于痛风活动期;(6)严重感染史、恶性肿瘤患者;(7)有不稳定心绞痛、充血性心力衰竭、心肌梗死或行冠状动脉搭桥手术或创伤性冠状动脉再通术或脑卒中病史的患者;(8)合并使用影响尿酸代谢药物(如利尿剂等)、免疫抑制剂(如巯嘌呤、环磷酰胺等);(9)过去6月内使用过非布司他、苯溴马隆、别嘌呤醇三者之一的患者;(10) HLAB5801阳性患者;(11)其他研究者认为不适合本研究的患者。本研究获得笔者医院伦理委员会同意和批准,所有患者均签署了纸质版知情同意书。
1.2方法 本研究为单中心、随机、平行对照临床试验,所有患者按照区组随机方式,将患者1∶1平衡分配至非布司他治疗组和别嘌呤醇治疗组。随机化由统计学专家采用SAS软件执行[分为13个区组(1个区组备用),区组长度为6,分组因素2组],按照区组制备随机信封及文件(13个,1个备用),之后随机文件送到上海巧捷生物科技有限公司进行保管,当患者经过筛选满足入组条件后,由研究者电话上海巧捷生物科技有限公司索取随机号,公司以区组为单位,依次读取随机号并告知研究者(一个区组6例读取完毕后进行下一个区组分配),研究者依据此号与其对应分组执行研究。非布司他治疗组:首月起始20 mg/d,口服;后加量至40 mg/d,持续治疗6月。别嘌呤醇治疗组:首月起始100 mg/d,口服;后加量至200 mg/d,持续治疗6月。研究过程中,如果患者尿酸低于5 mg/dL,将药物剂量减半;如果患者尿酸低于3 mg/dL(即180 μmol/L),则停用药物,以最后1次各项评估指标作为终点进行分析。此外,如果研究过程中eGFR下降到15~30 mL·min-1·1.73 m-2,将药物剂量减半;如果eGFR下降到15 mL·min-1·1.73 m-2以下,则停用药物,并归为治疗失败,以最后一次各项评估指标作为终点进行分析。
主要评估终点为治疗6月后eGFR相对基线期改变值和eGFR下降超过10%的患者比例。eGFR计算采用慢性肾脏病流行病合作工作组方程式,即:
eGFR (mL·min-1·1.73 m-2)男=141×[Scr(血清肌酐)/0.9]α×0.993年龄
eGFR (mL·min-1·1.73 m-2)女=144×(Scr/0.7)α×0.993年龄
男性且Scr≤0.9 mg/dL,则α=-0.411;男性且Scr>0.9 mg/dL,则α=-1.209。女性且Scr≤0.7 mg/dL,则α=-0.329;女性且Scr>0.7 mg/dL,则α=-1.209。次要评估终点为SUA,Scr及24 h尿蛋白定量治疗6月后相对于基线期的改变值及6月内心血管事件发生率。
1.3随访 共随访6月,于第0月(筛选/基线期,M0),M1,M2,M3,M6进行随访和疾病评估。
1.4最小样本量 本研究采用非劣效性试验方法设计。选取主要终点(eGFR下降10%的患者比例)进行计算。估计治疗6月后非布司他治疗组eGFR下降10%的患者比例为22%,别嘌呤醇组为50%,取双侧检验水准α=0.05,二类误差概率不超过β=0.2,允许误差=5%,试验组∶对照组取1∶1比例配样,考虑脱落率为15%。计算得出非布司他组需要最小样本量为39例,别嘌呤醇组为39例,合计78例。因此本研究共纳入78例患者。

2 结 果
2.1研究流程 本研究共邀请231例参与研究,132例接受邀请进行入组筛选,其中54例排除未纳入研究(21例符合排除标准,33例拒绝签署知情同意书),最后78例CKD合并HUA患者纳入研究并进行随机分组,按照比例1∶1分配为39例非布司他治疗组和39例别嘌呤醇治疗组(图1)。非布司他组中,共有3例未能完成研究提前退出,情况分别为:1例意愿退出和2例失访;别嘌呤醇组中,共有5例未能完成研究提前退出,情况分别为:1例不良反应(皮疹经过甲基强的松龙治疗后依然加重)、2例意愿退出、1例失访和1例出现难以控制的高尿酸。因此,最终非布司他组有36例(92%)而别嘌呤醇组有34例(87%)完成整个研究。
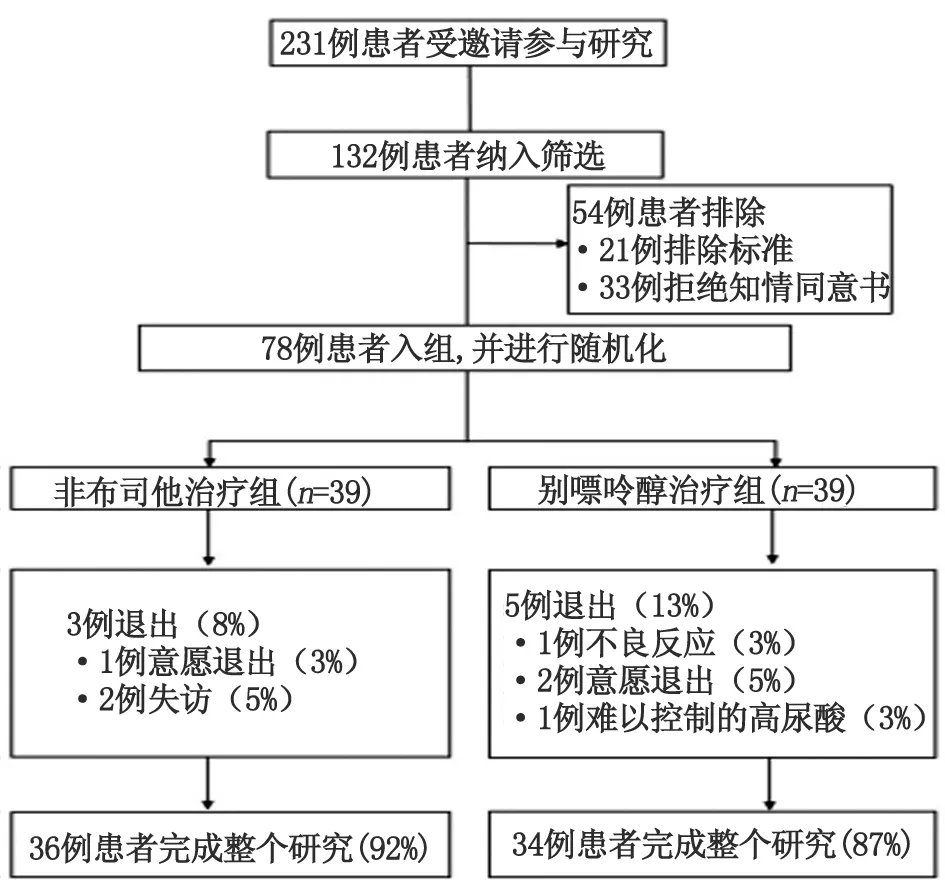
图1 研究流程图Fig 1 Study flow
2.2基线信息 非布司他组与别嘌呤醇组患者基线期年龄[(54.2±9.7)岁vs(55.8±10.1)岁,t=-0.714,P=0.478]、性别(32/7vs30/9,χ2=0.315,P=0.575)、eGFR[(46.5±9.3) mL·min-1·1.73 m-2vs(47.7±10.2) mL·min-1·1.73 m-2,t=-0.543,P=0.589]差别均无统计学意义。其他基线期人口学、临床特征、合并治疗的差别也均无统计学意义(表1),2组具有可比性。

表1 患者基线信息
1 mmHg=133.3 Pa. BMI:体质量指数;eGFR:估算肾小球滤过率;CKD:慢性肾脏病;Scr:血清肌酐;SUA:血清尿酸;SBP:收缩压;DBP:舒张压;FBG:空腹血糖;ALB:血白蛋白;HB:血红蛋白;TC:总胆固醇;TG:甘油三酯;LDL:低密度脂蛋白;HDL:高密度脂蛋白;ARB:血管紧张素受体阻滞剂;ACEI:血管紧张素转化酶抑制剂.
2.3主要评估终点 重复测量方差分析发现(图2A),各时间点eGFR值无差别(F=1.570,P=0.188), 2 组间eGFR值也无差别(F=0.661,P=0.418),但2 组各时间点eGFR交互作用有显著差别(非布司他组eGFR上升优于别嘌呤醇组,F=2.750,P=0.042)。t检验也表明,治疗6月后,非布司他组相对于别嘌呤醇组显著改善了患者的eGFR[(3.2±3.9) mL·min-1·1.73 m-2vs(0.8±4.3) mL·min-1·1.73 m-2,t=2.582,P=0.012](图2B)。此外,6月后非布司他组eGFR下降超过10%患者比例也显著低于别嘌呤醇组(28.3%vs51.3%,χ2=4.336,P=0.037)。
2.4主要评估终点的亚组分析 进一步将患者按照基线期eGFR水平划分亚组为eGFR低组(Ⅲb期)30~45 mL·min-1·1.73 m-2和高组(Ⅲa期)45~60 mL·min-1·1.73 m-2,发现针对于基线期eGFR在30~45 mL·min-1·1.73 m-2(Ⅲb期)患者,非布司他治疗6月后相比别嘌呤醇可以显著改善eGFR值(t=2.339,P=0.023,图3A),且eGFR下降超过10%的患者比例也显著低于别嘌呤醇组(χ2=4.251,P=0.039,图3B)。而针对于基线期eGFR在45~60 mL·min-1·1.73 m-2(Ⅲa期)患者,非布司他治疗6月后相比别嘌呤醇,eGFR值无差别(t=1.138,P=0.266,图3C),2组eGFR下降超过10%的患者比例也无差别(χ2=0.491,P=0.484,图3D)。
2.5次要评估终点 非布司他和别嘌呤醇均快速降低患者SUA值,1月后SUA值即显著低于基线期,且SUA值M0~M6持续下降且维持较低水平(表2)。重复测量方差分析结果显示(表2),不同时间点SUA有显著差别(F=32.886,P<0.001),非布司他组SUA值低于别嘌呤醇组(F=9.638,P=0.016),2组各时间点SUA交互作用也有显著差别(F=9.126,P=0.037)。而治疗6月后,相对于别嘌呤醇,非布司他组SUA降低水平[(-3.1±1.2) mg/dL]显著优于别嘌呤醇组[(-2.5±1.0) mg/dL] (t=-2.399,P=0.019)。此外,重复测量方差分析结果还显示:不同时间点Scr无显著差别(F=0.869,P=0.445),2 组间比较Scr值无显著差别(F=1.374,P=0.265),2 组各时间点Scr交互作用也无显著差别(F=1.925,P=0.106)。而治疗6月后,相对于别嘌呤醇,非布司他可以延缓Scr的上升[(-0.13±0.18) mg/dLvs(-0.03±0.21) mg/dL,t=-2.259,P=0.027](表2)。24 h尿蛋白定量水平经重复测量方差分析结果显示(表2):不同时间点24 h尿蛋白定量水平有显著差别(F=59.84,P<0.001),2组间24 h尿白蛋定量水平值比较无显著差别(F=1.026,P=0.338),2组各时间点24 h尿蛋白定量水平交互作用也无显著差别(F=1.430,P=0.241)。治疗6月后,2 组间24 h尿蛋白定量水平相对于基线期改变值也无差别[(-0.92±0.69)gvs(-0.77±0.78)g,t=-0.911,P=0.365],表明非布司他在改善24 h尿白蛋定量上并不优于别嘌呤醇。

eGFR:估算肾小球滤过率. A:非布司他组和别嘌呤醇组患者在不同时间点eGFR的比较;B:非布司他组和别嘌呤醇组患者的eGFR变化(M6~M0)情况比较.图2 非布司他组和别嘌呤醇组eGFR各随访点值和M6~M0改变值Fig 2 eGFR point of follow-up values and M6~M0 changes in febuxostat and allopurinol groups

eGFR:估算肾小球滤过率. A,C:CKD 3a期(A)和CKD 3b期(C)的非布司他组和别嘌呤醇组患者eGFR变化(M6~M0)情况比较;B,D:CKD 3a期(B)和CKD 3b期(D)的非布司他组和别嘌呤醇组患者eGFR下降超过10%的患者比例.图3 按照基线期eGFR值亚组分析非布司他组和别嘌呤醇组eGFR的改变Fig 3 Analysis of eGFR changes in febuxostat and allopurinol groups according to subgroup eGFR at baseline

表2 非布司他组和别嘌呤醇组SUA,Scr和24 h蛋白尿各随访点值和M6~M0改变值
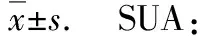
2.6安全性 非布司他组出现了1例(3%)轻微腹泻,2例(5%)皮疹,5例(13%)肝功能异常;别嘌呤醇组出现了7例(18%)皮疹,7例(18%)肝功能异常。2 组间总体不良反应率无明显差别(χ2=2.279,P=0.131);非布司他组皮疹发生率低于别嘌呤醇组,但差别无统计学意义(χ2=3.140,P=0.076)。2组在随访期均未发生心血管事件。
3 讨 论
本研究发现,与别嘌呤醇比较,非布司他治疗CKD Ⅲ期合并HUA患者可以延缓eGFR的下降,ULT治疗效果也更佳,并且一定程度上延缓患者Scr上升。此外,非布司他与别嘌呤醇之间不良反应无显著差别,且皮疹发生率略低于别嘌呤醇。
非布司他为一种新型降尿酸药物,为黄嘌呤氧化酶抑制剂,特异性抑制氧化型和还原型黄嘌呤氧化酶,从而发挥较别嘌呤醇更好的降尿酸效果[12]。近期一项双盲随机对照临床试验纳入了108例CKD Ⅲ~Ⅳ期合并HUA患者,发现与安慰剂比较,非布司他治疗可以显著延缓eGFR的下降[13]。另外一项随机对照临床试验,纳入了45例CKD合并HUA患者并随机分为非布司他组和不含非布司他的传统治疗组,结果表明相对比传统治疗组,非布司他显著降低了24 h尿蛋白定量,尿肝型脂肪酸结合蛋白、尿白蛋白和尿β2微球蛋白[14]。本研究通过纳入78例CKDⅢ期合并HUA患者并随机分为非布司他组和别嘌呤醇组治疗并随访6月,发现了非布司他可以延缓患者eGFR的下降,控制Scr上升,表明非布司他相对于别嘌呤醇有着更好的肾脏保护作用。这可能有多个原因造成了此结果:(1)非布司他更好的降尿酸效果,从而降低肾脏的损伤[10]。(2)非布司他同时在肝脏代谢和肾脏清除,不完全依赖于肾脏排泄,因此对于肾脏影响较别嘌呤醇轻[15]。(3)非布司他特异性结合黄嘌呤氧化酶,而别嘌呤醇同时影响嘌呤核苷磷酸化酶、次黄嘌呤合成、黄嘌呤氧化酶、乳清酸核苷酸脱羧酶,这可能会增加肾脏影响[16]。本研究结果与之前一项在心脏手术合并HUA患者中随机对照研究结果类似,该研究纳入141例进行心脏手术合并HUA的成年患者,随机分为非布司他和别嘌呤醇治疗,结果显示,非布司他相对比别嘌呤醇显著降低了Scr、尿微量白蛋白及胱抑素-C水平[17]。关于别嘌呤醇转化非布司他治疗CKD合并HUA患者的一项研究,73例患者治疗12月并按照实际情况分为非布司他转化组51例和持续别嘌呤醇治疗组22例,结果显示,转化为非布司他治疗可以显著延缓eGFR的下降。但该研究并未考虑患者本身的疾病状态、转换原因等对于结果的影响(混杂因素),并且样本量也较低而且不对称[18]。
本研究还发现,非布司他较别嘌呤醇能更好地降低患者的SUA,这和非布司他特异性抑制氧化型和还原型黄嘌呤氧化酶从而发挥更强的降尿酸效果相关。2016年欧洲抗风湿联盟(EULAR)关于痛风的治疗指南也指出,非布司他降尿酸效果优于别嘌呤醇[19]。此外,在此研究随访期中,非布司他组和别嘌呤醇组均未发生心血管事件,这主要是由于随访时间较短(6月)。在安全性方面,2 组无显著性差别,仅在皮疹方面别嘌呤醇组发生率略高于非布司他组,这与别嘌呤醇多个作用位点从而可能发生较高不良反应有关[20],此结果与近期一项纳入109例痛风患者比较非布司他和别嘌呤醇治疗HLA-B*5801阴性痛风患者类似,非布司他较少发生皮疹[11]。
本研究的不足之处:(1) 试验随访期较短,仅有6月干预和随访时间,因此非布司他和别嘌呤醇对于心血管事件的影响差别等并未得出有效结果。(2) 样本量较少。考虑到成本等因素,本研究纳入患者数采用了最小样本量78例,因此缺乏更大样本的验证。(3)出于对于别嘌呤醇的安全性考虑,本研究仅纳入了CKD Ⅲ期的患者,CKD Ⅳ期患者并未涉及。(4)此研究并未采用双盲设计,因此可能存在医生评估、患者感受等偏倚的影响。此外,本研究采用别嘌呤醇100 mg/d起始剂量进行对照组患者的治疗,主要原因:(1)既往研究别嘌呤醇治疗CKD合并HUA患者的研究,大部分是大剂量直接维持治疗,如一项研究中CKD Ⅱ~Ⅳ期患者直接使用别嘌呤醇大剂量300 mg/d进行治疗[21];而另外一项研究中CKD Ⅲ~Ⅳ期患者直接使用别嘌呤醇中剂量150 mg/d进行治疗[22]。而在笔者的临床经验中,患者的口服剂量以50~100 mg起始,后逐步加量。因此综合既往文献及临床用药经验,本研究折中选择别嘌呤醇100 mg/d作为起始量;(2)笔者医院非布司他为40 mg/片,按照临床经验,如果别嘌呤醇采用小剂量起始治疗(50 mg/d),那么非布司他最好也采用10 mg/d起始治疗,然而考虑非布司他难以再次切割为1/4片,因此本研究将用药初始剂量设置为非布司他20 mg/d,别嘌呤醇100 mg/d。
综上所述,本研究发现非布司他治疗CKD Ⅲ b期合并HUA患者较别嘌呤醇可以延缓eGFR的下降、控制Scr升高,对患者肾脏功能有着更好的保护作用。

