circ-ITCH表达水平与上皮性卵巢癌患者临床病理特征及预后的关联及对卵巢癌细胞增殖和凋亡作用的影响
梁杨焕
上皮性卵巢癌(epithelial ovarian cancer, EOC)是最常见的妇科恶性肿瘤之一,其发病率和死亡率分别位居世界女性全身恶性肿瘤的第7位和第4位[1]。根据2015年全球肿瘤流行病学调查报告,2012年全球约有239 000例新发EOC和151 900例死于EOC的患者[2]。2016年中国肿瘤流行病学调查报告显示,2015年新发EOC和死于EOC的病例分别为52 100和22 500例[3]。尽管近年早期诊断、个体化治疗及患者护理技术等均有所提高和发展,但EOC患者的病死率仍呈上升趋势,晚期患者的5年生存率不及30%[1],可能与极高的恶性程度、易复发性以及易转移性有关[4]。因此,积极探索EOC的发病机制,提高EOC的早期诊断率、发现可靠的治疗靶基因是有必要的。
环状RNA分子(circular RNA, circRNA)区别于传统的线性RNA(linear RNA,含5′和3′末端),是一类不具有5′末端帽子和3′末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子,其封闭的环状结构不受RNA外切酶的影响,表达更稳定且不易降解[5]。据报道,circRNA与宫颈癌、胃癌以及结肠癌等肿瘤具有密切的联系,并可通过直接或者间接调节许多基因或信号通路来影响肿瘤的发生发展[6-8]。circ-ITCH作为一个新颖的circRNA位点,已被证实在肝细胞癌、肺癌及食管鳞状细胞癌的发生和进展中起重要作用[9-11]。本研究旨在评估组织circ-ITCH的表达水平与EOC患者的临床病理特征及总体生存期(overall survival, OS)的关联,并探讨circ-ITCH对EOC细胞增殖及凋亡的影响。
1 对象与方法
1.1对象 收集2013年10月-2016年7月接受手术切除的EOC患者122例,年龄(53.24±10.15)岁(24~76岁)。患者的基本情况见表1。所有患者均经临床和病理学检查确诊,年龄≥18岁,且在医院样本库中存有可用于定量聚合酶链反应(quantitative polymerase chain reaction, qPCR)检测的癌组织和配对癌旁组织。排除标准:(1)继发性卵巢癌患者;(2)有其他肿瘤病史,或之前接受过卵巢癌手术的患者;(3)临床和病理资料不完整或缺失的患者。本研究获医院伦理委员会批准,患者或监护人均知情同意。
1.2方法
1.2.1信息采集和样本采集 通过医院的电子病历系统或病案室记录,收集患者的临床病理资料,包括年龄、组织学亚型、病理分级、腹膜细胞学检查结果、肿瘤大小、腹水量、国际妇产科联盟分期(International Federation of Gynecology and Obstetrics, FIGO)、糖类抗原125(carbohydrate antigen 125, CA125)的水平和生存资料。所有患者均依据其疾病状况和意愿进行随访,中位随访时间为30月(1~57月),随访截止日期为2017年10月1日。OS定义为患者手术后至任何原因导致死亡的时间。从医院样本库中获得所有入组患者手术切除并保存于液氮中的癌组织和配对癌旁组织样本。

表1 患者的基本信息
EOC:上皮性卵巢癌;FIGO分期:国际妇产科联盟分期;CA125:糖类抗原125.
1.2.2细胞培养 人类EOC细胞(SKOV3细胞)购自中国科学院上海细胞库,加入含10%胎牛血清、2 μmol/L左旋谷丙酰胺、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基(11885084,美国Gibco公司),置于37 ℃、体积分数为0.05的CO2培养箱中培养。选取对数期生长的细胞进行实验。
1.2.3细胞转染 质粒设计委托上海巧捷生物科技有限公司进行,质粒构建合成委托苏州金唯智生物科技有限公司进行。将NC1(+)、NC2(-)、circ-ITCH (+)及circ-ITCH (-)质粒分别转染进SKOV3细胞。根据转染的质粒,分为NC1(+)、NC2(-)、circ-ITCH (+)及circ-ITCH (-)组。
1.2.4qPCR 采用Trizol Reagent (15596018, 美国Invitrogen公司)抽提总RNA。利用分光光度计检测RNA的浓度及纯度。将RNA分为RNase消化组和非消化组2组,准备10×Reaction Buffer配制10 μL总反应体系,用于消化线性RNA,每1 μg RNA用1 U的RNase消化,37 ℃ 10 min。采用苯酚和乙醇沉淀法提取消化产物。采用SuperScriptTMⅢ First-Strand Synthesis Super Mix (11752050, 美国Invitrogen公司)合成cDNA。采用TB GreenTMFast qPCR Mix (RR430A, 日本Takara公司)完成qPCR的反应体系,反应条件为:95 ℃预变性2 min,然后按95 ℃ 1 min→60 ℃ 1 min→72 ℃ 1 min,扩增40个循环。以GAPDH作为内参。运用2-ΔΔCt来计算qPCR的结果。引物序列如下:
circ-ITCH:
正向:5′-GCAGAGGCCAACACTGGAA-3′
反向:5′-TCCTTGAAGCTGACTACGCTGAG-3′
GAPHD:
正向:5′-GAGTCCACTGGCGTCTTCAC-3′
反向:5′-ATCTTGAGGCTGTTGTCATACTTCT-3′
1.2.5CCK-8检测 取各组细胞,胰酶消化后分别加入96孔板中,加入CCK-8后,37 ℃孵育2 h,酶标仪测定0,24,48 h的吸光度(optical density, OD)值,绘制增殖曲线。
1.2.6AV/PI检测 胰酶消化和PBS冲洗后,细胞制成细胞悬液,加入100 mL Binding buffer清洗和重悬细胞,加入5 mL AV-FITC,在室温下黑暗处孵育15 min。加入5 mL PI,室温下黑暗处孵育15 min。使用流式细胞仪检测细胞凋亡。实验均重复3遍。
1.3统计学处理 采用SPSS 22.0软件和GraphPad Prism 6.0软件进行统计学处理。数据以频次(%)表示。采用Wilcoxon符号秩和检验癌组织和癌旁组织中circ-ITCH的表达差异;Wilcoxon秩和检验分析circ-ITCH表达在不同临床病理特征亚组中的差异;Kaplan-Meier(K-M)曲线和Log-rank检验分析circ-ITCH表达水平和患者OS的关联。采用单元和多元Cox风险比回归模型对影响OS的因素进行分析,单元Cox回归模型中P<0.1的因素进一步纳入多元Cox回归模型。采用t检验评估两组间SKOV3细胞增殖和凋亡的差异。P<0.05为差别具有统计学意义。
2 结 果
2.1circ-ITCH在癌组织和癌旁组织中的表达差异 与癌旁组织[1.570(1.077~2.598)]比较,circ-ITCH在癌组织中[0.576(0.262~1.063)]的表达水平显著降低(P<0.01,图1)。
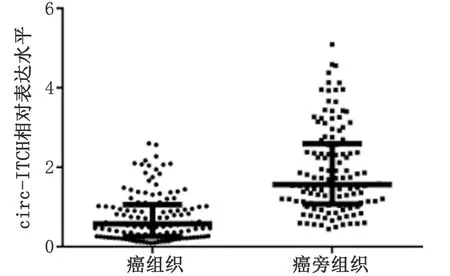
P<0.001.图1 circ-ITCH在癌组织和癌旁组织中的表达差异Fig 1 The differential expression of circ-ITCH in tumor tissue and adjacent tissue
2.2circ-ITCH和临床病理特征的关联 癌组织中circ-ITCH的表达水平,病理分级G1/2的患者[0.872(0.466~1.347)]高于G3患者[0.469(0.240~0.953)](P=0.008),肿瘤≤10 cm的患者[0.849(0.312~1.217)]高于>10 cm患者[0.484(0.233~0.817)](P=0.023),FIGO分期Ⅰ/Ⅱ的患者[1.119(0.767~1.850)]高于Ⅲ/Ⅳ的患者[0.366(0.217~0.686)](P<0.001,图2)。此外,组织circ-ITCH表达水平与其他临床病理特征无明显关联。
2.3circ-ITCH表达水平对OS的影响 根据癌组织中circ-ITCH的表达水平将患者分为高表达组与低表达组,并进一步采用K-M曲线和Log-rank检验分析组织circ-ITCH的表达水平与EOC患者OS的关联。高表达组患者的中位生存时间为41月(14~57月),低表达组患者为20月(1~57月);高表达组比起低表达组患者有更好的OS(P=0.002,图2)。

A:年龄≥50岁与<50岁患者比较; B:组织亚型为浆液性与其他患者比较; C:病理分级G1/2与G3患者比较;D:细胞学检查阳性与阴性患者比较;E:肿瘤大小≥10 cm与<10 cm的患者比较;F:腹水量≥100 mL与<100 mL的患者比较;G:FIGO分期为Ⅲ/Ⅳ与Ⅰ/Ⅱ的患者;H:CA125≥1 000 U/mL与<1 000 U/mL的患者比较; circ-ITCH表达水平对OS的影响.图2 circ-ITCH和临床病理特征的关联以及对OS的影响Fig 2 The correlation of circ-ITCH and clinicopathologic features and the relationship of circ-ITCH expression with OS
2.4影响OS的因素 癌组织circ-ITCH的高表达水平(P=0.003)与患者更好的OS相关,而病理学分级(G3vsG1/2) (P=0.012)、细胞学检查阳性(P=0.019)、腹水量≥100 mL(P=0.023)、FIGO分期(Ⅲ/ⅣvsⅠ/Ⅱ) (P=0.001)与患者更差的OS相关。进一步采用多元Cox′s回归模型分析EOC患者OS的预测因素(单元模型中P<0.1的因素),结果显示,癌组织circ-ITCH高表达水平(P=0.012)能独立预测EOC患者较好的OS,而细胞学检查阳性(P=0.019)及腹水量≥100 mL (P=0.005)能独立预测EOC患者较差的OS(表2)。

表2 影响总体生存期的因素
FIGO分期:国际妇产科联盟分期;CA125:糖类抗原125.
2.5circ-ITCH (+)/(-)质粒转染 为进一步探讨circ-ITCH在EOC的功能,进一步行细胞实验。转染circ-ITCH (+)/(-)后,采用qPCR实验分析RNA的表达。光镜下显示,NC1(+)、circ-ITCH(+)、NC2(-)及circ-ITCH(-)组中转染率均超过90%(图3A)。此外,转染circ-ITCH(+)后,circ-ITCH的表达水平比NC1(+)组显著增加(P<0.000 1),而转染circ-ITCH(-)后,circ-ITCH的表达水平比NC2(-)组显著减少(P<0.000 1,图3B),表明转染成功。

a:NC1(+); b:circ-ITCH(+); c:NC2(-); d:circ-ITCH(-). A:细胞转染图;B:circ-ITCH相对表达量,☆☆☆:P<0.000 1.图3 细胞转染Fig 3 Cell transfection
2.6circ-ITCH对EOC细胞增殖的影响 转染circ-ITCH(+)/(-)后,采用CCK-8检测各组细胞增殖情况,结果显示,48 h后,circ-ITCH(+)组的细胞增殖比NC1(+)组显著减少(P<0.05),而circ-ITCH (-)组的细胞增殖比NC2(-)组显著增加(P<0.05,图4),表明circ-ITCH有抑制EOC肿瘤细胞增殖的作用。
2.7circ-ITCH对EOC细胞凋亡的影响 转染circ-ITCH (+)/(-)后,采用AV/PI实验检测各组细胞凋亡情况,结果显示,circ-ITCH(+)组的细胞

与NC2(-)组比较,☆:P<0.05; 与NC1(+)组比较,#:P<0.05.图4 细胞增殖检测Fig 4 Cell proliferation assay
凋亡率较NC1(+)组明显增加(P<0.05),而circ-ITCH(-)组较NC2(-)组明显减少(P<0.05,图5),表明circ-ITCH有促进EOC肿瘤细胞凋亡的作用。
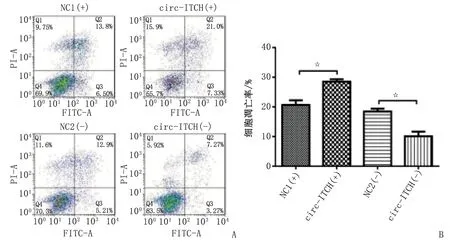
A:细胞凋亡流式图;B:细胞凋亡率,☆:P<0.05.图5 细胞凋亡Fig 5 Cell apoptosis
3 讨 论
circRNA作为一种非编码RNA,具有高度保守性、稳定性及特异性,其主要生物功能如下:(1)可顺式调控亲本基因的表达;(2)可结合吸附miRNA,从而降低miRNA的活性,间接调控相关靶基因的表达;(3)有较强的组织表达特异性,未来可作为疾病(尤其是肿瘤)诊断和治疗的潜在靶点[12-14]。研究表明,circRNA与肿瘤关系密切。例如CDR1as,ciRS-7-A,circ7374,circ3204或circ0817等与宫颈癌、乳腺癌、胃癌或结肠癌等的发生和发展密切相关[6,13,15-17]。一项有关肝细胞癌的研究表明,circRNA has_circ_0001649在癌组织中相较于癌旁组织的表达水平显著下调,其表达水平与肿瘤的大小和门静脉癌栓呈负相关[18]。此外,另一项有关胃癌的研究表明,circRNA has_circ_002059在癌组织中表达明显减少,其表达水平与患者的TNM分期和远处转移等临床病理特征均呈负相关[19]。上述研究均说明circRNA在恶性肿瘤的发生和发展过程中扮演着重要的角色。
circ-ITCH作为一种新颖的circRNA,位于染色体20q11.22[10]。一项有关食管鳞状细胞癌的研究表明,与癌旁组织比较,circ-ITCH在癌组织中的表达水平显著降低[11]。同样,另一项有关肝细胞癌的研究表明,circ-ITCH在癌组织中的表达水平亦明显减少[9]。肿瘤的发生和发展涉及诸多基因和信号通路的复杂调控。为了进一步了解circ-ITCH在EOC的具体机制,笔者研究了circ-ITCH对EOC细胞增殖及凋亡的影响,结果显示,circ-ITCH可减少EOC细胞增殖,而增加EOC细胞凋亡。近年来,少量研究报道了关于circ-ITCH在恶性肿瘤的细胞机制,如circ-ITCH可通过海绵吸附作用抑制Wnt/β-catenin信号通路,从而减少ESCC细胞增殖[11];circ-ITCH同样可通过吸附致癌性miR-7和miR-214抑制Wnt/β-catenin信号通路的活动性,从而降低肺癌细胞的增殖[10];circ-ITCH可通过调节miR-224和miR-17上调P21和磷酸酶基因,从而抑制细胞增殖、转移和侵袭,继而减少膀胱癌恶化[20]。可见,circ-ITCH可通过发挥生物调控功能,如海绵吸附作用等,影响细胞活动,从而影响肿瘤的发生和发展。这可能是circ-ITCH减少EOC细胞增殖、而增加EOC细胞凋亡的部分原因。
综上所述,癌组织circ-ITCH与EOC的病理分级、肿瘤大小及FIGO分期均呈负相关,而与OS呈正相关。此外,circ-ITCH可减少EOC细胞增殖,且增加细胞凋亡。

