雷公藤内酯醇对小鼠H22腹水瘤细胞凋亡及PD-L1表达的影响
邹玉莲, 黄秀旺, 甘陈灵
近年来,癌症已被列为影响中国居民健康的第一病因。传统的临床一线抗癌药物如5-氟尿嘧啶、紫杉醇、长春新碱等,已表现出越来越高的药物耐受率[1-3],且大剂量使用化疗药物往往加重机体免疫功能的破坏,肿瘤细胞更易发生免疫逃逸。负性调控因子程序性死亡受体-配体1(programmed cell death-Ligand 1, PD-L1)是最重要的免疫抑制分子,其过表达是介导肿瘤免疫逃逸的关键机制[4]。5-氟尿嘧啶等化疗药物可以诱导人肿瘤细胞PD-L1的表达,诱导T细胞凋亡进而介导肿瘤免疫逃逸,这无疑为经典的化学药物治疗又蒙上一层阴影[5-6]。雷公藤内酯醇(triptolide,TPL)又名雷公藤甲素,是从雷公藤中分离出的环氧二萜内酯化合物,是雷公藤的主要有效成分之一,具有抗炎、抑制生育、调节免疫反应等药理作用。自Kuchan等首次发现TPL的抗肿瘤活性以来[7],人们对TPL治疗肿瘤的功效做了大量的研究。体内外实验显示其具有较强及广谱的抗肿瘤作用,对鳞状细胞癌、结肠癌、胆囊癌、胰腺癌、卵巢癌、乳腺癌、肾癌、肺癌等多种癌细胞都有较好的疗效[8-9]。研究提示,TPL可以诱导肿瘤细胞凋亡,且小剂量TPL即可抑制多种肿瘤细胞的生长[10-11]。体外实验表明,TPL可以下调γ-干扰素诱导的PD-L1表达[12-13]。本研究以H22小鼠腹水瘤为研究对象,探讨TPL抗肝癌的作用机制,为TPL在临床上用于防治肝肿瘤提供实验依据。
1 材料与方法
1.1材料
1.1.1药物、主要试剂与仪器 雷公藤内酯醇购自南京泽朗生物科技有限公司,纯度为99%,分子量为360.4;于实验前以丙二醇(1 mg/mL)新鲜配制。RPMI 1640培养基(美国Corning公司);1640培养基(美国GEMINI公司);Annexin V-FITC/PI凋亡试剂盒(瑞士 Roche公司);PD-L1(美国eBioscience公司)。CO2生物培养箱(Forma371)、酶标仪(Varioskan Flash)及高速冷冻离心机(Heraeus Multifuge X1R)(美国Thermo公司);流式细胞仪(FACS Verse,美国BD公司)。
1.1.2动物与细胞 C57BL/6小鼠,雌性,体质量18~22 g[上海斯莱克实验动物有限公司,合格证号:SCXK(沪)2012-0002],饲养在清洁级环境中。饲养1周后进行实验,每日12 h 光照维持,昼夜循环。小鼠肝癌H22细胞株购买于中科院上海细胞所。
1.2方法
1.2.1小鼠H22 腹水瘤模型的建立 取对数生长期的H22细胞,用RPMI 1640培养液制成每毫升含1.5×107细胞的悬液,取0.2 mL腹腔注射于2只C57BL/6小鼠。接种后第10天,抽取小鼠的腹水,用PBS制成每毫升含1.5×107细胞的悬液,取0.2 mL分别腹腔注射于80只小鼠,作为实验第1天。
1.2.2分组及给药方法 将80只H22腹水瘤小鼠随机分为对照组及TPL低、中、高剂量组,每组20只(15只用于生存期观察,另外5只用于检测其他指标):实验第3天起,TPL低、中、高剂量组分别隔日尾静脉注射TPL 0.05,0.1,0.2 mg/kg,对照组隔日尾静脉注射等量2%丙二醇溶液。
1.2.3小鼠体质量及生存期 隔日记录各组小鼠的体质量变化情况和生存时间,并绘制体质量曲线和生存期曲线。
1.2.4小鼠腹水体积和腹水中肿瘤细胞数 第14天,各组随机处死5只小鼠,抽取腹水,计量体积,用PBS将腹水稀释10倍,检测细胞密度,计算腹水中的肿瘤细胞数。
1.2.5检测细胞凋亡 取1.2.4中的腹水,离心收集细胞,PBS洗涤2次,按照罗氏公司AnnexinV-FITC/PI双染试剂盒说明书处理,流式细胞术检测。细胞凋亡率计算方法:
细胞凋亡率(%)=(早期凋亡细胞+晚期凋亡细胞)/全部细胞数×100%
Annexin V阳性/PI阴性表示早期凋亡,Annexin V阳性/PI阳性表示晚期凋亡。
1.2.6流式细胞仪检测细胞PD-L1的表达 腹水标本处理同上,收集细胞至流式管中,2 000 r/min离心3 min,弃上清,向各流式管中加入2 mL流式液(含1%血清的PBS溶液)重悬细胞,2 000 r/min离心3 min,弃上清,轻轻将管底细胞悬起,各管加入抗体,4 ℃孵育20 min后,加入2 mL流式液,2 000 r/min离心3 min,弃上清,各管加入300 μL流式液,上机检测。

2 结 果
2.1小鼠体质量和生存期变化情况 接种H22腹水瘤后前6天,对照组小鼠的腹水和体质量增加迅速,小鼠进食状况及精神状态较好;第7天后小鼠进食减少,精神欠佳,活动减少;第11天后小鼠腹部膨胀;第13天对照组小鼠逐步开始死亡,到第19天小鼠全部死亡。与对照组比较,TPL各组小鼠的进食及精神状态良好,腹水和体质量增长缓慢,尤以中、高剂量组最明显。给药组小鼠第16天开始死亡,直至第22天全部死亡(图1)。
对照组和TPL低、中、高剂量组小鼠的中位生存期分别为14,17,20和20 d。与对照组比较,TPL各剂量组的生存期均有明显延长(P<0.05,P<0.01,表1)。其中,中、高剂量组较低剂量组延长(P<0.05),但是中、高剂量组间比较,差别无统计学意义(P>0.05)。
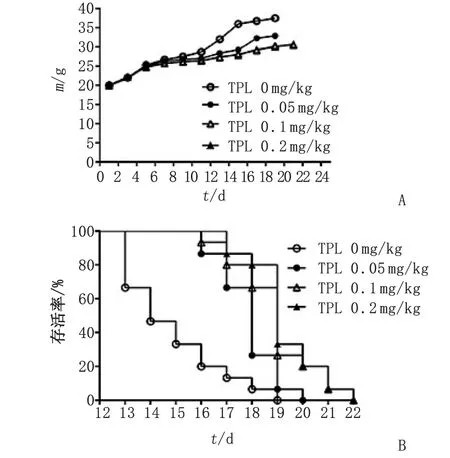
TPL:雷公藤内醇酯. A:TPL对腹水瘤小鼠体质量的影响;B:TPL对腹水瘤小鼠生存期的影响.图1 TPL对腹水瘤小鼠体质量和生存期的影响Fig 1 Effects of TPL on the weight and survival of ascites tumor mice
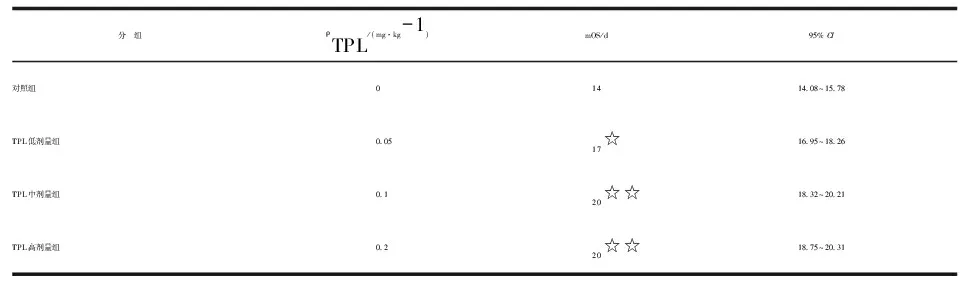
分 组ρTPL/(mg·kg-1)mOS/d95% CI对照组01414.08~15.78TPL低剂量组0.0517☆16.95~18.26TPL中剂量组0.120☆☆18.32~20.21TPL高剂量组0.220☆☆18.75~20.31
n=15. TPL:雷公藤内酯醇; mOS:中位生存期;CI:置信区间. 与对照组比较,☆:P<0.05; ☆☆:P<0.01.
2.2TPL对小鼠腹水和腹水中肿瘤细胞数的影响 TPL各剂量组的腹水体积和每毫升腹水肿瘤细胞数较对照组减少(P<0.05,P<0.01,表2),作用具有浓度依赖性。
表2TPL对腹水以及腹水肿瘤细胞数的影响。
Tab2Effects of TPL on the growth of ascites and the number of tumor cells in ascites
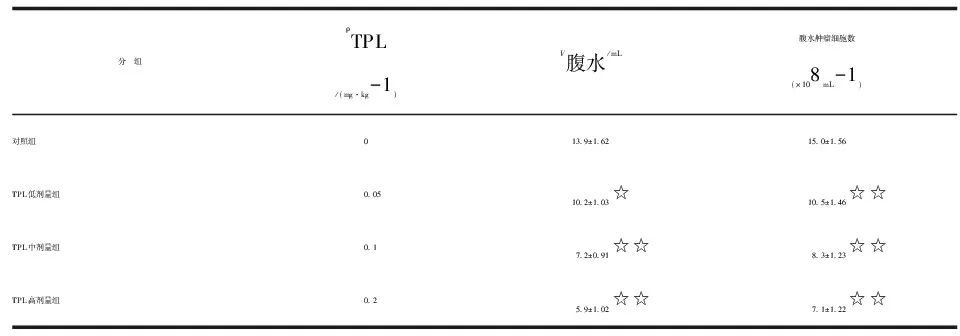
分 组ρTPL/(mg·kg-1)V腹水/mL腹水肿瘤细胞数(×108 mL-1)对照组013.9±1.6215.0±1.56TPL低剂量组0.0510.2±1.03☆10.5±1.46☆☆TPL中剂量组0.17.2±0.91☆☆8.3±1.23☆☆TPL高剂量组0.25.9±1.02☆☆7.1±1.22☆☆
n=5. TPL:雷公藤内酯醇. 与对照组比较,☆:P<0.05,☆☆:P<0.01.
2.3TPL对小鼠腹水中肿瘤细胞凋亡的影响 TPL各剂量组的腹水肿瘤细胞凋亡率均较对照组明显增加,对照组、低、中、高剂量组的细胞总凋亡率分别为(11.08±4.12)%,(22.04±3.50)%,(32.38±4.47)%及(43.22±6.36)%,单因素方差分析表明,药物浓度对细胞凋亡影响显著,各组之间两两比较,差别具有统计学意义(图2)。
2.4流式细胞术测定TPL对PD-L1的表达的影响 TPL低、中、高剂量组的H22细胞PD-L1蛋白表达水平明显低于对照组(图3),单因素方差分析表明,药物浓度对PD-L1表达影响显著(P<0.01),且TPL低、中、高剂量组 PD-L1蛋白表达两两比较差别亦有显著性。随着TPL药物剂量增加,PD-L1表达水平降低,提示TPL可下调肝癌H22细胞PD-L1的表达,且其下调蛋白表达作用具有浓度依赖性。

TPL:雷公藤内醇酯. A:流式细胞技术分析;B:统计学分析. 不同浓度间比较,☆:P<0.05,☆☆:P<0.01.图2 TPL对腹水瘤细胞凋亡的影响Fig 2 Effects of TPL on tumor cell apoptosis in mouse ascites
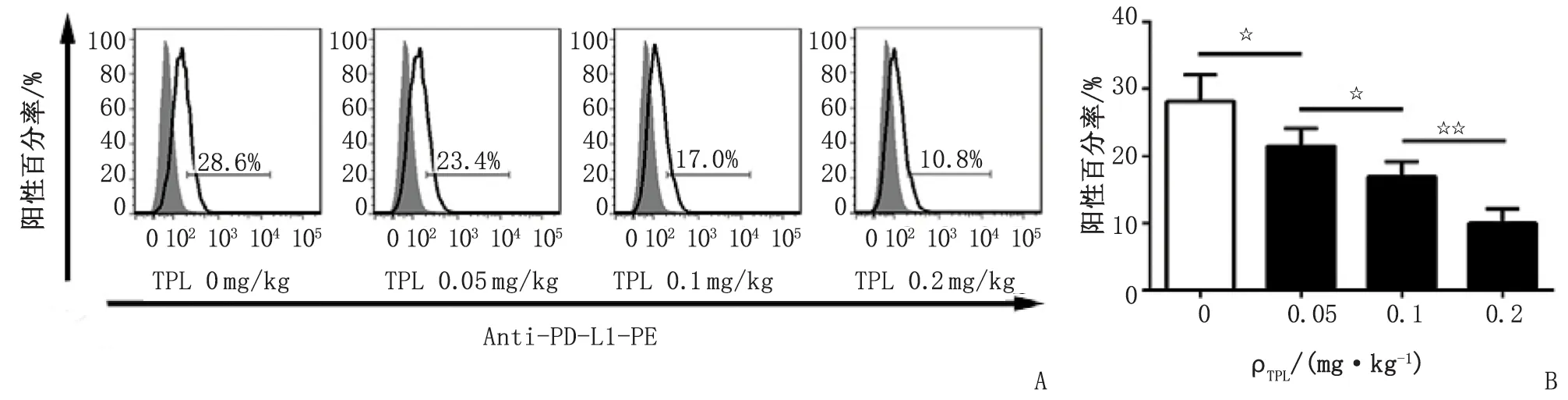
TPL:雷公藤内酯醇. A:流式细胞技术分析;B:统计学分析. 不同浓度间比较,☆:P<0.05,☆☆:P<0.01.图3 TPL对腹水瘤细胞PD-L1蛋白表达的影响Fig 3 Effects of TPL on the expression of PD-L1 on tumor cell in mouse ascites
3 讨 论
TPL是中药雷公藤的主要有效成分之一,具有高效广谱抗肿瘤的作用。目前,TPL的抗肿瘤作用机制尚不明确,早期的研究认为TPL通过抑制细胞核苷酸转运体系而抑制DNA、RNA的合成,尤其是对DNA合成的抑制。近年来研究显示,TPL可以通过多种途径诱导肿瘤细胞的凋亡,如TPL可以激活凋亡信号传导的关键分子caspase 3及p53,丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPK)等多种信号通路来诱导肿瘤细胞凋亡[11,14-15]。本研究发现,经TPL作用后,小鼠H22腹水瘤细胞发生了典型的凋亡变化,提示TPL可以诱导H22细胞凋亡,且与对照组比较,经过TPL作用后的小鼠腹水量及腹水瘤细胞数均减少,生存期提高,表明TPL可能通过诱导H22细胞凋亡进而发挥抗肿瘤作用。
PD-L1也称B7-H1、CD274,是PD-1的配体之一,表达于活化的T细胞、B细胞、NK细胞等。有研究表明,PD-L1在多种人类肿瘤中高表达,如肝癌、卵巢癌、胃癌等。近年来研究表明,负性共刺激分子PD-L1 异常表达可以促使T细胞凋亡,从而抑制机体的免疫功能,使肿瘤细胞发生免疫逃逸,促进了肿瘤细胞的生长。研究表明,沉默PD-L1的表达可以有效诱导A549癌细胞凋亡[16],提示PD-L1蛋白可能与肿瘤细胞凋亡关系密切。PD-L1在淋巴瘤组织中高表达,并且可以促进肿瘤的生长,并能通过抗凋亡抵制顺铂对肿瘤的杀伤作用[17]。越来越多的证据表明,PD-L1可能成为预测肝癌进展和预后的新分子标志物, 阻断PD-L1/PD-1信号通路有望成为肝癌免疫治疗的新策略。本实验结果显示,不同剂量的TPL均可下调PD-L1的表达,且不同程度的诱导肿瘤细胞的凋亡,提示TPL抗肝腹水瘤作用可能与下调肿瘤细胞表面标志蛋白PD-L1有关,二者之间的内在联系有待进一步深入研究。

